Белки-транспортеры кремния: долгий путь к открытию
Для описания способа, которым диатомовые водоросли строят свои «стеклянные» домики из кремнезема, покрытые изысканными орнаментами микро- и нанометрового масштаба, сегодня используют термин «кремниевые нанотехнологии». Один из главных этапов этой технологии – транспортировка кремниевой кислоты из окружающей среды, где ее концентрации довольно низки, особенно в пресной воде. Осуществляют эту работу уникальные белки, способные связываться с кремниевой кислотой без ее полимеризации, причем из-за их «неуловимости» все заключения о структуре и работе активного центра этих белков приходится делать исключительно на основе анализа данных «расшифровки» соответствующих генов и генных фрагментов
«Единственный способ определить границы
возможного – выйти за эти границы».
Артур Кларк
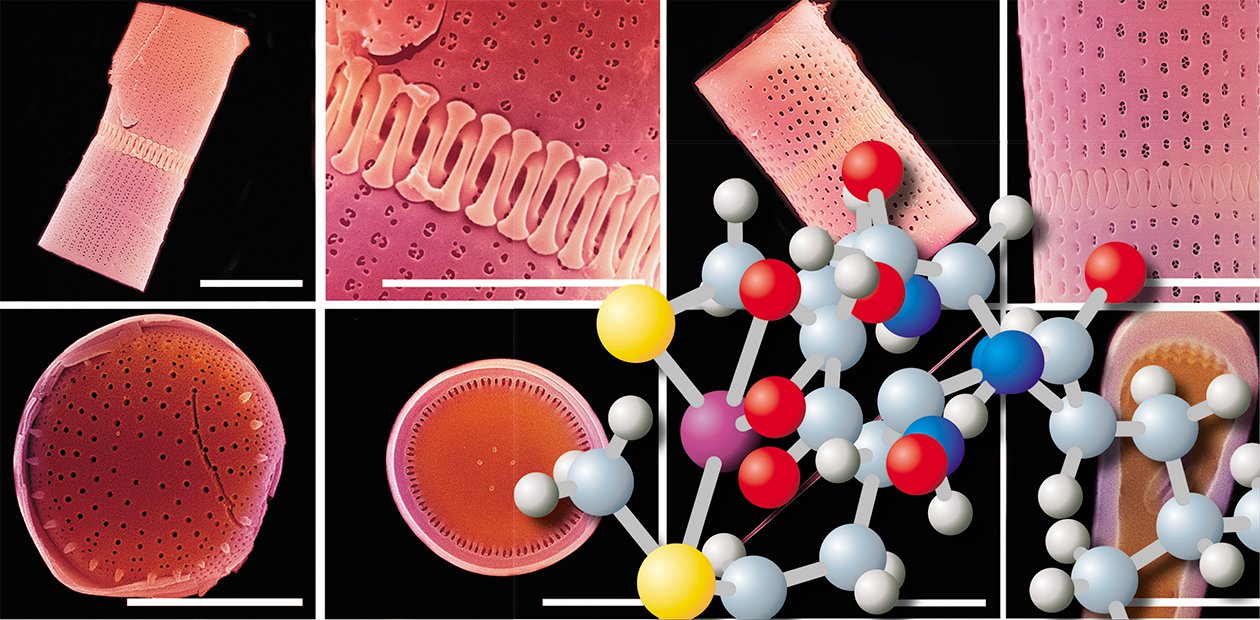
Поразительной красоты и прочности панцири диатомовых водорослей – впечатляющий пример микро- и наноструктурированного природного материала. Несмотря на то что эти удивительные микроводоросли известны еще с XVIII в., современные молекулярные биологи пока не обладают полными данными о том, как диатомеи преобразуют информацию, закодированную в геномах, в эти сложные кремнистые конструкции.
В том числе недостаточно изучены и такие базовые этапы процесса формирования элементов панциря водорослей, как захват кремниевой кислоты из окружающей среды и перенос ее в специальные органеллы, где происходит полимеризация кремния. Говоря о кремнии, мы подразумеваем, что в действительности створка диатомей построена не из кремния, а из кремнезема (SiO2·H2O), а в клетку поступает не чистый кремний, а свободная кремниевая кислота (Si(OH)4).
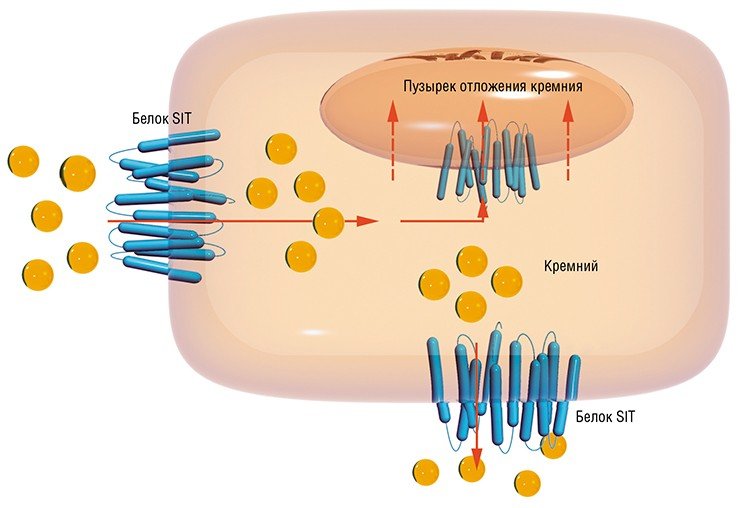
И здесь диатомовые водоросли сталкиваются с двумя проблемами: во-первых, они должны забирать кремниевую кислоту из среды против очень «крутого» градиента концентраций, а во-вторых, при концентрациях, превышающих 2 мМ, она начинает самопроизвольно полимеризоваться (Таматракольн, Хильдебранд, 2006). Чтобы успешно транспортировать из воды кремний, диатомеи должны связывать ее с такими органическими молекулами, как белки.
Неуловимые SIT
Первые данные о потенциальных белках-транспортерах кремния (silicon transporters – SITs) были опубликованы для морской диатомеи Cylindrotheca fusiformis в конце прошлого века (Hildebrand et al., 1997). Сотрудникам Института океанографии Скриппса Калифорнийского университета (Сан-Диего, США) удалось установить нуклеотидную последовательность пяти генов, образующих близкородственное семейство. Дальнейший анализ предсказанных аминокислотных последовательностей дал основания утверждать, что эти белки являются хорошими кандидатами на роль переносчиков кремниевой кислоты (Hildebrand et al., 1998).
После выхода этих работ у группы ученых Лимнологического института СО РАН под руководством академика М. А. Грачева возникла идея изучить белки SIT у байкальских диатомей. В качестве основного объекта исследований был выбран обитающий в Байкале вид диатомовой водоросли рода Synedra, широко распространенного в пресноводных водоемах.
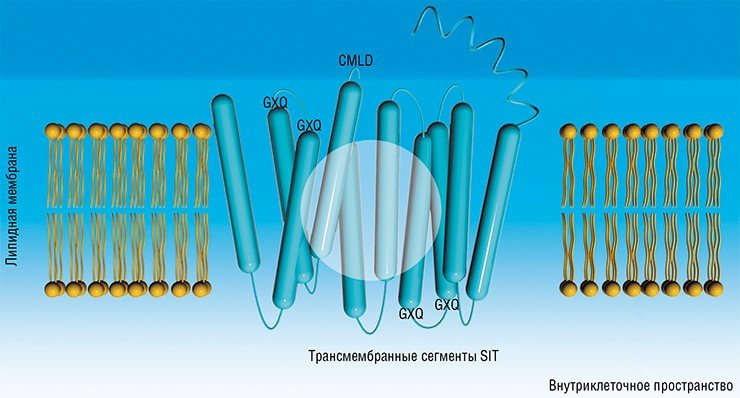
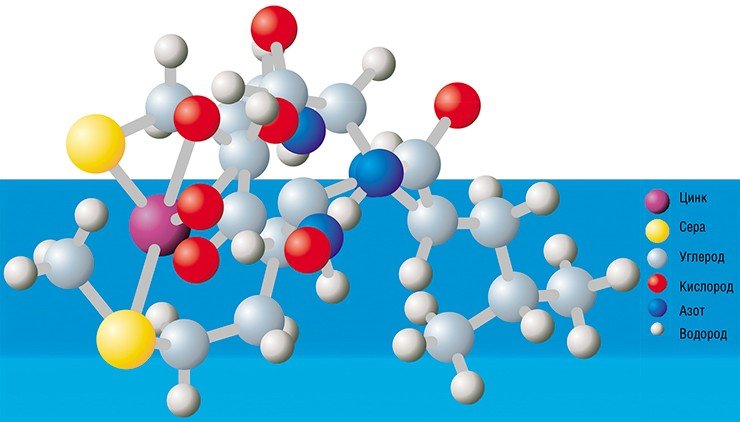
На основе сравнительного анализа аминокислотных последовательностей белков у двух видов – байкальской S. acus subsp. radians и морской C. fusiformis, разделенных между собой эволюционной дистанцией в несколько десятков миллионов лет, предполагалось выявить элементы, которые могли бы входить в состав активного центра этих белков. В результате внимание исследователей привлекла последовательность CMLD, представляющая собой так называемый консервативный мотив, т. е. короткую последовательность аминокислотных остатков, которая не претерпела изменений в процессе эволюции. Прилегающие к этому мотиву участки также оказались сходными у двух видов водорослей (Грачев и др., 2002). Была высказана гипотеза, что этот мотив в белках SIT связывает ион цинка, который, в свою очередь, служит акцептором кремниевой кислоты.
Позже как в ЛИН СО РАН, так и за рубежом на основе изучения генных последовательностей были получены новые данные об аминокислотных последовательностях белков SIT. Их сравнительный анализ показал значительную вариабельность SIT-белков, однако их гомология при этом была столь очевидна, что могла свидетельствовать о большом давлении естественного отбора в процессе адаптации водорослей к условиям среды обитания.
Следуя гипотезе происхождения диатомовых водорослей от хризофитовых, были предприняты попытки поиска генов sit у водорослей из этой группы, которые увенчались успехом (Лихошвай и др., 2006). Таким образом, стало ясно, что белки-транспортеры кремния имеют очень древнюю эволюционную историю, так как диатомовые водоросли появились лишь около 240 млн лет назад, а хризофитовые – 600 млн лет назад. Наличие в белках хризофитовых мотива CMLD явилось еще одним аргументом в пользу гипотезы о его важной роли в функционировании этих загадочных белков.
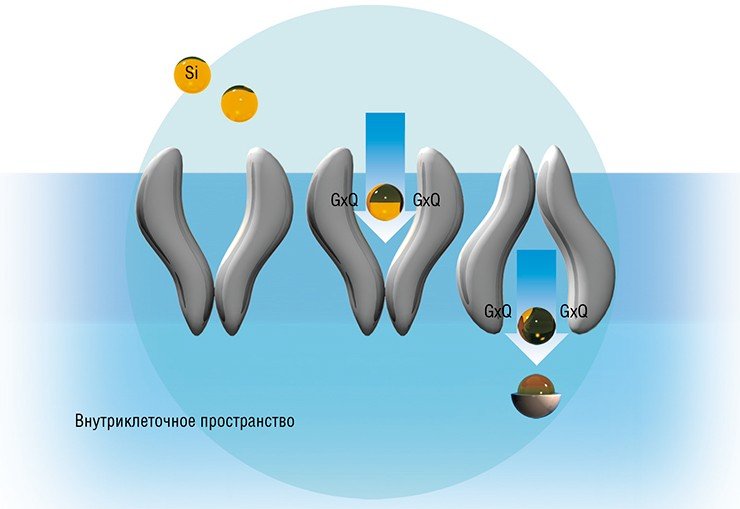
В 2006 г. наши американские коллеги, продолжив работу на других видах диатомей, выдвинули гипотезу о роли в транспорте кремния других консервативных аминокислотных мотивов – GxQ, расположенных в трансмембранных (т. е. встроенных в клеточную мембрану) доменах белков SIT. Согласно их предположению, остаток кремниевой кислоты первоначально связывается с двумя из этих последовательностей, расположенных с внешней стороны клетки. Вслед за этим белок SIT претерпевает радикальную перестройку своей третичной структуры – этот конформационный переход напоминает выворачивание зонтика, в результате чего кремниевая кислота «отрывается» от «внешних» мотивов GХQ и связывается с мотивами, расположенными уже с внутренней стороны клеточной мембраны. В итоге кремниевая кислота попадает в цитоплазму клетки.
2008 г. ознаменовался своеобразным подведением итогов исследований в области белков-транспортеров кремния: авторы двух разных гипотез независимо друг от друга обобщили весь свой полученный материал, приведя весомые аргументы в пользу той или другой гипотезы (Hildebrand, 2008; Grachev et al., 2008).
Еще раз отметим, что все эти гипотезы были выдвинуты исключительно на основе информации, полученной в результате расшифровки фрагментов генов и небольшого числа полных генов, так как выделить сам белок SIT в чистом виде и провести его рентгеноструктурный анализ до сих пор не удалось. Лишь в 2007 г., спустя почти десятилетие после обнаружения генов sit, иркутские, а затем американские исследователи подтвердили высокочувствительным методом иммуноблоттинга реальное наличие белков SIT в протеомах нескольких видов диатомовых.
Правила умножения генов
Благодаря усилиям ученых из разных стран стало появляться все больше данных относительно структуры генов sit у разных видов диатомей, однако чаще всего речь шла об их отдельных фрагментах. Что касается полноразмерных генов, то информация о них была значительно расширена благодаря секвенированию геномов двух морских диатомей – Thalassiosira pseudonana и Phaelodactilum tricornutum (Armbrust et al., 2004; Bowler et al., 2008).
Поставив задачу секвенировать полную последовательность гена sit у байкальской синедры, исследователи из ЛИН СО РАН сразу столкнулись с большими трудностями. В 2007 г. с помощью полимеразной цепной реакции (ПЦР) со специфическими праймерами («затравками» для синтеза комплементарной цепи ДНК) и секвенирования по методу Сэнгера в генетическом материале водоросли удалось идентифицировать протяженную последовательность этого гена, однако его стартовый кодон – тройка нуклеотидов, с которой начинается процесс синтеза белка в рибосоме, так и не был обнаружен. Вопрос о «прочтении» полного гена sit у байкальской диатомеи несколько лет оставался открытым.
Большое значение в дальнейшем поиске сыграли новый метод культивирования водорослей, «чистых» от бактерий и других одноклеточных (Shishlyannikov et al., 2011) и проект расшифровки полного генома S. acus subsp. radians с использованием методов массового параллельного секвенирования, стартовавший в ЛИН СО РАН в 2008 г. Так как благодаря результатам секвенирования других видов диатомовых уже было известно о наличии у них сразу нескольких генов sit, этот проект открыл возможность «разобраться» как с числом и структурой искомых генов, так и их местоположением в геноме (кстати сказать, больше половины из известных на сегодня полных последовательностей генов sit были получены благодаря «прочтению» именно полных геномов).
В рамках этого проекта совместно с сотрудниками московского Центра «Биоинженерия» РАН достаточно быстро удалось «собрать» полные геномы митохондрий и хлоропластов синедры (Ravin et al., 2010; Galachyants et al., 2012), однако ген sit все еще оставался неуловимым. Наконец, в 2012 г. при анализе данных предварительной сборки полного генома S. acus subsp. radians был найден участок, где располагалась нуклеотидная последовательность, имевшая лишь точечные отличия от ранее обнаруженной генной структуры. Эта последовательность ДНК кодировала полипептид, содержащий все характерные для белка SIT консервативные элементы, а также имеюший стартовый остаток метионина в начале последовательности.
Таким образом, появились все основания говорить об открытии первого полноразмерного гена sit у представителя байкальских диатомовых, что было подтверждено в совместной работе с к. х. н. А. А. Бондарем из ЦКП «Геномика» СО РАН (Новосибирск).
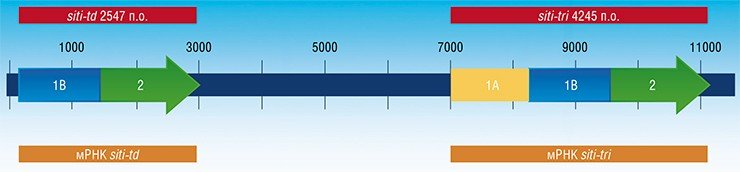
В конечном счете удалось выяснить, что кластер генов sit у синедры состоит из двух неожиданно «длинных» генов, расположенных в одном участке хромосомы, – «удвоеннного» sit-td и «утроенного» sit-tri, длина которых почти в 2 и 3 раза, соответственно, превышает длину всех известных полноразмерных генов семейства sit. В хромосоме эти гены разделены расстоянием в несколько тысяч пар нуклеотидов. Каждый из них кодирует, соответственно, 2 и 3 функциональные белковые единицы SIT, содержащие все их специфические консервативные элементы.
Открытие генов sit у байкальской синедры породило и новые загадки: судя по результатам вышеупомянутых иммунохимических исследований, белки SIT у этой водоросли имеют массу около 66 кДа, но исходя из расшифрованных генных последовательностей, их масса должна была превышать 92 и 110 кДа. Чтобы проверить, не являются ли найденные гены «псевдогенами» (не транслируемыми), а также определить длину считываемой с генов матричной РНК, была получена суммарная РНК клеток водоросли, а на ее основе – «библиотека» комплементарной ДНК.
Оказалось, что в клетках байкальской синедры действительно присутствуют «длинные» мРНК, последовательности которых точно соответствуют обнаруженным генам. Эта находка означает, что там теоретически могли бы находится и белки с очень большой молекулярной массой, чего в реальности не наблюдается. Однако ответа на вопрос, как и на каком этапе трансляции генетической информации происходит «укорочение» мРНК и формирование белков «обычной» длины, пока нет.
К 2015 г. в мире было идентифицировано лишь 15 полных последовательностей генов, кодирующих белки транспорта кремния, для шести видов морских диатомовых водорослей. Спустя 13 лет после начала в нашей стране подобных работ удалось открыть и характеризовать первые полноразмерные гены sit, принадлежащие пресноводному представителю диатомей.
Обнаруженный у байкальской S. acus subsp. radians кластер генов sit в виде «тандем+триплет» не встречался ни у одной из уже исследованных диатомей, для которых характерно наличие 3–5 отдельных генов sit «обычной» длины. Особый интерес вызывает тот факт, что «нестандартные» гены были обнаружены у вида, обитающего в пресноводном озере, что может быть связано с приспособлением к новым условиям обитания.
Анализ структурной организации генов, кодирующих белки транспорта кремния у диатомей и других кремний-зависимых организмов, позволит понять, каким образом шла эволюция этих уникальных белков. Без них одноклеточные водные организмы не смогли бы использовать «вредный» кремний окружающей среды для «полезного» строительства защитных панцирей и опорных прочных элементов экзоскелета. Новые организмы, которые появились благодаря белкам-транспортерам и активно эволюционировали, изменили биосферу нашей планеты.
Литература
Грачев М. А., Деникина Н. Н., Беликов С. И и др. Элементы активного центра белков транспорта кремниевой кислоты в диатомовых водорослях // Молекуляр. биология. 2002. Т. 36, № 4. С. 379—681.
Лихошвай Е. В., Масюкова Ю. А., Щербакова Т. А., и др. Обнаружение гена транспорта кремниевой кислоты у хризофитовых водорослей // Докл. РАН. 2006. Т. 408. С. 845—849.
Armbrust E. V., Berges J. A., Bowler C. et al. The genome of the diatom Thalassiosira pseudonana: ecology, evolution, and metabolism // Science. 2004. V. 306. P. 79—86.
Bowler C., Allen A. E., Badger J. H. et al. The Phaeodactylum genome reveals the evolutionary history of diatom genomes // Nature. 2008. V. 456. P. 239—244.
Galachyants Y.P., Morozov Al.A., Mardanov A.V. et al. Complete Chloroplast Genome Sequence of Freshwater Araphid Pennate Diatom Alga Synedra acus from Lake Baikal // Intern. J. of Biol. 2012. V. 4(1). P. 27—35.
Grachev M. A., Annenkov V. V., Likhoshway Ye. V. Silicon nanotechnologies of pigmented heterokonts // BioEssays. 2008. V. 30. P. 328—337.
Grachev M., Sherbakova T., Masyukova Yu. et al. A potentional Zinc-binding motif in silicic acid transport proteins of diatoms // Diatom Res. 2005. V. 20, N 2. P. 409—411.
Hildebrand M., Volcani B. E., Gassmann W. et al. A gene family of silicon transporters // Nature. 1997. V. 385. P. 688—689.
Hildebrand M., Dahlin K., Volcani B. E. Characterization of a silicon transporter gene family in Cylindrotheca fusiformis: sequences, expression analysis, and identification of homologs in other diatoms // Mol. Gen. Genet. 1998. V. 260. P. 480—486.
Hildebrand M. Diatoms, Biomineralization Processes, and Genomics // Chem. Revi. 2008. V. 108, N. 11. P. 4855—4874.
Ravin N. V., Galachyants Y. P., Mardanov A. V. et al. Complete sequence of the mitochondrial genome of a diatom alga Synedra acus and comparative analysis of diatom mitochondrial genomes // Curr. Genet. 2010. V. 56(3). P. 215—223.
Shishlyannikov S. M., Zakharova Y. R., Volokitina N. A. et al. A procedure for establishing an axenic culture of the diatom Synedra acus subsp. radians (Kutz.) Skabibitsch. from Lake Baikal // Limnol. Oceanogr.: Methods. 2011. V. 9. P. 478—484.
Работа поддержана программой Президиума РАН «Молекулярная и клеточная биология»