Из твердого – в твердое
Механика химических превращений
Химия, как и любая другая наука, столь многообразна, что накопленные в этой области знания приходится классифицировать по «полочкам»: химия органическая, неорганическая, физическая и т. д. О первых двух получает представление даже учащийся средней школы, но вот что представляет собой химия твердого тела, известно далеко не каждому выпускнику вуза. Однако многие проблемы этой науки, лежащей на пересечении химии, физики и даже механики, интересны не только специалистам, но и любому человеку, который хочет знать, как устроен окружающий нас мир
 Основатель сибирской школы химиков-«твердотельщиков» академик В. В. Болдырев в первой лекции по курсу химии твердого тела (ХТТ) для студентов так формулирует три составных части этого предмета: «дефекты + процессы переноса + фазовые превращения».
Основатель сибирской школы химиков-«твердотельщиков» академик В. В. Болдырев в первой лекции по курсу химии твердого тела (ХТТ) для студентов так формулирует три составных части этого предмета: «дефекты + процессы переноса + фазовые превращения».
Этими немногими понятиями удается обрисовать всю специфику и область приложения ХТТ. Дефекты – это любые неоднородности объекта, и они присущи только твердым телам в отличие от газов или жидкостей. Поскольку в твердых веществах мигрирующим атомам приходится буквально «протискиваться» сквозь плотно упакованную сеть прочно связанных друг с другом атомов, то перенос вещества требует больших затрат энергии. А что касается фазовых переходов, то в газах и жидкостях это явление в принципе отсутствует. И все эти три феномена существенно отражаются на реакционной способности твердых веществ.
Но, как говорил Козьма Прутков, «нельзя объять необъятное». И все же – можно ли выделить только одну, главную особенность химических реакций твердых веществ? Какое же свойство в первую очередь отличает «твердые» тела от «не твердых»?
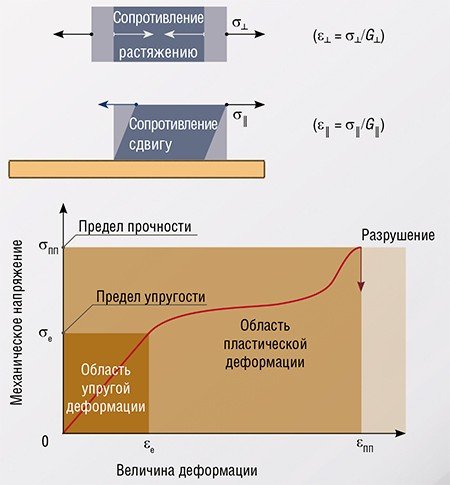
Конечно, это твердость! То есть, согласно школьному курсу физики, способность тел сохранять форму, сопротивляясь воздействию деформирующих сил. А на языке университетской физики – наличие упругих свойств.
За пределом упругости
При любом превращении веществ, в котором хотя бы один исходный реагент и один конечный продукт – твердые и находятся в контакте (будем называть такие превращения твердофазными, ТП), как правило, происходит изменение атомной структуры вещества, сопровождаемое увеличением либо уменьшением объема. Разбухание (или наоборот, сокращение) реагирующего материала приводит к возникновению упругих механических напряжений в области контакта между исходным и новообразованным веществом. Очевидно, что через изменение локального давления возникающие напряжения непосредственно влияют на условия протекания реакции. Кроме того, релаксируя, эти напряжения порождают в кристаллической структуре дефекты, т. е. нарушения упорядоченности строения, которые, в свою очередь, также могут влиять на условия превращения веществ.
 Одна из простых моделей кристаллических тел – идеальный кристалл, где атомы расположены в строгом порядке во всех направлениях. Но «в мире нет совершенства», и мир кристаллов не исключение: их идеальность нарушается дефектами. Они бывают трех типов: дефекты поверхности (которыми являются грани кристаллов, границы зерен, межфазные границы); линейные дефекты (дислокации); точечные дефекты (межузельные атомы и др.).
Одна из простых моделей кристаллических тел – идеальный кристалл, где атомы расположены в строгом порядке во всех направлениях. Но «в мире нет совершенства», и мир кристаллов не исключение: их идеальность нарушается дефектами. Они бывают трех типов: дефекты поверхности (которыми являются грани кристаллов, границы зерен, межфазные границы); линейные дефекты (дислокации); точечные дефекты (межузельные атомы и др.).
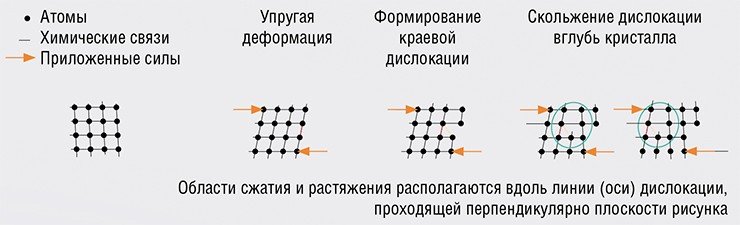
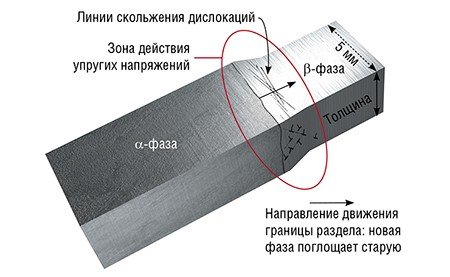
Пластическая деформация твердых тел обусловлена перемещением дислокаций, которые можно себе представить в виде обломанного края атомной полуплоскости внутри кристалла. Наиболее эффективный механизм – скольжение дислокации (движение ее в направлении, перпендикулярном этой полуплоскости). При перемещении дислокации на очередное межатомное расстояние происходит коллективное смещение атомов, примыкающих к оси дислокации.
Как только дислокация достигает противоположной грани кристалла, напряжение сбрасывается, две части кристалла снова становятся «идеальными», но сдвинутыми на одно межатомное расстояние – образуется «ступенька». В итоге осуществляется массоперенос сразу большого количества вещества, ведь ось дислокации пронизывает кристалл насквозь. Этот процесс аналогичен листанию страниц в толстой книге, по завершении которого она целиком оказывается на соседнем месте.
Другой тип движения дислокации – переползание – происходит параллельно оборванной атомной полуплоскости за счет перемещения по отдельности атомов, расположенных на оси дислокации. В конечном итоге составляющие лишнюю полуплоскость атомы уходят в вакансии или на поверхность кристалла, и дислокация, как и напряжение, исчезает. Подобный механизм массопереноса называют дислокационной ползучестью. Для его реализации требуется высокая диффузионная подвижность атомов, которая достигается при температуре, близкой к температуре плавления
Хотя систематических экспериментальных исследований динамики упругих напряжений при твердофазных превращениях не проводилось, их релаксация хорошо изучена смежной дисциплиной – физикой твердого тела. Разумеется, для создания таких напряжений физики используют не химическую реакцию, а физические способы воздействия, такие как растяжение, сжатие, сдвиг, неоднородный нагрев и т. п.
Что же произойдет, когда прилагаемая к телу нагрузка превысит предел упругости материала? Произойдет пластическая деформация тела, характеризующаяся необратимым смещением одной части тела относительно другой. Этот вид деформации обусловлен движением дислокаций – линейных дефектов кристалла.
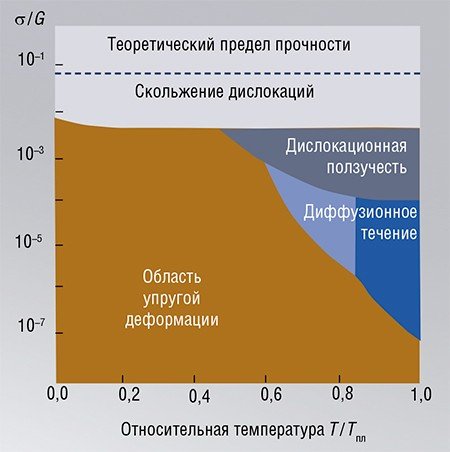
Различают несколько видов такого движения. Например, скольжение, которое можно сравнить с движением гусеницы, когда происходит последовательный перенос отдельных частей тела. При скольжении дислокаций имеет место коллективный характер перемещения атомов, в отличие от других механизмов массопереноса (ползучесть, диффузионное течение), которые наблюдаются в условиях, когда температура приближается к точке плавления материала.
Интересно, что механические свойства всех твердых материалов имеют общие черты, несмотря на разнообразие кристаллических структур и видов связи между атомами. Более того, на диаграммах разных веществ, построенных в координатах «температура / температура плавления» – «механическое напряжение / модуль сдвига», области, соответствующие различным типам деформации, практически совпадают. Это позволяет предсказывать наиболее вероятные механизмы релаксации напряжений в конкретных условиях.

Таким образом, внутренние механические напряжения, которые генерируются при самых разных твердофазных превращениях (фазовых переходах, химических реакциях разложения и обмена с участием металлов, ионных и ионно-ковалентных веществ), релаксируют либо через варианты пластической деформации, либо через разрушение или изменение формы.
Для некоторых модельных превращений удалось обнаружить и количественно описать механизм взаимного влияния изменений структуры и наводимых ими напряжений.
Самонаклеп как результат ползучести
Химические реакции твердых веществ идут как минимум в две стадии: собственно химическую (образование нового вещества) и структурную (формирование новой твердой фазы), что усложняет их изучение. В качестве модели структурной стадии, не отягощенной «химической спецификой», можно рассматривать переход из одной твердой фазы в другую – полиморфное превращение вещества без изменения его химического состава.
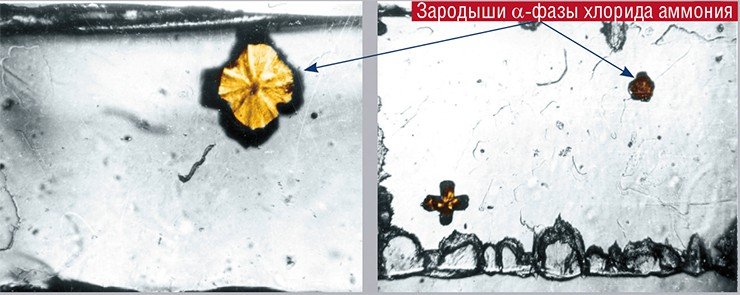
Хорошей моделью для изучения закономерностей перестройки кристаллической структуры является фазовый переход β → α в хлориде аммония NH4Cl, при котором плотность вещества уменьшается. Превращение начинается при температуре 457 K (184°C) и выше.

По известному значению модуля сдвига β-NH4Cl можно оценить порядок величины гидростатического давления, создаваемого на межфазной границе зародышем α-фазы, которое составляет несколько тысяч атмосфер. Однако согласно фазовой диаграмме NH4Cl, при таком давлении минимально необходимая температура начала полиморфного превращения должна быть выше на сотни градусов, чем реально наблюдаемая.
В действительности в тонких пластинчатых кристаллах β-NH4Cl фазовый переход происходит уже при перегреве в один градус. Подобное расхождение объясняется тем, что рассчитанное давление намного превышает предел упругости этого материала, поэтому рост зародышей приводит к пластической деформации. Происходит релаксация напряжений, давление снижается, и перегрев для осуществления реакции становится не нужным (Chupakhin et al., 1987). Ионный характер кристалла позволяет предположить, что механические напряжения, вызванные увеличением объема, вероятнее всего будут релаксировать через механизм скольжения дислокаций.
Из практики известно, что уменьшение размеров частиц обычно приводит к увеличению их реакционной способности. Однако при фазовом превращении того же олова наблюдается обратный эффект – с уменьшением толщины его скорость также уменьшается (Matvienko et al., 1997).
Почему так происходит? Уменьшение толщины образца приводит к укорочению зоны действия напряжений и, соответственно, зоны пластической деформации, что подтверждают оптические наблюдения. Протяженность зоны, в которой наблюдаются линии скольжения, уменьшается с утоньшением пластинки. Поскольку число генерируемых в единице объема дислокаций остается неизменным, в тонких образцах они вынуждены «тесниться» в более короткой зоне, что приводит к увеличению их средней плотности перед границей. В результате скольжение дислокаций затрудняется из-за их пересечения и упругого взаимодействия с другими дислокациями – соответственно, уменьшается и скорость движения межфазной границы
С течением времени рост зародышей замедляется вплоть до полной остановки. Торможение объясняется тем, что дислокации образуют густой «лес», в котором они начинают мешать продвижению друг друга. При этом релаксация напряжений путем скольжения все более затрудняется, и в конце концов происходит изменение механизма деформации на менее эффективную диффузионно-дислокационную ползучесть (за счет поочередной диффузии атомов вдоль оси дислокации). По сути это явление аналогично наклепу (механическому упрочнению материала вследствие пластической деформации) с той лишь разницей, что оно происходит под действием не внешних, а внутренних сил, почему и называется самонаклепом (Сидельников и др., 1985).
Легирование и допирование
Итак, напряжения, возникающие в результате твердофазного превращения, могут существенно влиять на ход самого превращения. Наличие такой обратной связи дает возможность регулировать этот процесс, целенаправленно меняя условия возникновения и релаксации напряжений. Например, затруднить процесс скольжения дислокаций в исходном веществе.
Именно так поступают при легировании металла – упрочнении его путем использования специальных добавок. Например, железо – металл сравнительно мягкий и поэтому практически не используется в чистом виде. Однако добавление очень небольших количеств углерода и некоторых других химических элементов значительно увеличивает его твердость. Механизм действия разных легирующих добавок может различаться, но часто они препятствуют как раз скольжению дислокаций в металле, что уменьшает его пластичность и увеличивает твердость.
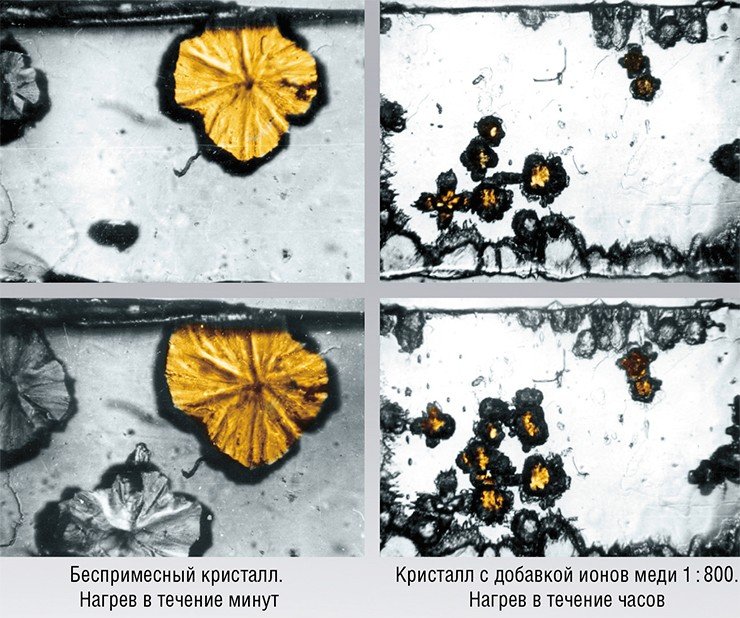
В случае ионных кристаллов эффективными стопорами скольжения дислокаций служат ионы с другой величиной заряда. В частности, к вышеупомянутым солям аммония для этой цели добавляют ионы Cu2+. Экспериментальные исследования показали, что такое допирование (так называют легирование в «неметаллической» химии) кристаллов NH4Cl действительно затрудняет скольжение дислокаций – длина их пути уменьшается, а твердость кристалла возрастает более чем на порядок. Фазового превращения такого кристалла при температуре перехода, стандартной для беспримесного соединения, вообще не происходит – необходим перегрев на десятки градусов.
Такие изменения происходят даже в том случае, если допировать лишь приповерхностный (не более 10 мкм в глубину) слой кристалла. При этом зародыши новой фазы появляются только в сердцевине кристалла, где температура начала превращения на 12—15 K выше, чем для беспримесных кристаллов. Поверхностный же допированный слой не испытывает превращения даже при 70-градусном перегреве.
Вот так изменение механического свойства кристалла – его твердости – позволило повысить температуру фазового перехода и изменить его кинетику.
Стеклянная метаморфоза
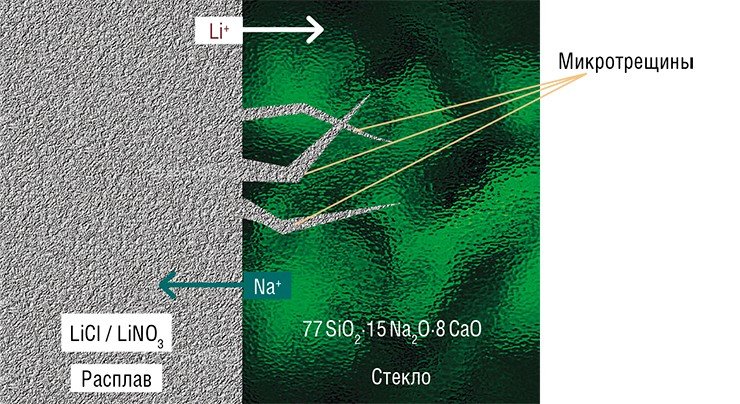
Фазовые переходы – тема интересная и важная для понимания того, как устроен «твердотельный» мир, но все же химия – это в первую очередь химические реакции и образование новых веществ. Огромное влияние напряжений на кинетику твердофазных химических превращений можно продемонстрировать на примере обычного стекла, в котором протекает реакция ионного обмена.
Изменение объема при замещении иона натрия на меньшего размера ион лития невелико – около 5 %. Но, в отличие от кристаллических хлорида аммония и олова, стекло – материал аморфный. Направленность химических связей и отсутствие упорядоченности в расположении ионов делает невозможным образование в нем дислокаций. Значит, напряжения должны приводить к разрушению – именно потому-то стекло и хрупкое!

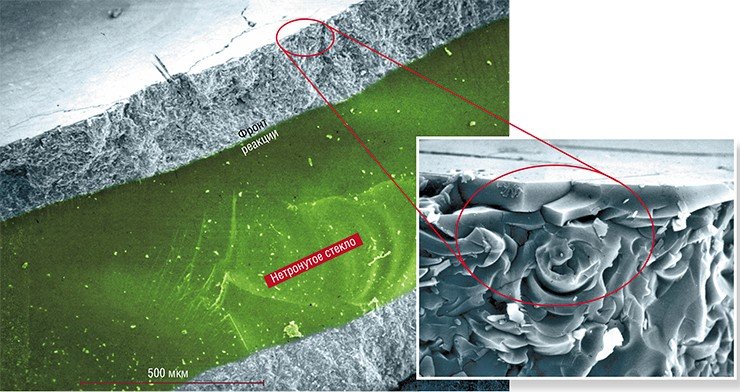
Неудивительно, что в ходе вышеупомянутой реакции вид стекла значительно меняется. После полного протекания реакции материал сохраняет целостность, но теряет прозрачность, становится «матовым» (Chizhik et al., 2007).
Интересно отметить, что форма и характерные размеры фрагментов разрушения при этом гораздо сильнее зависят не от температуры проведения реакции, а от состава расплава.
Так, при реакции стекла с нитратным расплавом разрушение происходит путем откола фрагментов в виде пластинок неправильной формы. А при реакции с хлоридными расплавами трещины выстраиваются в сетку из почти правильных шестиугольников. Движение этой сетки вглубь стекла вслед за реакционным фронтом приводит к разбиению стекла на граненые столбики (колонны) (Chizhik et al., 2008).
Причина этих отличий – в разных фазовых диаграммах систем «LiNO3 – NaNO3» и «LiCl – NaCl», или другими словами, в том, что температура плавления хлорида натрия много выше, чем нитрата. Поэтому в хлоридных расплавах, в отличие от нитратных, образуются твердые выделения. Они закупоривают трещины, по которым расплав протекает к реакционному фронту. Из-за этого напряжения в реакционной зоне приобретают определенную пространственную конфигурацию, в которой трещины могут устойчиво продвигаться только перпендикулярно фронту и выстраиваться в упорядоченную шестиугольную сетку. Напряжения, возникающие при реакции в нитратном расплаве, не позволяют трещинам распространяться так же устойчиво – они постоянно сворачивают параллельно фронту реакции.

Эти предположения удалось подтвердить косвенным экспериментом в смешанных хлоридно-нитратных расплавах, где были реализованы переходные режимы между упорядоченным и хаотическим.
Отметим, что такой феномен пространственного упорядочивания (самоорганизации) вещества в физико-химических процессах давно известен: это и шестиугольные ячейки Бенара, возникающие при нагревании тонких слоев жидкости – результат упорядоченной конвекции; и кольца Лизеганга – упорядоченная структура продуктов некоторых реакций. Однако образование колоннад при ионном обмене в стекле, которое исходно является изотропным материалом, относится к новому классу таких процессов.
Курильская Мостовая гигантов
Конечно, рассматривать картинки различных типов растрескивания химически реагирующего стекла забавно и поучительно, но есть ли польза от таких занятий «народному хозяйству»?
 Оказывается, есть! На основе концепции обратной связи между химической реакцией и разрушением твердого тела, была построена макрокинетическая модель. Важнейшим параметром модели является характеристика, отражающая масштаб минимально возможного разрушения (Chizhik et al., 2007; 2008). Эта величина возникает как следствие закона сохранения энергии: работа, затраченная на образование новой поверхности, равна энергии механических напряжений, высвобождаемой при образовании трещины (как в вышеописанной задаче о разрушении стекла).
Оказывается, есть! На основе концепции обратной связи между химической реакцией и разрушением твердого тела, была построена макрокинетическая модель. Важнейшим параметром модели является характеристика, отражающая масштаб минимально возможного разрушения (Chizhik et al., 2007; 2008). Эта величина возникает как следствие закона сохранения энергии: работа, затраченная на образование новой поверхности, равна энергии механических напряжений, высвобождаемой при образовании трещины (как в вышеописанной задаче о разрушении стекла).
Эта модель применима для описания широкого круга реакций термического разложения типа АВтв = Атв + Вгаз (например, дегидратация кристаллогидратов, гидроксидов, превращение карбонатов в оксиды и др.). Твердофазный продукт А таких реакций сформирован в виде так называемой псевдоморфозы, повторяющей форму исходного кристалла, которая состоит из отдельных фрагментов и содержит пустоты.
Величина механических напряжений и, соответственно, размер фрагментов образующегося продукта в первую очередь определяется величиной усадки, которая обычно известна. Несмотря на имеющиеся ограничения, модель позволяет оценить минимально возможный блок дробления, т.е. предсказать, на кусочки какого размера разрушится кристалл при химической реакции. Это важно для прогнозирования свойств образующихся при реакциях веществ (Сидельников, 2011).
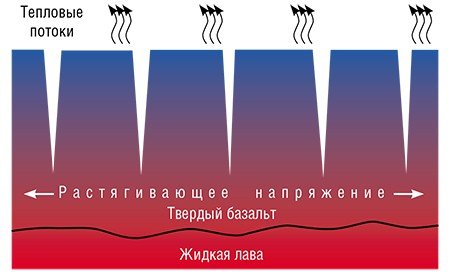
Но и это не все: на основе этой модели оказалось возможным описать механизм формирования природного феномена, чей возраст составляет многие миллионы лет! Речь идет об одном из чудес природы – «Мостовой гигантов» в Северной Ирландии. Это образование состоит из базальтовых колонн, достигающих метра в поперечнике и десятков метров в длину. Подобных колоннад в мире обнаружено много, для них имеется даже специальный термин – «столбчатые отдельности». Встречаются и базальтовые отдельности с хаотическими трещинами.
Адекватной модели, количественно описывающей возникновение упорядоченной колоннады из расплава, пока не создано, хотя попыток было немало. Если использовать здесь вышеописанную модель диспергирования стекла при ионном обмене, то в качестве аналога явления диффузии ионов к реакционному фронту будет выступать теплоотвод. Ведь процесс затвердевания базальта происходит с выделением тепла, и чем интенсивнее оно отводится, тем быстрее будет продвигаться вглубь расплавленного базальтового слоя фронт затвердевания.

Математические выражения для описания диффузии и теплопереноса одинаковы. Удельный объем базальта меньше, чем его расплава (как и объем литиевого стекла меньше объема исходного натриевого), поэтому возникают растягивающие напряжения. Применение модели, созданной для описания процесса ионного обмена в стекле, позволило предсказать размер базальтовых столбов и описать кинетику их роста в зависимости от условий теплообмена при затвердевании лавы.
В химии XXI в. преобладает микроскопический подход, ведь химические реакции – это изменения состояния валентных электронов. Исследования реакционной способности ушли в такие «тонкости», как особенности фемтосекундных процессов, положения колебательных и вращательных энергетических уровней молекул и т. п. Так не анахронизмом ли сегодня является феноменологический подход, когда вещества и реакции различают не по химической природе, а по таким сугубо макроскопическим параметрам, как различие в удельном объеме, поверхностной энергии и другим явно не химическим признакам?
 Развитие, которое получила теория кинетики химических реакций в газах и жидкостях, обеспечено возможностью простого и прямого управления условиями протекания таких реакций: всегда можно задать или измерить температуру, давление и концентрации реагентов в реакционном сосуде, реакторе. Но твердофазная реакция протекает не просто в каком-то внешнем сосуде – она протекает в зоне, которая формируется в результате самой реакции. Именно эта зона и есть «реактор» твердофазной реакции, который существует до тех пор, пока идет сама реакция. Такие образования принято называть диссипативными структурами, а самым интересным их свойством является способность к самоорганизации.
Развитие, которое получила теория кинетики химических реакций в газах и жидкостях, обеспечено возможностью простого и прямого управления условиями протекания таких реакций: всегда можно задать или измерить температуру, давление и концентрации реагентов в реакционном сосуде, реакторе. Но твердофазная реакция протекает не просто в каком-то внешнем сосуде – она протекает в зоне, которая формируется в результате самой реакции. Именно эта зона и есть «реактор» твердофазной реакции, который существует до тех пор, пока идет сама реакция. Такие образования принято называть диссипативными структурами, а самым интересным их свойством является способность к самоорганизации.
Прежде чем перейти на микроскопический уровень в описании кинетики твердофазных реакций, необходимо изучить принципы самоорганизации такого реактора. Конечно, исследование строения реакционной зоны затруднено ее малой пространственной протяженностью (как правило, речь идет о нанометрах) и множеством взаимовлияющих физико-химических процессов, в ней протекающих. Но без этого шага продвижение в понимании механизма твердофазных превращений невозможно.
Литература
Сидельников А. А., Чупахин А. П., Болдырев В. В. Влияние возникающих при твердофазных превращениях механических напряжений на их кинетику. II. Регулирование температуры полиморфного превращения NH4Cl гомофазным и поверхностным упрочнением // Изв. СО АН СССР. Сер. хим. наук. 1985. № 17, вып. 6. С. 39—49.
Chizhik S. A., Sidelnikov A. A. The kinetics of solid state reactions accompanied by fracture: I. Reaction of ion exchange in lime-soda glass; II. Model of stationary front with disordered fracture morphology; III. Model of stationary front with spacially ordered fracture morphology // Solid State Ionics. 2007. V. 178. P. 1344—1352; P. 1487—1492; 2008. V. 179. P. 1823—1834.
Chupakhin A. P., Sidel`nikov A. A., Boldyrev V. V. Control of the Reactivity of Solids by Chainging their Mechanical Properties // Reactivity of Solids. 1987. V. 3, № 1. P. 1—19.
Matvienko A. A., Sidelnikov A. A. The influence of relaxation of stresses occurring during the transformation of tin on the kinetics of the transformation // Solid State Ionics. 1997. V. 101—103. P. 641—646.
В публикации использованы фото авторов и Д. В. Кулакова









