Клеточная иммунотерапия: от цирроза до инсульта
Один из самых авторитетных научных журналов мира – Science – в 1999 г. поставил открытие эмбриональных стволовых клеток на третье место по значимости в биологии после расшифровки структуры молекулы ДНК и реализации программы «Геном человека». А уже в 2007 г. исследования в этой области были отмечены Нобелевской премией.Открытие незрелых «предшественников» специализированных клеток органов и тканей стало сенсацией не только в научном мире: предполагалось, что уже в недалеком будущем мы сможем с помощью клеточных технологий выращивать новые органы, лечить наследственные болезни и даже возвращать молодость. Однако этим надеждам не суждено было сбыться в полной мере: путь «от пробирки» до клинического применения оказался слишком тернист. Тем не менее определенные успехи на этом пути уже есть, в том числе в новосибирском НИИ фундаментальной и клинической иммунологии СО РАН, где изучаются возможности использования стволовых клеток и их продуктов для лечения самых разных заболеваний: от цирроза печени и рака до депрессии
Для меня и моих коллег все началось в 1900‑х гг. с работ американского ученого и хирурга-онколога Стивена Розенберга. Один из пионеров иммунотерапии рака, Розенберг стал использовать для лечения злокачественных новообразований иммунные клетки крови – натуральные киллеры (NK-клетки). В нашем организме они являются компонентом «первой линии защиты» – врожденного иммунитета – и способны уничтожать зараженные и злокачественно перерожденные клетки. Для усиления киллерной активности Розенберг предложил воздействовать на NK-клетки с помощью одного из белков, регулирующих клетки иммунной системы (интерлейкин‑2).
Мы решили повторить этот опыт, тем более что в ГНЦ вирусологии и биотехнологии «Вектор» в то время была разработана технология получения генно-инженерного интерлейкина‑2. К сожалению, терапия нескольких онкологических больных активированными клетками-киллерами явного клинического результата не дала. Зато выяснилось, что на фоне их введения операционные раны после удаления опухоли заживали быстрее и без осложнений.
Тогда и возникла мысль: если введение NK-клеток активирует неспецифический иммунитет в целом, то почему бы не использовать этот способ для лечения септических больных. В то время смертность от тяжелых форм сепсиса составляла 40–60 %.
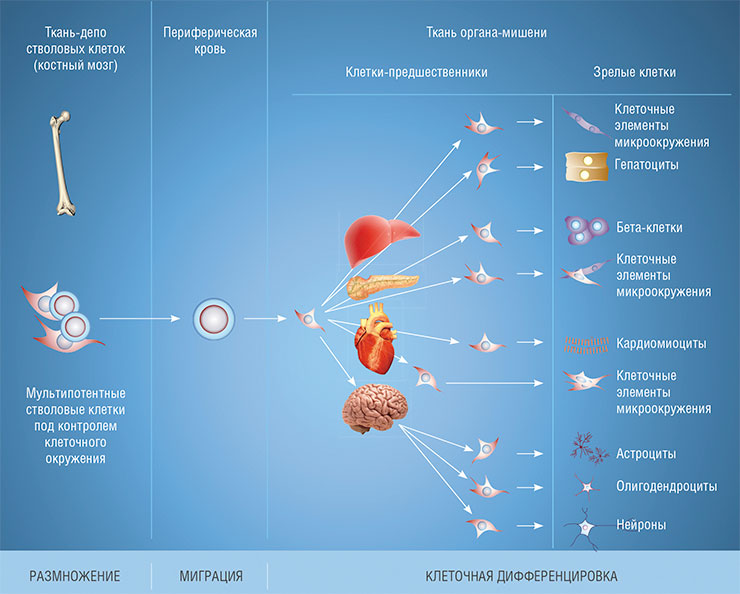
Во взрослом организме имеются гемопоэтические стволовые клетки (родоначальницы всех клеток крови), стволовые клетки кожи, скелетной мускулатуры, миокарда, нейрональные стволовые клетки и др. Все эти стволовые клетки, «обитающие» в конкретных тканях, обладают высоким потенциалом к размножению и дифференцировке – и не только в клетки соответствующей ткани
С этим предложением мы решили обратиться в отделение гнойной хирургии одной из новосибирских больниц. Нам удалось договориться о возможном сотрудничестве в случае появления тяжелого, практически безнадежного больного. И буквально через несколько дней из больницы позвонили: приезжайте.
Пациентом оказался человек без определенного места жительства с букетом тяжелых диагнозов. Попал он в больницу с флегмоной грудной клетки, ну а дальше – череда осложнений: выход гноя и воздуха в плевральную полость, прорыв гнойного содержимого в брюшную полость с развитием тяжелого перитонита, септический шок… Обычные меры не помогали – надежд на выздоровление не было.
Мы взяли у больного кровь, получили из нее клетки-киллеры, активировали их интерлейкином‑2 и ввели внутривенно. Дело было перед выходными, а к понедельнику пациент был не просто жив, но и с «чистой» брюшной полостью…
Это было для нас первое применение клеточной технологии. Потом мы несколько лет успешно использовали этот метод для лечения септических больных, но из-за появления эффективных антибиотиков нового поколения постепенно отказались от него.
Стволовые клетки – строители или регулировщики?
Стволовые, или недифференцированные, клетки – это «предшественники» всех клеток нашего организма, способные превращаться (дифференцироваться) в клетки различных органов и тканей. Благодаря этим клеткам организм постоянно обновляется, залечивает травмы, восстанавливает целостность тканей, поэтому первоначально их стали использовать исключительно в регенеративной медицине.
 После открытия стволовых клеток специалисты надеялись, что с помощью клеточных технологий можно будет восстанавливать любые повреждения – в печени, почках, сердце, суставах… Для этого нужно лишь ввести необходимое количество клеток-предшественников в кровь – и они сами найдут больной или изношенный орган, начнут дифференцироваться в специализированные клетки тканей и замещать погибшие. Казалось, что найдена панацея и вскоре мы сможем лечить практически любые болезни.
После открытия стволовых клеток специалисты надеялись, что с помощью клеточных технологий можно будет восстанавливать любые повреждения – в печени, почках, сердце, суставах… Для этого нужно лишь ввести необходимое количество клеток-предшественников в кровь – и они сами найдут больной или изношенный орган, начнут дифференцироваться в специализированные клетки тканей и замещать погибшие. Казалось, что найдена панацея и вскоре мы сможем лечить практически любые болезни.
Однако реальность оказалась иной. Выяснилось, что в разных тканях процессы регенерации идут по-разному. К примеру, стволовые кроветворные клетки действительно на протяжении нашей жизни дают начало всем форменным элементам крови: от эритроцитов и лейкоцитов до тромбоцитов. Сейчас такие клетки успешно применяются в лечении онкогематологических заболеваний. Но вот в других органах превращения стволовых клеток в клетки поврежденной ткани не наблюдалось.
Сегодня исследователи склоняются к мнению, что ведущий механизм терапевтического действия стволовых клеток – это паракринная регуляция. Суть ее заключается в том, что введенные в организм стволовые клетки вырабатывают огромное количество различных активных соединений, которые воздействуют на клеточное окружение и стимулируют процессы восстановления поврежденных тканей. Другими словами, сами по себе они не являются материалом «для ремонта» больного или изношенного органа, но запускают в нем процессы регенерации.
Примером могут служить мезенхимальные стволовые клетки (МСК), предшественники клеток жировой, хрящевой и костной ткани. В своем недифференцированном состоянии МСК обладают колоссальным иммуномодулирующем потенциалом, в частности они способны подавлять воспаление – основу большинства хронических заболеваний.
Длительный воспалительный процесс приводит к тому, что функциональные клетки органа начинают отмирать, постепенно замещаясь соединительной тканью. Результат – сердечная и почечная недостаточность, фиброз легких… При введении такому пациенту МСК мы, во‑первых, останавливаем патологический воспалительный процесс, во‑вторых – стимулируем в органе процессы регенерации с участием собственных стволовых клеток.
На сегодня в мире был зарегистрирован лишь один препарат на основе МСК – прохимал (Prochymal). Когда в 2013 г. патент купила австралийская компания Mesoblast, препарат был переименован в ренсил (Ryoncil). Его применяют при осложнениях, связанных с пересадкой костного мозга от донора. Как известно, в 30–50 % таких случаев развивается реакция «трансплантат против хозяина», когда здоровые иммунные донорские клетки начинают атаковать ослабленный организм пациента. Этот иммунный конфликт не лечится никакими известными методами – его могут предупреждать и «гасить» только МСК.
Лечим цирроз
Способность МСК подавлять воспалительный процесс мы использовали для лечения цирроза печени – на сегодня неизлечимого заболевания, так как на поздних стадиях фиброз этого органа необратим. При этом именно воспаление служит триггером этой патологии, и неважно, какой оно природы: вирусной, алкогольной, аутоиммунной…
В НИИ фундаментальной и клинической иммунологии разработкой методов клеточной терапии цирроза печени начали заниматься с 2003 г. Это был довольно смелый шаг: в то время такие работы ни у нас, ни за рубежом еще не проводились. Так что мы оказались одними из первых, хотя сегодня в мире проведено уже более 40 клинических исследований эффективности МСК при циррозе печени.
К нам в клинику обычно попадают уже тяжелые пациенты, часто с декомпенсированной формой заболевания. Конечно, полностью вернуть здоровье больному в такой стадии уже нельзя, но можно облегчить его состояние – в случае цирроза печени это уже большой успех.
Поначалу мы использовали костный мозг как источник МСК, позднее стали выделять из него предшественников этих клеток (Старостина, Пальцев, Останин и др., 2009; Шевела, Старостина, Пальцев и др. 2015). Но сама эта процедура была для пациента достаточно травматичной. Позже зарубежные и отечественные иммунологи показали, что аналогичные клетки имеются в жировой ткани, причем в ней их гораздо больше, а получить намного проще.
Сегодня мы используем собственную жировую ткань пациента, около 50–100 мл, обычно из области живота. Из этого образца выделяем фракцию нежировых клеток и помещаем в своего рода «инкубатор». Чтобы был понятен масштаб, приведу цифры: в 1 мл жира содержится около полумиллиона нежировых клеток, из которых не более 1 % составляют предшественники МСК. В инкубаторе, используя специальные методики, мы выращиваем десятки миллионов МСК, которые затем внутривенно вводим пациенту.
Исследования, в которых МСК метили флуоресцентным красителем или радиоактивными метками, показали, что львиная доля введенных клеток оседает в легких, печени же «достается» лишь незначительный процент.
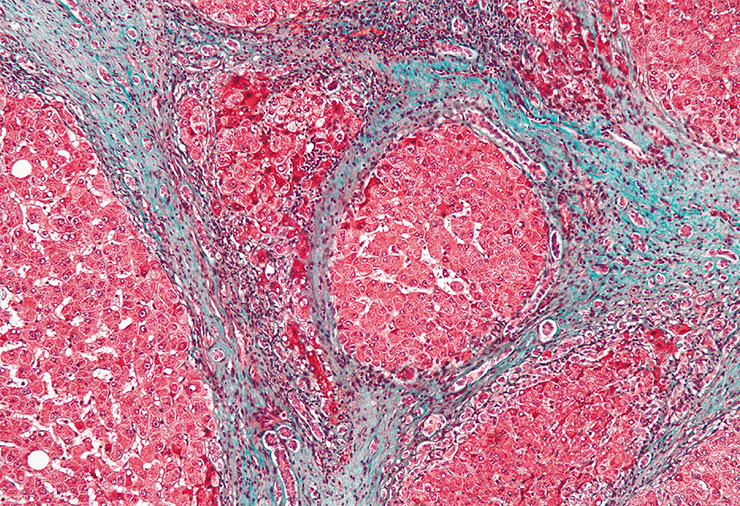
Но ведь цирроз – это не только больная печень, но и масса тяжелых осложнений: от нарушения проницаемости кишечника до энцефалопатии и внутренних кровотечений… Введенные МСК уменьшают воспаление, а также запускают процессы паракринной регуляции во всем организме. Начиная с легких, они цепной реакцией распространяются на другие пораженные органы, включая печень. И хотя потом эти клетки гибнут, свою задачу они выполняют. Это подтверждается и результатами сравнения уровня провоспалительных цитокинов до и после введения МСК. Разница выше на порядок!
Первое, что мы видим после такой процедуры, – у больного уменьшается астенический синдром. У него улучшается самочувствие и мозговая деятельность, восстанавливается трудоспособность. И чем раньше начинается лечение, тем лучше оказывается результат.
У наших больных с начальной стадией цирроза (класс А), которые в течение 7–8 лет успели пройти несколько таких процедур, стабильное состояние и нормальное качество жизни. У пациентов со второй, более продвинутой стадией (класс В) МСК-клеточная терапия дает хороший эффект примерно в половине случаев, а на последней, третьей стадии (класс С) – в четверти. Главная задача тех, кто попадает к нам в терминальной стадии, – дожить до трансплантации, и иммуноклеточная терапия может им в этом помочь.
Встречаются и совсем неожиданные эффекты. У некоторых пациентов после иммунотерапии в печени с помощью компьютерной томографии обнаруживались какие-то очаговые изменения. И это не опухоль, а, как мы предполагаем, участки формирования новой печеночной ткани. Правда, доказательств этому нет – чтобы получить их, требуются биопсия и гистологический анализ. Но вряд ли кто-то из таких больных согласится на лишнюю и болезненную инвазивную процедуру, да и число их мало. Проверить же наши предположения на лабораторных животных проблематично: по крайней мере, ни лабораторные мыши, ни крысы не болеют настоящим «человеческим» циррозом. Если прекратить вводить этим животным токсические вещества, они спонтанно выздоравливают.
Ингаляции… для мозга
 Разработки в области клеточной терапии цирроза печени с помощью МСК сейчас активно ведутся во всем мире. Однако в нашем институте имеются и собственные оригинальные технологии. Так, за последние пять лет у нас была создана удивительно простая в применении технология для лечения мозговых патологий, связанных с воспалением, которая до сих пор не имеет аналогов в нашей стране и за рубежом. Мы назвали ее ингаляционная интраназальная иммунотерапия.
Разработки в области клеточной терапии цирроза печени с помощью МСК сейчас активно ведутся во всем мире. Однако в нашем институте имеются и собственные оригинальные технологии. Так, за последние пять лет у нас была создана удивительно простая в применении технология для лечения мозговых патологий, связанных с воспалением, которая до сих пор не имеет аналогов в нашей стране и за рубежом. Мы назвали ее ингаляционная интраназальная иммунотерапия.
Почему ингаляционная? При лечении головного мозга всегда стоит проблема: как преодолеть гематоэнцефалический барьер, представляющий своего рода клеточную мембрану, выстилающую сосуды мозга и защищающую его от потенциально опасных молекул и клеток, циркулирующих в крови. Этот же барьер может препятствовать проникновению в мозг и лекарственных средств, тогда как при вдыхании различные вещества могут попадать из носовой полости непосредственно в ткани головного мозга по ходу тройничного и обонятельного нервов.
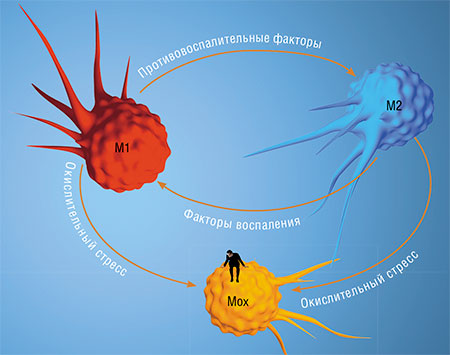
«Классический» макрофаг М1 формируется из предшественника-моноцита под действием внутриклеточных сигналов после распознавания инфекционного агента и начинает активно синтезировать более чем сотню белков – факторов воспаления.Но уже на начальных этапах воспалительного процесса М1 начинает активно секретировать и противовоспалительные низкомолекулярные липидные молекулы. Эти сигналы воздействуют на новые «рекруты»-моноциты в очаге воспаления: у них активируются гены, отвечающие за гармонизацию обмена веществ, а активность «провоспалительных» генов подавляется. В результате образуются макрофаги М2, которые останавливают воспалительный процесс и способствуют тканевому восстановлению.
Макрофаги ЦНС образуются из циркулирующих моноцитов костномозгового происхождения и пополняются на протяжении жизни. При острой патологии рекрутируемые макрофаги быстро приобретают М2‑фенотип, который уже через неделю сменяется на М1. При хронических нейровоспалительных заболеваниях в ЦНС присутствуют клетки с М1- и М2‑фенотипом: доминирование М1 ассоциировано с прогрессией заболевания, а М2 – с ремиссией
В своей технологии мы использовали клетки врожденного иммунитета – макрофаги. Эти иммунные клетки, как известно, могут выполнять различные специализированные функции в зависимости от микроокружения. Так, макрофаги М1, которые в буквальном смысле «пожирают» патогены и опухолевые клетки, выделяют сигнальные молекулы, стимулирующие образование очагов воспаления в качестве универсальной защитной реакции на «врага». А М2, о которых пойдет речь ниже, напротив, способствуют уменьшению воспалительного процесса и восстановлению поврежденных тканей.
Мы, конечно, не единственные в мире, кто использует противовоспалительное действие макрофагов 2‑го типа. Например, немецкие исследователи изучают эффективность применения макрофагов при пересадке почки. Снимая воспаление, эти клетки тем самым уменьшают риск отторжения трансплантата.
Специфика нашего метода заключается в том, что мы используем не сами клетки, а их продукты, применяя для их доставки в мозг ингаляцию. Дело в том, что макрофаги М2, как и уже упомянутые мезенхимальные стромальные клетки, выделяют целый комплекс небольших активных и сигнальных молекул (цитокины, хемокины, факторы роста и др.), которые подавляют воспаление и стимулируют регенеративные процессы. Искусственно такую «композицию» подобрать очень сложно: в нее входит много различных молекул в разных концентрациях, и не все они на сегодня хорошо изучены.
Вот эти молекулярные продукты макрофагов и получают в качестве терапии наши пациенты. Состав, содержащий противовоспалительный «коктейль», заливается в обычный ингалятор-небулайзер, создающий мелкодисперсный аэрозоль, которым больные дышат.
Мы применяли этот метод для лечения взрослых с церебральным инсультом, хронической ишемией головного мозга и детей с задержкой речевого развития. Надо помнить, что пусковым механизмом неврологических нарушений при инсульте, поражении ЦНС у новорожденных и даже при депрессии и шизофрении служит все тот же хронический воспалительный процесс в нервной ткани.
При этом в головном мозге процессы восстановления идут не так, как в других тканях и органах. Так, если кровь постоянно обновляется за счет новых кровяных телец, образующихся из стволовых клеток, то образование новых нейронов не играет значимой роли в процессах функционального восстановления мозговой ткани. Этот процесс идет преимущественно за счет регенерации у нейронов поврежденных аксонов (отростки, проводящие нервные импульсы), восстановления их защитной миелиновой оболочки, а также образования новых нейронных связей.
К примеру, при инсульте часть головного мозга просто гибнет, а в месте поражения впоследствии образуется полость, заполненная спинномозговой жидкостью. Восстановить такое повреждение невозможно, но в обход этого участка постепенно начинают формироваться новые нейронные пути, причем иногда они идут даже из другого полушария. Применяя интраназальную иммунотерапию, мы видим, как со временем у пациента восстанавливается речь и координация, уменьшается выраженность тревожно-депрессивного синдрома, улучшаются умственные функции (Останин, Давыдова, Старостина и др., 2018).
Но самый яркий эффект ингаляционной иммунотерапии наблюдается у других пациентов – детей с задержкой речевого развития (Шевела, Дегтярева, Сосновская и др., 2021). Мы проводили наши исследования на базе одного из новосибирских детских неврологических центров: многие из детей, которые там наблюдаются, могут произносить лишь отдельные слова, некоторые – только слоги. Но уже после месяца интраназальных процедур детей было не узнать: они начинали разговаривать целыми фразами, становились более коммуникабельными, у них повышалась социализация. И это отмечали не только родители, но и специалисты, которые с ними работали.
Конечно, строго говоря, нашу технологию нельзя назвать клеточной, поскольку мы вводим больному не сами клетки, а их продукты. С другой стороны, многие терапевтические эффекты стволовых клеток реализуются именно через молекулярные механизмы.
Рак: найти и обезвредить
Еще одна наша методика, где клеточные технологии и иммунотерапия неразрывно связаны, касается лечения онкологических заболеваний. Как известно, Т-лимфоциты, играющие важную роль в приобретенном иммунитете, устроены так, что не могут самостоятельно распознать ни бактерии или вирусы, ни собственные измененные патологические клетки организма. Для этого им нужны помощники – дендритные клетки, которые «профессионально» занимаются презентацией чужих антигенов (молекулы, вызывающие иммунный ответ) Т-лимфоцитам. Для этого они захватывают чужеродный материал, «разрезают» его на мелкие фрагменты и представляют их Т-лимфоцитам. По сути, именно дендритные клетки служат «включателем» иммунного ответа.
К сожалению, этот включатель иногда не срабатывает. К примеру, многие вирусы и клетки злокачественных опухолей могут вырабатывать вещества, угнетающие функцию дендритных клеток, которые уже не могут эффективно представлять чужеродные антигены Т-клеткам.
СТВОЛОВЫЕ КЛЕТКИ И РИСК РАЗВИТИЯ РАКА Многие до сих пор убеждены, что введение стволовых клеток само по себе может провоцировать развитие рака. Однако те незрелые клетки-предшественники, которые получают из собственной ткани пациента, а затем вводят обратно, принципиально ничем не отличаются от других таких же клеток организма. Хотя теоретически такая опасность все-таки существует, что и было показано, в частности, в экспериментах на животных.Так, МСК животных, будучи не слишком стабильными генетически, при длительном культивировании (особенно при многократном разделении и переносе в другие лабораторные сосуды для выращивания) могут действительно трансформироваться в опухолевые. Но разработанная в нашем институте технология, предусматривающая ограниченное время культивирования клеток, а также достаточно высокая генетическая стабильность МСК человека (Meza-Zepeda, Noer, Dahl et al., 2008) снимают эту проблему.
Но есть и другая потенциальная угроза. МСК обладают иммуносупрессивным действием, поэтому возникает вопрос: не могут ли они настолько снизить эффективность работы нашей собственной иммунной системы, что это спровоцирует рак? Однако, в отличие от многих широко применяемых препаратов-иммуносупрессоров, такие клетки вводятся однократно, и мы никогда не отмечали при этом иммунодефицитного состояния.
Реальная опасность заключается в том, что введение стволовых клеток может стимулировать рост уже имеющейся опухоли. Поэтому мы очень тщательно обследуем пациентов и обязательно берем анализы на онкомаркеры. Больному, у которого в анамнезе есть опухолевый процесс, лечение МСК противопоказано
Но что делать, если собственные дендритные клетки организма не выполняют положенную им функцию? Исправить ситуацию можно, если ввести такому больному полноценные дендритные клетки, уже «нагруженные» нужным антигеном. Этот прием очень напоминает привычную иммунизацию против инфекций, а сам клеточный препарат так и называется – дендритноклеточная вакцина.
Технология получения дендритных клеток в принципе хорошо известна: у пациента забирают кровь, выделяют из нее моноциты – относительно незрелые крупные лейкоциты, которые можно по определенной схеме дифференцировать в дендритные клетки. Затем эти клетки нагружают нужными антигенами, для чего культивируют, к примеру, с суспензией разрушенных опухолевых клеток. Как правило, терапия больного включает серию вакцинаций: 4–6 раз с интервалом 1–2 недели, а затем желательны поддерживающие курсы на протяжении всей жизни.
Дендритноклеточные вакцины апробируют во многих странах. На сегодня к практическому применению официально разрешена единственная вакцина, сделанная по этому принципу, – Sipuleucel-T (Provenge®), разработанная против рака предстательной железы американской биотехнологической компанией Dendreon Corporation (Kantoff, Higano, Shore et al., 2010). Ожидается, что в ближайшем будущем Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США разрешит применять в клинической практике еще одну дендритноклеточную вакцину против глиобластомы (злокачественная опухоль головного мозга) – DCVax-L, разработанную американской фармацевтической компанией Northwest Biotheraouetics.
 Наш опыт в области дендритноклеточных вакцин также связан прежде всего с глиобластомой. Это чрезвычайно агрессивная, рецидивирующая опухоль с очень плохим прогнозом: за 15 месяцев половина больных, которым поставлен такой диагноз, умирают. В этом смысле американским ученым удалось добиться весьма обнадеживающих результатов: благодаря вакцине DCVax-L около 30 % пациентов живут после операции более трех лет (Liau, Ashkan, Tran et al, 2018).
Наш опыт в области дендритноклеточных вакцин также связан прежде всего с глиобластомой. Это чрезвычайно агрессивная, рецидивирующая опухоль с очень плохим прогнозом: за 15 месяцев половина больных, которым поставлен такой диагноз, умирают. В этом смысле американским ученым удалось добиться весьма обнадеживающих результатов: благодаря вакцине DCVax-L около 30 % пациентов живут после операции более трех лет (Liau, Ashkan, Tran et al, 2018).
Хотя наши работы по масштабу намного скромнее, по результатам они вполне сравнимы: доля наших пациентов с глиобластомой, перешагнувших трехлетний рубеж выживаемости, составляет 29 %.
Более того, кое в чем мы пошли дальше наших американских коллег. Дело в том, что когда мы проводим химио- или лучевую терапию, то зрелые раковые клетки погибают, а их предшественники остаются, потому что ведут себя неактивно и не делятся, а потом дают начало новому витку опухолевого роста. Однако дендритные клетки, которые получаются по нашей технологии, не позволяют им «отсидеться». Они обладают более выраженной цитотоксической активностью – способностью убивать раковые клетки, причем не только зрелые, но и, как выяснилось, стволовые (Тыринова, Леплина, Мишинов и др., 2010; Leplina, Tyrinova, Tikhonova et al., 2015). Правда, здесь нужно сразу оговориться, что клеточная вакцина служит лишь дополнением к хирургическим и другим методам борьбы с раком. Сначала нужно удалить злокачественное новообразование и лишь затем стимулировать иммунный ответ, чтобы нанести по оставшимся опухолевым клеткам еще один удар.
Кстати сказать, возможности дендритноклеточных вакцин не ограничиваются только онкопатологией. В частности, мы успешно применили этот метод для лечения пациентов с часто рецидивирующей герпетической инфекцией (Leplina, Starostina, Zheltova et al., 2016). Применение вакцины позволяет примерно в три раза увеличить период между обострениями, а в комбинации с противовирусной терапией – свести рецидивы практически к нулю и добиться стойкой ремиссии.
Следующим нашим шагом стала апробация клеточной вакцины у пациентов с гепатитом С. О результатах говорить пока рано, но уже ясно, что и в этом случае вакцина вызывает специфический противовирусный иммунный ответ (Chernykh, Leplina, Oleynik et al., 2018).
Клетка вне закона
Возможности иммунотерапии сегодня пусть и не безграничны, но очень широки. Мы можем выделить из организма и культивировать различные иммунные клетки, перепрограммировать их под нужные нам задачи или восстановить утраченные функции, а затем вновь ввести пациенту. Таким образом мы можем усилить иммунный ответ на какой-то конкретный антиген либо, наоборот, подавить его.
Сегодня мы могли бы лечить многие заболевания без грубых вмешательств, используя естественные природные механизмы. Могли бы – но не имеем права, согласно закону «О биомедицинских клеточных продуктах», принятому в июле 2016 г. и обновленному в августе 2021 г. В свое время мы очень ждали этот закон и возлагали на него большие надежды. Но с его выходом лишились даже тех скромных возможностей, которые имели.
Ранее в законодательстве существовало такое понятие, как «медицинская технология», которую можно было зарегистрировать в реестре Роспотребнадзора и применять на практике. Теперь правила игры изменились, и мы больше не имеем права заниматься тем, чем успешно занимались много лет.
При этом логика наших законодателей часто приводит в замешательство. К примеру, трансплантация стволовых кроветворных клеток костного мозга больным с лейкозами и злокачественными лимфомами разрешена, а больным другого профиля – уже под запретом. Нежировую клеточную фракцию, полученную из жировой ткани, использовать можно, а выделенные из нее мезенхимальные клетки – нет.
Закон определяет биомедицинский клеточный продукт как клеточную линию, т. е. группу однотипных клеток с одинаковой функцией. Однако при клеточной иммунотерапии мы в основном имеем дело с разнородными клеточными популяциями. А это уже другой субстрат, который, по идее, не должен подпадать под этот закон. Однако по умолчанию подпадает.
Можно привести еще немало других противоречий и несоответствий. К примеру, согласно действующему закону, клеточный продукт должен пройти все доклинические испытания на мелких и крупных лабораторных животных, как и любой лекарственный препарат. Но в нашем случае сделать это просто невозможно, за редким исключением.
Наша иммунотерапия «пациентзависимая»: мы работаем с клетками, которые берем у конкретного пациента и ему же вводим обратно. Если ввести эти клетки животному, его организм их просто отторгнет. Конечно, есть еще иммунодефицитные мыши, у которых человеческие клетки не отторгаются, но, как отмечалось выше, само функционирование организма таких животных моделей далеко от человеческого. Что же касается крупных животных, то иммунодефицитных собак и кошек пока не существует.
Результат закономерен: за пять лет с момента принятия нового закона ни один биомедицинский продукт на основе иммунных или стволовых клеток не был зарегистрирован. Поэтому сегодня вся наша работа в области регенеративной иммунотерапии идет строго в рамках клинических или поисковых научных исследований и проводится в очень небольшом объеме. К примеру, за пять лет терапию макрофагами у нас прошли всего около сотни пациентов. А могли бы тысячи!
Что делается в мире? Сегодня в лидеры по числу исследований в области клеточной иммунологии вышла КНР. Китайское государство разрешает использовать клеточные технологии в порядке «экспериментальной терапии», причем 60 % таких пациентов – иностранцы.
Клеточные технологии активно используются и в клиниках Германии и Израиля. К примеру, в Израиле с помощью мезенхимальных клеток выращивают костную ткань с сосудами. В принципе, это умеют делать и у нас в России. Но не делают, потому что нельзя. Неудивительно, что наши соотечественники, у кого была такая возможность, до недавних пор уезжали лечиться за рубеж. А могли бы приезжать в Новосибирск.
Многие, и я в том числе, считают, что будущее медицины будет во многом определяться клеточной терапией. Вопрос в том, как это будущее сделать реальностью.
До сих пор есть ряд заболеваний, для которых пока не существует методов лечения с доказанной эффективностью. Например, аутоиммунные патологии или такие тяжелые заболевания ЦНС, как рассеянный склероз и боковой амиотрофический склероз, которые превращают человека в инвалида. Да и «обычная» депрессия, которая, по прогнозам ВОЗ, вскоре станет одной из главных причин нетрудоспособности. Не говоря уже о новых инфекциях, которые могут оказаться опаснее COVID‑19. В отношении многих из этих патологий иммунотерапевтические методы уже применялись, причем с обнадеживающими результатами.
Здесь будет уместно снова вспомнить про нашу технологию лечения сепсиса с использованием активированных лимфоцитов, которую мы стали применять в 1990‑е гг. После появления новых поколений антибиотиков от нее отказались, однако вполне вероятно, что она вновь станет актуальной из-за стремительного роста лекарственной устойчивости бактерий. Ведь чуть ли не каждые полгода появляются новые штаммы возбудителей с резистентностью к имеющимся препаратам, и нужно искать новые. К тому же при борьбе с инфекцией очень важно воздействовать не только на патоген, но и на иммунную систему самого человека, а клеточные технологии своей эффективности не теряют…
Литература
Останин А. А., Давыдова М. Н., Старостина Н. М. и др. Интраназальные ингаляции биоактивных факторов, продуцируемых М2-макрофагами, в лечении больных с органическими поражениями головного мозга // Мед. иммунология. 2018. Т. 20(4). С. 577–588.
Шевела Е. Я., Старостина Н. М., Пальцев А. И. и др. Эффективность клеточной терапии при циррозе печени // Клеточные технологии в биологии и медицине. 2015. № 4. С. 232–238.
Шевела Е. Я., Дегтярева В. Г., Сосновская А. В. и др. Корригирующий эффект растворимых факторов макрофагов М2-фенотипа у детей с нарушением речи // Мед. иммунология. 2021. Т. 23(5). С. 1137.
Chernykh E. R., Shevela E. Ya., Starostina N. M. et al. Safety and therapeutic potential of M2-macrophages in stroke treatment // Cell Transplantation. 2016. V. 25. P. 1461–1471.
Chernykh E., Leplina O., Oleynik E. et al. Immunotherapy with interferon-α-induced dendritic cells for chronic HCV infection (the results of pilot clinical trial) // Immunol Res. 2018 Feb. V. 66(1). P. 31–43.
Leplina O. Yu., Tyrinova T. V., Tikhonova M. A. et al. Interferon alpha induces generation of semi-mature dendritic cells with high pro-inflammatory and cytotoxic potential // Cytokine. 2015. V. 71(1). P. 1–7.
Leplina O., Starostina N., Zheltova O. et al. Dendritic cell-based vaccines in treating recurrent herpes labialis: Results of pilot clinical study // Hum Vaccin Immunother. 2016. V. 12(12). P. 3029–3035.