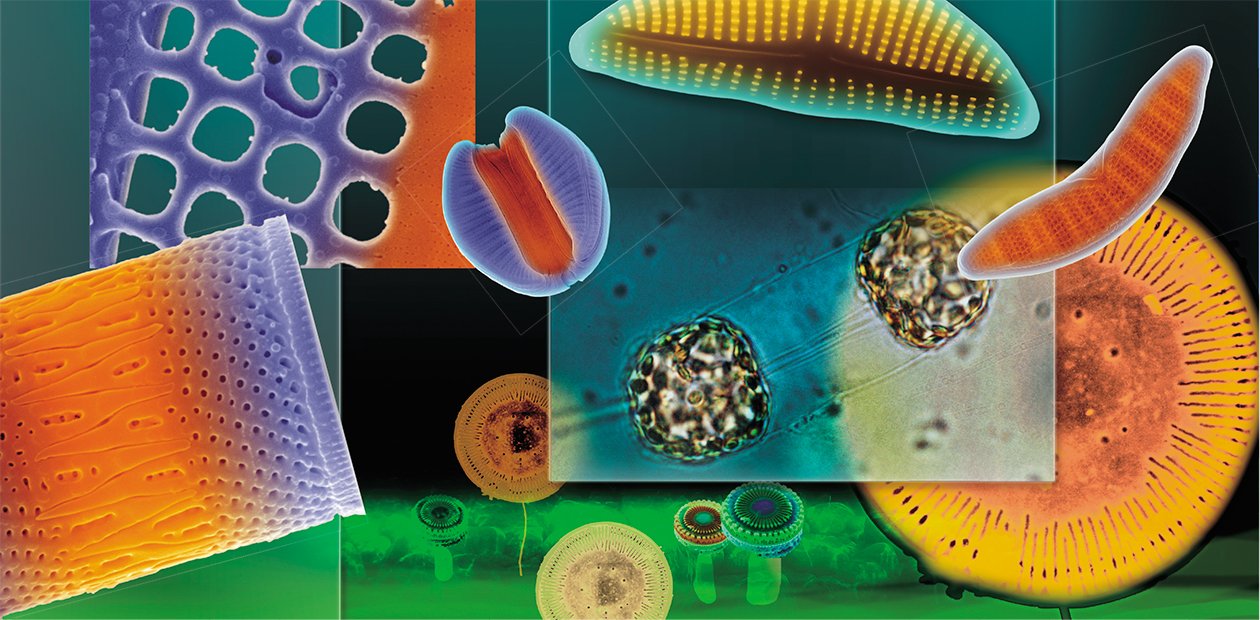
Кремниевые нанотехнологии «в пробирке»
Кремний – один из самых широко распространенных химических элементов в земной коре – не входит в число основных элементов, слагающих живые клетки, а в высоких концентрациях даже токсичен. Тем не менее многие организмы, от губок и радиолярий до злаков, активно используют его для создания каркасных элементов своего тела. Среди самых искусных создателей структур из полимеризованного кремнезема –многочисленная и широко распространенная группа диатомовых водорослей. В своих «кремниевых нанотехнологиях» эти микроводоросли не используют экстремально высокие температуры и «тяжелую химию», поэтому они служат объектом пристального внимания современных биотехнологов
Умение диатомовых водорослей искусно манипулировать кремнием, которое эволюционировало и «оптимизировалось» десятки миллионов лет, в эпоху высоких технологий вызывает живейший интерес ученых. Термин «диатомовые нанотехнологии» (diatom nanotechnologies) ввел еще в 1988 г. американский исследователь Р. Гордон (Gordon, Aguda, 1988). Сейчас применительно ко всей группе пигментированных гетероконтов, к которым относятся не только диатомеи, но и хризофитовые, можно говорить о кремниевых нанотехнологиях (silicon nanotechnologies) в широком смысле (Grachev et al., 2008). Поэтому неудивительно, что макро- и микропроцессы морфогенеза и сама структура кремнеземных створок водорослей привлекают сегодня внимание специалистов из самых разных областей.

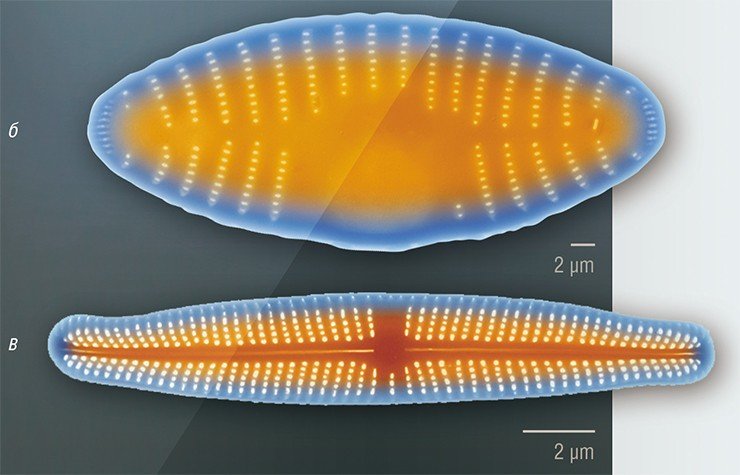
Благодаря своим оптическим свойствам и большой площади поверхности, на которой могут быть иммобилизованы антитела и ферменты, панцири диатомей могут использоваться в качестве биосенсоров (Gale et al., 2009; Sheppard et al., 2012). Недавно была показана возможность их применения для целевой доставки плохо растворимых в воде лекарственных препаратов, например, антираковых (Delalat et al., 2015).
Панцири диатомей являются и объектом трибологии – науки, исследующей контактные взаимодействия твердых деформируемых тел при их относительном перемещении. При этом особое внимание привлекают способы объединения клеток водорослей в колонии с помощью соединительных кремнеземных конструкций и адгезивных веществ, которые они выделяют (Кроуфорд, Гибшубер, 2006, Gebeshuber, 2007). Диатомеи могли бы стать и экономичной заменой таких нанотехнологий, как планарная литография, которая используется для создания «плоских» полупроводниковых приборов, интегральных микросхем, а также некоторых сверхпроводниковых наноструктур. Один из этапов этой технологии – формирование в чувствительном слое на поверхности подложки рельефного рисунка, повторяющего топологию микросхемы. Вот если бы диатомее можно было «заказать» конкретный рисунок!
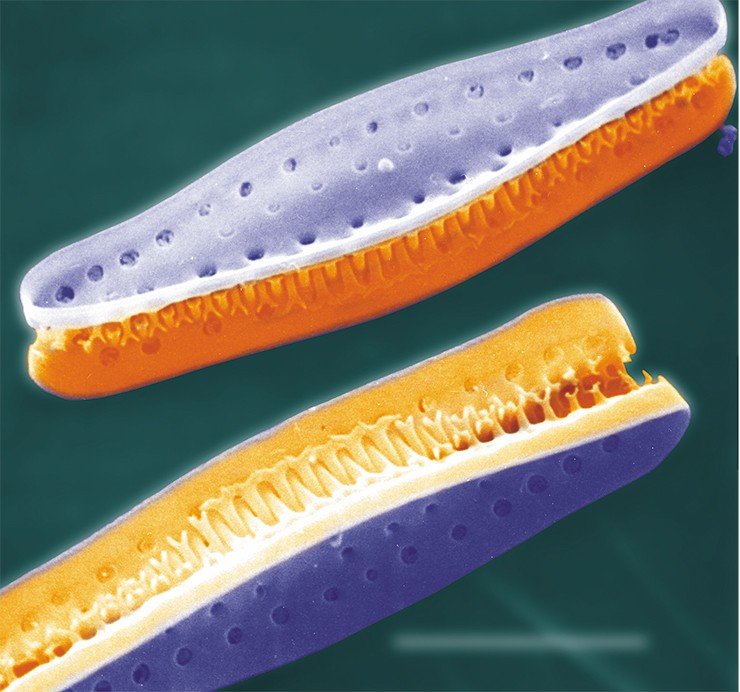
Эта мечта волнует многих – ее реализация могла бы стать основой принципиально новых биотехнологических производств. Однако несмотря на всю возможную пользу и экономическую выгоду, мы еще далеки от полного понимания генетических и клеточных процессов, лежащих в основе морфогенеза кремнеземного панциря диатомей, хотя эти исследования ведутся с середины прошлого века.
Ключевое звено – микротрубочки
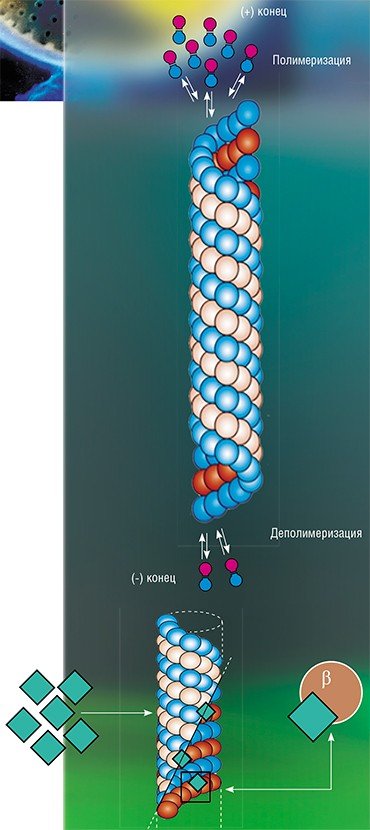 Кремнистая створка диатомовых водорослей формируется в специализированной внутриклеточной органелле – везикуле отложения кремнезема, окруженной специфической мембраной – силикалеммой. На сегодня известно, что важную роль в формировании створки играет цитоскелет, в частности, микротрубочки, которые у некоторых видов диатомей удалось визуализировать с помощью флуоресцентной и конфокальной микроскопии. В экспериментах, где использовались вещества, ингибирующие работу микротрубочек (колхицин, люмиколхицин, оризалин и др.), водоросли формировали створки с разнообразными аномалиями.
Кремнистая створка диатомовых водорослей формируется в специализированной внутриклеточной органелле – везикуле отложения кремнезема, окруженной специфической мембраной – силикалеммой. На сегодня известно, что важную роль в формировании створки играет цитоскелет, в частности, микротрубочки, которые у некоторых видов диатомей удалось визуализировать с помощью флуоресцентной и конфокальной микроскопии. В экспериментах, где использовались вещества, ингибирующие работу микротрубочек (колхицин, люмиколхицин, оризалин и др.), водоросли формировали створки с разнообразными аномалиями.
В отделе ультраструктуры клетки Лимнологического института СО РАН была впервые в мире исследована роль цитоскелета в морфогенезе створки на синхронизированной культуре диатомовых водорослей, где все клетки находятся на одной и той же стадии клеточного цикла. Добиться синхронизации клеточных культур диатомей сравнительно несложно: для этого достаточно содержать их некоторое время в бескремниевой среде. Клетки сначала будут усиленно тратить свой запасенный кремний на построение панциря, а как только он весь израсходуется, они перестанут делиться и остановятся на определенной стадии жизненного цикла. При добавлении кремния в среду клетки вновь начинают процесс формирования новых створок и деления.
«Подопытной» стала диатомея Synedra acus subsp. radians – эта водоросль в течение нескольких лет служит в ЛИН СО РАН модельным объектом при изучении всех аспектов морфогенеза створки и хорошо размножается в лабораторной культуре. В экспериментах использовались два ингибитора работы микротрубочек с разным механизмом действия – колхицин и, впервые, паклитаксел. Колхицин блокирует сборку новых микротрубочек, связываясь с их растущими концами. Микротрубочки, которые подверглись деполимеризации, уже не могут восстановиться и вскоре разрушаются; при удалении колхицина из среды они восстанавливаются. Паклитаксел, напротив, блокирует деполимеризацию микротрубочек, связываясь с белком β-тубулином, что вызывает образование пучков микротрубочек.
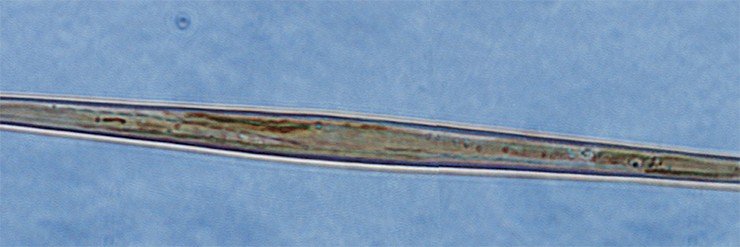
Эксперименты на синхронизированной культуре синедры показали, что добавление колхицина в определенный момент морфогенеза позволяет получить новые кремнеземные формы с определенной структурой (Kharitonenko et al., 2015). Так, самое большое количество створок с неравномерными и непараллельными рядами ареол (отверстий) встречается при добавлении колхицина через 1,5 часа после начала морфогенеза створки, а самое большое количество искривленных створок – через 0,5 часа. Самое интересное – створки без ареол появляются, только если добавить колхицин через 2,5 часа после начала морфогенеза! Это справедливо и в отношении паклитаксела, причем при использовании обоих этих ингибиторов доля створок с аномалиями и характер изменений их морфологии зависит от стадии морфогенеза, на которой ингибиторы добавляют в среду с культурой водоросли.



Однако воздействие паклитаксела приводит к появлению и таких аномалий в строении створки, которые не наблюдаются в случае применения колхицина. Среди них – крупные отверстия в створке (единичные случаи), а также расширение створки, довольно часто встречающееся при использовании паклитаксела на начальных стадиях морфогенеза.
Как из «стаканчика» сделать «трубочку»
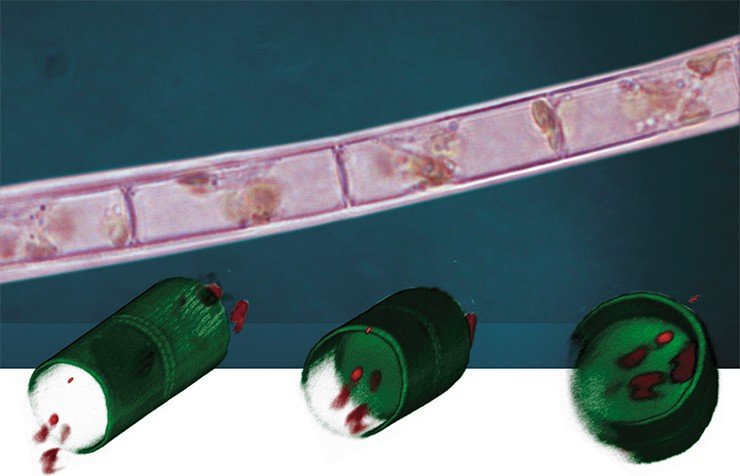
 Сотруднице ЛИН СО РАН Надежде Волокитиной удалось выделить в лабораторную культуру еще один вид диатомовых водорослей – Aulacoseira islandica, доминирующий в байкальском фитопланктоне в определенные сезоны. Морфогенез этой диатомеи, в отличие от синедры, сравнительно мало изучен. У представителей рода Aulacoseira створка благодаря своему необычайно высокому загибу напоминает «микростаканчик», а клетки в колониях прочно скреплены особыми соединительными шипами.
Сотруднице ЛИН СО РАН Надежде Волокитиной удалось выделить в лабораторную культуру еще один вид диатомовых водорослей – Aulacoseira islandica, доминирующий в байкальском фитопланктоне в определенные сезоны. Морфогенез этой диатомеи, в отличие от синедры, сравнительно мало изучен. У представителей рода Aulacoseira створка благодаря своему необычайно высокому загибу напоминает «микростаканчик», а клетки в колониях прочно скреплены особыми соединительными шипами.
Поскольку этот вид имеет тонкий панцирь, который сминается и разрывается при манипуляциях, при оценке воздействия ингибиторов на его морфогенез было решено использовать специальный флуоресцентный краситель, который встраивается в формирующиеся створки и позволяет наблюдать за результатом экпериментального воздействия в конфокальный микроскоп.
С помощью этой технологии удалось показать, что в присутствии колхицина в культуре появляются сросшиеся дочерние створки без перегородки, т. е. «микростаканчики» превращаются в «микротрубочки». Таким образом, если клетке на определенной стадии морфогенеза помешать соорудить «донышко» (лицевую часть створки), то она впоследствии продолжит строить загиб створки по запрограммированному сценарию, как если бы строители по какой-то причине не построили фундамент здания, а следующая бригада продолжила возведение стен или крыши.
Cегодняшние исследования механизмов формирования створок у диатомовых водорослей позволят в будущем использовать эти кремниевые бионанотехнологии на благо человечества, хотя сейчас мы находимся лишь в самом начале этого длинного пути. Не исключено, что дальнейшее изучение регуляции работы микротрубочек цитоскелета диатомей на клеточном и генетическом уровнях даст возможность получать культуры мутантных водорослей и «по заказу» создавать кремнеземные структуры с нужными характеристиками.

Литература
Кроуфорд Р. М. Гибшубер И. Мини-наноинженеры // НАУКА из первых рук. 2006. № 4 (10). С. 48—54
Delalat B., Sheppard V. C., Ghaemi S. R. et al. Targeted drug delivery using genetically engineered diatom biosilica // Nature Communications. 2015. N. 6.
Dumontet C., Jordan M. A. Microtubule-binding agents: a dynamic field of cancer therapeutics // Nat. Rev. Drug Discov. 2010 V. 9 P. 790–803.
Gale D. K., Gutu T., Jiao J., Chang C.-H., Rorrer G. L. Photoluminescence detection of biomolecules by antibody-functionalized diatom biosilica. Advanced Functional Materials. 2009. V. 19. P. 926–933.
Gebeshuber I. Biotribology inspires new technologies // Nano today. 2007. V. 2 N. 5. P. 30—37.
Gordon, R. & B. D. Aguda. Diatom morphogenesis: natural fractal fabrication of a complex microstructure // Harris, G. & C. Walker, Proceedings of the Annual International Conference of the IEEE Engineering in Medicine and Biology Society, Part 1/4: Cardiology and Imaging, 4—7 Nov. 1988, New Orleans, LA, USA, New York: Institute of Electrical and Electronics Engineers. 1988. V. 10. P. 273—274.
Grachev M. A., Annenkov V. V., Likhoshway Ye. V. (2008) Silicon nanotechnologies of pigmented heterokonts // BioEssays. 2008. V. 30. P. 328–337.
Sheppard V. C., Scheffel A., Poulsen N., Kröger N. Live diatom silica immobilization of multimeric and redox-active enzymes // Appl Environ Microbiol. 2012. V. 78 N. 1. P. 211–218.
В публикации использованы фото авторов