На пути к персонализированной медицине. Динамическая модель развития опухоли
В одном из номеров нашего журнала (№4, 2011) авторы этой публикации уже познакомили наших читателей с проблемами и методами персонализации лекарственной терапии рака – одной из самых серьезных и трудноизлечимых болезней наших дней. В новой публикации исследователи представляют результаты своей успешной многолетней работы по созданию оригинальной математической модели развития опухолей. Созданная на ее основе компьютерная программа уже в недалеком будущем может стать для специалистов-онкологов незаменимым инструментом при подборе индивидуальных схем лечения конкретным пациентам
Сегодня имеется много подходов к моделированию развития раковой опухоли – этим занимаются и биохимики, и системные биологи, и физики, и математики. И хотя в этих моделях используется большой массив знаний о деталях и механизмах онкологического процесса на клеточном и молекулярном уровнях, однако полноценной модели, адекватно описывающей это явление, до сих пор не создано.
Это и не удивительно, ведь сформировавшаяся опухоль представляет собой сложную систему, состоящую из нескольких миллионов клеток. И если, к примеру, поведение каждой из них описывать своей системой уравнений, то мощности современных компьютеров просто не хватит для проведения необходимых расчетов. Кроме того, такая модель должна учитывать влияние лекарственной терапии: специфическое действие, распространение и выведение лекарств из организма, – что достаточно непросто, а также взаимное влияние лекарств и опухоли, чего пока не делают даже самые сложные из современных моделей.
Но нельзя ли тогда использовать другой подход – «феноменологический», взяв в качестве основы что-то известное и уже проверенное на практике? И лишь потом, опираясь на реально измеримые величины, двигаться вглубь к пониманию более частных закономерностей? Оказывается, можно. А поскольку при разработке математических моделей сложных явлений всегда начинают с уже существующих более простых моделей, то в нашем случае это, как ни странно, будет математическое описание знакомого всем фазового перехода «вода–лед».
Такая аналогия далеко не случайна. Как известно, и вода, и лед достаточно стабильны при плавном изменении температуры, но в окрестностях 0 °С свойства системы резко меняются. Какое-то время в ней в относительном равновесии могут существовать сразу обе фазы, резко различающиеся по свойствам, в частности по плотности. Тем не менее этот фазовый переход обратим, а его условия определяются рядом параметров, как внешних для системы, так и внутренних.
Можем ли мы говорить о «фазовых превращениях» в системе «нормальная ткань–раковая опухоль»? Онкологи отмечают значительную стабильность раковых образований; в то же время нормальные ткани тоже достаточно стабильны – здоровый организм успешно сопротивляется всему, что пытается это состояние нарушить. Сформировавшаяся опухоль значительно отличается от окружающих ее родительских тканей, с которыми она, тем не менее, может сосуществовать значительное время. Вместе с тем при определенных условиях (например, успешном лечении) раковые опухоли могут регрессировать – «таять».
Безусловно, напрямую переносить модели типа «фазовый переход», разработанные для неживых систем, на неживые нельзя. Тем не менее попытки применять их для описания поведения живых систем в математической физике делаются давно. В том числе за последние десятилетия значительные успехи в этом направлении были достигнуты итальянскими исследователями во главе с итальянским профессором Н. Белломо, разработавшими кинетическую теорию активных частиц (Bellomo et al., 2009; Bellomo, 2010).
Авторы данной статьи на основе этой теории и обобщенного математического описания фазовых переходов начали разработку математического аппарата для моделирования развития раковых опухолей (Mamontov, et al., 2006). Затем был сделан следующий шаг: за четыре года удалось уверенно связать формальные параметры, используемые в модели, с величинами, реально измеримыми на практике.
На пяти постулатах
Модель, описывающая динамику поведения плотных раковых опухолей, базируется на небольшом числе постулатов.
• Раковая опухоль возникает в результате сбоя механизмов регулирования. Если механизм, поддерживающий баланс между числом умирающих и рождающихся клеток нарушается, то клетки могут начать бесконтрольно делиться. Если контроль утерян полностью, то возникает раковая опухоль, с которой организм сам может и не справиться. Если же ему «помочь» лечением, то контроль может восстановиться, и раковая опухоль исчезнет.
• Плотная раковая опухоль образуется из так называемого инфламмационного инфильтрата, т. е. плотного воспалительного «желвака». Вообще сам воспалительный процесс является частью регуляторных и защитных механизмов, и только перейдя определенный предел, воспаление может становиться опасным, чему имеются экспериментальные подтверждения. Интересно, что в русском языке онкологическое образование так и называется – «опухоль».
• Динамику воспалительного процесса можно количественно описать, следя за изменением концентрации клеток – числа клеток в единице объема ткани. Для формулирования нужных уравнений можно воспользоваться следующими утверждениями. Во-первых, оба состояния ткани – «нормальное» и «раковая опухоль» – являются «устойчивыми» (асимптотически стабильными). Во-вторых, контроль над делением и запрограммированной смертью клеток осуществляется биохимическим путем – «доставкой» к клеткам определенных сигнальных молекул. (Это утверждение не совсем корректно в отношении опухолей с развитой системой кровеносных сосудов). В-третьих, каждая клетка ткани выбирает один из двух путей развития – «нормальный» или «бесконтрольное деление» (математически речь идет о вероятности).
• Для каждой точки нашего организма в каждый конкретный момент времени существует некоторая «критическая» концентрация клеток, выше которой регуляторные системы человеческого организма просто не способны поддерживать баланс между делением клеток и их гибелью. Если не изменить концентрацию клеток (например, уничтожив часть из них, используя тот или иной метод терапии) или не сдвинуть саму точку критического порога, то деление пойдет бесконтрольно и образуется раковая опухоль.
• Концентрация лекарства в тканях и ее изменение в пространстве и времени неразрывно связаны с развитием опухолей в пространстве и времени. Хорошая (адекватная) модель обязана учитывать это обстоятельство, чего не делают в силу своего происхождения фармакокинетические и фармакодинамические модели.
Надо сказать, что все эти постулаты достаточно серьезно обоснованы: на сегодняшний день авторам не удалось обнаружить ни одного экспериментально подтвержденного факта, вступающего с ними в противоречие. Конечно, не следует забывать, что любая модель ограничена и является лишь приближенным описанием действительности. Например, как выше отмечалось, эта модель мало применима к описанию роста опухолей на поздних стадиях развития, когда они густо пронизаны кровеносными сосудами.
Когда потерян контроль
Теперь уже в рамках такого подхода можно качественно описать появление и развитие раковой опухоли.
В наших тканях клетки вовсе не находятся «в свободном плавании». Они как строительными лесами окружены коллагеновым «каркасом» и межклеточной жидкостью, занимающей свободный объем. Вся жизнь клетки контролируется извне путем поступления к ней определенных химических веществ. Эти молекулы распространяются в межклеточной жидкости довольно медленно – примерно так, как диффундирует в стакане воды капля чернил. Например, даже введенное внутривенно лекарство разносится кровотоком только по сосудам, а потом его распространение в основном также контролируется диффузией.
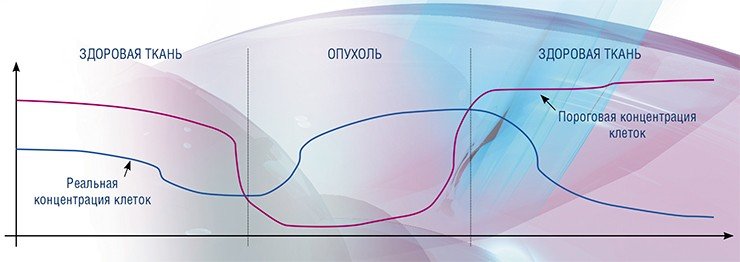
Если концентрация клеток в ткани не слишком велика, то межклеточная жидкость эффективно доставляет химические вещества (в том числе и сигнальные молекулы) ко всем клеткам. При этом эффективно работает и механизм, обеспечивающий равновесие между делением клеток и их запрограммированной гибелью. Если же из-за воспалительного процесса или из-за временного сбоя механизма регуляции концентрация клеток в каком-то месте вырастает, то объем, занимаемый межклеточной жидкостью, уменьшается. Соответственно, механизм поддержания клеточного «баланса» должен увеличить число поступающих в межклеточную жидкость «сигнальных» молекул, чтобы необходимое их количество достигло адресатов.
Однако у любого механизма существует предел, который в нашем случае может быть обусловлен, например, производительностью «биохимической фабрики». К тому же регулирование – процесс не мгновенный, он определяется скоростью диффузии. Поэтому при достижении некоторой концентрации клеток механизм восстановления баланса перестает справляться с ситуацией: число поступающих к клеткам сигнальных молекул становится недостаточным, чтобы предотвратить их неконтролируемое деление. В результате концентрация клеток в данной области еще более увеличивается. В дальнейшем этот неконтролируемый процесс может прийти к другому стабильному состоянию – к плотной раковой опухоли.
В уже сформировавшейся области «потери контроля баланса» концентрация клеток распределена неравномерно: на периферии она ниже, чем в центре, где клетки дольше делились без контроля. Но поскольку контроль над ситуацией уже полностью потерян, концентрация клеток продолжает расти везде, сдвигая границы зоны «потери контроля» все дальше и дальше. Опухоль начинает увеличивать свои размеры и одновременно становится все более плотной в центре.
Если же теперь внутривенно ввести лекарственный препарат, то проникнуть в центр опухоли ему будет достаточно сложно: лекарство будет работать только на периферии, там, где доставка пока еще эффективна. При этом регулирование на периферии может восстановиться, и там начнется постепенное уменьшение концентрации клеток. Улучшится и доставка химических веществ к более плотным внутренним частям опухоли. Если концентрация клеток в ткани будет оставаться ниже пороговой, этот процесс при продолжении правильного лечения будет продолжаться вплоть до полного исчезновения опухоли.
В одном уравнении
Исходной задачей авторы поставили создание «минималистической» модели, которая учитывала бы только абсолютно необходимые для описания явления связи и параметры и при этом позволяла бы качественно и количественно предсказывать динамику развития опухолей, в том числе и при использовании лекарств.
В результате «тотальной минимизации» все удалось свести к одному (!) нелинейному дифференциальному диффузионно-кинетическому уравнению, куда входят всего шесть параметров: критическая концентрация клеток (величина порога «срыва» регулирования), «предпочтительная» концентрация клеток (т. е. концентрация, которую стремится поддерживать механизм регулирования), коэффициент диффузии, время жизни клетки, «скорость» смерти клеток, а также параметр, связанный с суммарной продолжительностью стадий клеточного цикла. Подобного рода уравнения достаточно легко просчитываются на современных, даже не самых мощных компьютерах.
Созданная на основе этой модели программа PhasTraM (от Maintenance of the cell concentrations via Phase Transitions или «поддержка клеточных концентраций с позиций теории фазовых переходов») даст возможность практикующим медикам подбирать режим терапии для конкретного больного, опираясь на результаты биохимических анализов. Программа может выдавать прогноз результатов лечения с учетом применения выбранного лекарства по заданной схеме. Если же прогноз окажется неудовлетворительным, то подбор лечения можно продолжить.
Безусловно, заменить человека подобная программа никогда не сможет – решение о назначении способа лечения всегда остается за специалистом, но она позволяет быстро перебрать большое число допустимых вариантов или предложить оптимальный режим терапии. Поскольку перебор вариантов производится на «виртуальном» пациенте, для реального человека риск отсутствует.
Нужно отметить, что в рамках данной модели для «раскрутки спирали» бесконтрольного деления клеток необязательно наличие их повышенной концентрации. Для этого достаточно в какой-то точке пространства сбиться механизму регулирования (говоря языком модели, достаточно критической концентрации по какой-то причине упасть ниже концентрации клеток в данной точке пространства). И тогда картина срыва регулирования, описанная выше, будет непременно реализована. Подобное может произойти, например, из-за ослабления общего иммунитета, сильного хронического стресса, попадания в организм ядов или канцерогенных химических веществ.
Более того: данная модель допускает возможность «излечения без медикаментов», например, за счет улучшения собственного иммунитета или даже эмоционального состояния в противоположность стрессу. Все, что помогает существующей системе регулирования в восстановлении баланса, может снова вывести систему на траекторию к основному устойчивому состоянию – здоровой ткани. Правда, ожидать этого для любой опухоли вряд ли стоит, но меры по улучшению иммунитета и душевного состояния больного обязательно будут способствовать успеху правильного терапевтического лечения.
Как она работает
Параметры, которые пользователь должен ввести в программу, разбиты на две основные группы – индивидуальные данные о пациенте и самой опухоли; данные о лекарстве и режиме его использования; а также данные, определяющие режим моделирования.
В первую группу входят результаты анализа ткани, полученной при помощи не совсем обычной биопсии с множественными пробами. Нужны несколько образцов из здоровой ткани, окружающей опухоль, а также из самой опухоли, причем необходимо точно знать расстояния между точками отбора проб.
Хотя такая биопсия сложнее обычной, она дает очень низкий процент осложнений, даже в случае такого «деликатного» органа, как печень. Сразу оговоримся, что на данном этапе модель рассматривает только сферически симметричные опухоли. Это ограничение связано с тем, что в ином случае потребовалась бы биопсия по трем, желательно ортогональным, осям. Это бы осложнило и удорожило подготовку исходных данных, а главное, значительно увеличило риск возможных осложнений для пациента.
Для каждой из проб должны быть определены средние показатели длительности фаз клеточного цикла, объема клеток, доли объема, занятого коллагеновой матрицей и динамической вязкости ткани. Хотя эти параметры сегодня не измеряются при стандартной биопсии, методы их измерения известны и вполне доступны. Проблема имеется лишь с использованием понятия «вязкость» применительно к живым тканям, в частности потому, что вязкость ткани нельзя померить стандартными жидкостными вискозиметрами. Ее удалось обойти, заменив параметр вязкости коэффициентом диффузии (правда, в этом случае вязкость становится не прямо измеряемым, а вычисленным параметром). Зато с помощью магниторезонансной томографии сегодня можно неинвазивно получить «карты» распределения коэффициента диффузии молекул воды в тканях с очень высоким пространственным разрешением (Schepkina et al., 2006).
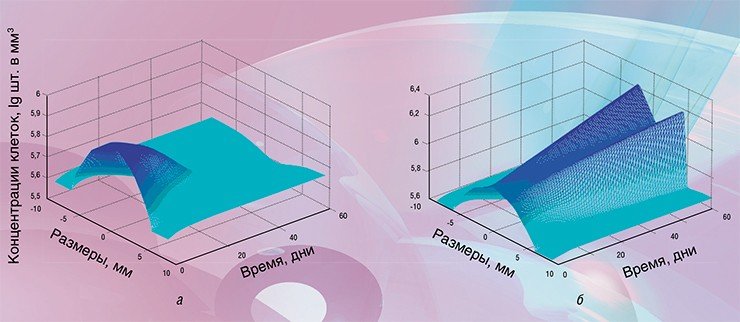
Одним из известных «биомаркеров» хронического стресса является интерлейкин-6 (IL-6) – небольшие белковые молекулы, непосредственно участвующие в иммунном отклике. Экспериментально показано, что концентрация этих молекул в тканях при хроническом стрессе возрастает. При гистопатологических исследованиях раковых опухолей в них также часто отмечают значительно повышенные концентрации IL-6.
В настоящее время считается, что так называемые «гиперпластические полипы», являющиеся одной из стадий развития раковых опухолей, возникают при сочетании наличия воспалительного процесса и высоких концентраций IL-6, которые могут быть вызваны, в том числе, и хроническим стрессом. Более того, наличие повышенных концентраций молекул IL-6 в тканях само по себе является индикатором нарушения правильного функционирования одной или нескольких автокринных регуляторных цепей.
При моделировании динамики развития уже имеющейся опухоли при нормальной и повышенной концентрациях IL-6 в тканях обнаружилось, что в первом случае собственные регуляторные системы организма вполне справляются с ее уничтожением, тогда как при высоких уровнях IL-6 происходит быстрый рост опухоли. Таким образом, в рамках модели получено подтверждение влияния хронического стресса на развитие раковой опухоли
Во вторую группу данных, если использовать в качестве примера внутривенные препараты, входят: название препарата из встроенной библиотеки программы, его доза, количество и длительность инъекций. Аналогичный список можно привести для других форм применения препаратов, например таблеток или инъекций, однако точность моделирования при оральном приеме лекарств падает.
Таким образом, для каждого лекарства в программе должен существовать особый «модуль», где детально описано его действие. Оказалось, что для моделирования в целях персонализации терапии лекарства нужно выбирать по фирменному названию, а не по действующему веществу, так как очень часто оно является далеко не единственным составляющим. Еще одна проблема – существование множества так называемых дженериков, непатентованных аналогов оригинального препарата, предполагающих лишь наличие статистически обоснованной схожести действия (Le Corre, 2010).
Уже сегодня программа может выдавать прогноз успеха терапии с использованием цитотоксических (разрушающих клетки) препаратов, таких как радионуклиды и различные препараты химиотерапии. Сравнительно недавно в программу включена возможность работы с нецитототоксическими препаратами (на основе моноклональных антител, а также ингибиторами фермента тирозин-киназы), а также с «сигнальными» веществами, например интерлейкином-6. В рамках подхода имеется также возможность персонализации лучевой и фотодинамической терапии, однако они пока не реализованы.
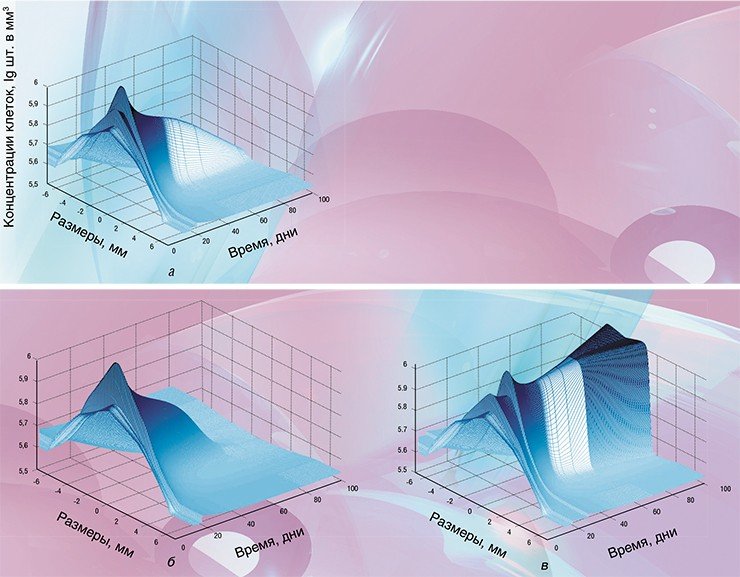
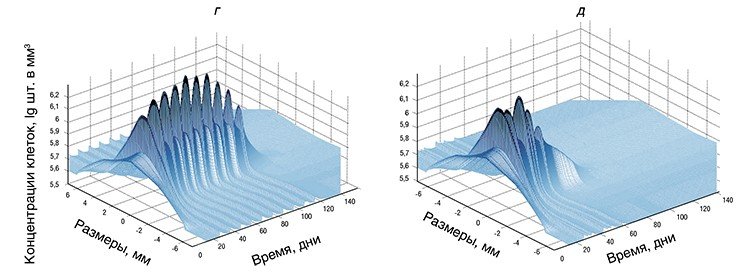
Итак, исходные данные в программу загружены. Сама работа программы занимает около одной минуты даже при использовании сравнительно маломощных ноутбуков. Вывод данных осуществляется в виде, выбранном пользователем, и представляет собой ряд различных графиков и поверхностей, иллюстрирующих динамику развития опухоли при выбранной терапии.
В качестве примера приведем подбор режимов лечения радионуклидными препаратами. В последние годы такие препараты часто вводят дробными дозами, чтобы уменьшить вероятность осложнений, однако вариантов терапии даже при двух дробных дозах существует множество. Если же требуются более мелкие дозы (например, для обеспечения более щадящего режима лечения), то, соответственно, многократно увеличивается и возможное количество вариантов.
Программа позволяет варьировать как дозу каждой инъекции, так и время между инъекциями. Не имея возможности быстро оценивать, какие варианты будут более эффективными, практикующие врачи обычно выбирают одинаковые дозы и одинаковое время между введением этих доз. Однако при наличии прогнозирующей модели перебор вариантов и оптимизацию схемы лечения можно «поручить» компьютеру. То есть моделирование позволяет минимизировать как общую дозу цититоксического препарата, так и время -лечения.
В результате многолетней работы удалось создать модель, адекватно описывающую динамику развития опухоли. Качественно модель хорошо согласуется со всеми известными экспериментальными данными. Количественная проверка модели была проведена на основе материалов из архивов Шальгренского исследовательского госпиталя (Гетеборг, Швеция) и результатов собственных экспериментов авторов. С помощью сотрудников Тюменского отделения РАН сейчас проводятся новые эксперименты на лабораторных животных с целью проверки основных постулатов модели без использования статистических методов усреднения.
Использование небольшого числа входных параметров предопределило пригодность модели для практического использования – научная разработка «превратилась» в пакет программ для индивидуальной терапии онкологических больных. Сегодня продолжается работа по включению в программу новых модулей для различных лекарств, созданию версий для различных операционных систем, а также упрощенной версии, пригодной для обучения.
Одна из будущих версий программы предназначена для разработчиков новых противораковых препаратов, которые смогут оценивать их эффективность на «виртуальных пациентах». И конечно, ее создатели надеются, что уже в самом ближайшем будущем они смогут предложить рабочий вариант программы практикующим врачам-онкологам.
Литература
Basso A. M., Depiante-Depaoli M., and Molina V. A. Chronic variable stress facilitates tumoral growth: reversal by imipramine administration // Life Sciences. 1992. Vol. 50. P. 1789—1796,
Corre P. Le. Bio-équivalence et génériques de principes actifs à marge thérapeutique étroite (Narrow therapeutic index drugs: bioequivalence and generics) // Presse Medicale. Feb 2010. Vol. 39, No. 2. P. 169-176.
Koptioug A., Mamontov E., Myrberg T., Sukhovey Yu. Software for pretherapeutic design of tumor/patient-individual tumor-eradicating drug regimens // Communications in Applied and Industrial Mathematics. 2012 (в печати).
Mamontov E., Koptioug A., and Psiuk-Maksymowicz K. The minimal, phase-transition model for the cell-number maintenance by the hyperplasia-extended homeorhesis // Acta Biotheoretica. 2006. Vol. 54. P. 61–101.
Schepkina V. D., Chenevert T. L., Kuszpit K., Lee K. C. et al. Sodium and proton diffusion MRI as biomarkers for early therapeutic response in subcutaneous tumors // Magnetic Resonance Imaging. 2006. Vol. 24. P. 273–278.