НАНОайболиты. Бактериофаги как альтернатива антибиотикам в ветеринарии
Среди болезней сельскохозяйственных животных на первом месте стоят инфекционные заболевания, которые приносят существенный экономический ущерб из-за гибели животных и потери продуктивности, а также немалых затрат на организацию мер профилактики и борьбы. Особое значение имеют инфекции, которым наряду с животными подвержен и человек: сибирская язва, бешенство, бруцеллез, лептоспироз, сальмонеллез и т. д.
Одной из ключевых, наиболее активно развивающихся отраслей сельского хозяйства во многих странах мира сегодня является птицеводство. Ежегодно производится около 300 млн т мяса, для чего выращивается более 500 млрд бройлеров. И примерно 5 % этой птицы погибает, т. е. каждую секунду от различных болезней умирает более 800 цыплят! Одной из основных причин смертности сельскохозяйственной птицы служат болезнетворные бактерии, в том числе опасные для человека. Для нашей страны наиболее актуальны такие патогены, как листерии, иерсинии, сальмонеллы, кампилобактерии и некоторые штаммы кишечной палочки.
Нужно заметить, что с проблемой инфекционных болезней рано или поздно сталкивается любое животноводческое предприятие, вне зависимости от того, на чем оно специализируется, будь то крупный или мелкий рогатый скот, свиньи, пушные животные и т. д. Обеспечение здоровья животных и безопасности продуктов питания требует активного противодействия патогенным микроорганизмам. С момента открытия пенициллина в 1928 г. основным средством борьбы с бактериальными инфекциями стали антибиотики. Однако несмотря на постоянное появление на рынке все новых препаратов, появление мультирезистентных форм бактерий, устойчивых практически ко всем антибиотикам, стало серьезной проблемой не только в здравоохранении, но и в ветеринарии.
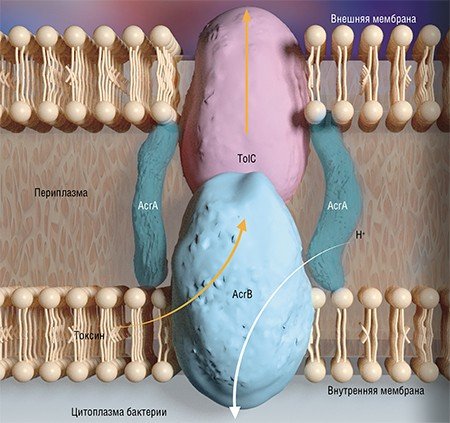 Применение антибиотиков в животноводстве и птицеводстве постоянно подвергается критике, так как, с одной стороны, они могут попадать в продукты питания человека, с другой – стимулировать возникновение новых лекарственно-устойчивых возбудителей инфекций. К тому же использование антибиотиков в сельском хозяйстве не всегда является обоснованным, а порой даже вредит. К примеру, при заболеваниях свиней применение антибиотиков часто является «палкой о двух концах». Так, при клостридиозе бактерия, защищаясь от антибиотика, иногда может образовывать споры и вырабатывать токсины, вызывая токсикоинфекцию и повреждая слизистую кишечника. А в случае репродуктивно-респираторного синдрома антибиотики часто усугубляют течение этой вирусной инфекции, провоцируя воспаление в легких.
Применение антибиотиков в животноводстве и птицеводстве постоянно подвергается критике, так как, с одной стороны, они могут попадать в продукты питания человека, с другой – стимулировать возникновение новых лекарственно-устойчивых возбудителей инфекций. К тому же использование антибиотиков в сельском хозяйстве не всегда является обоснованным, а порой даже вредит. К примеру, при заболеваниях свиней применение антибиотиков часто является «палкой о двух концах». Так, при клостридиозе бактерия, защищаясь от антибиотика, иногда может образовывать споры и вырабатывать токсины, вызывая токсикоинфекцию и повреждая слизистую кишечника. А в случае репродуктивно-респираторного синдрома антибиотики часто усугубляют течение этой вирусной инфекции, провоцируя воспаление в легких.
Но если мы ограничим применение антибиотиков для животных, не приведет ли это к росту заражения людей патогенными бактериями и, соответственно, росту потребления антибиотиков уже в человеческой популяции? Кроме того, сегодня известны механизмы, которые могут приводить к появлению у бактерий антибиотикорезистентности даже при отсутствии контакта с этими препаратами.
Сложная ситуация подогревает интерес к поиску новых терапевтических средств, которые могут заменить или дополнить антибиотики в борьбе с инфекционными заболеваниями. Поиски альтернативных путей лечения бактериальных инфекций сразу выдвинули на первое место фаготерапию и фагопрофилактику (Акимкин и др., 2010).
От лаборатории – к птицефабрике
Пионерами в использовании фагов для лечения животных можно считать английских ученых У. Смита и его коллег из Института исследования заболеваний животных (Smith et al., 1987). В своих исследованиях на лабораторных мышах, экспериментально зараженных кишечной палочкой, они обнаружили, что даже единичное введение препарата бактериофага значительно уменьшало количество жизнеспособных клеток E. coli в пищеварительном тракте. Позже они повторили этот опыт на телятах, ягнятах и морских свинках, зараженных вирулентным штаммом кишечной палочки, вызывающим диарею. И в этих случаях фаготерапия снижала численность бактерий в желудочно-кишечном тракте, а также смягчала такие связанные с инфекцией симптомы, как обезвоживание. В результате практически все инфицированные животные выжили.
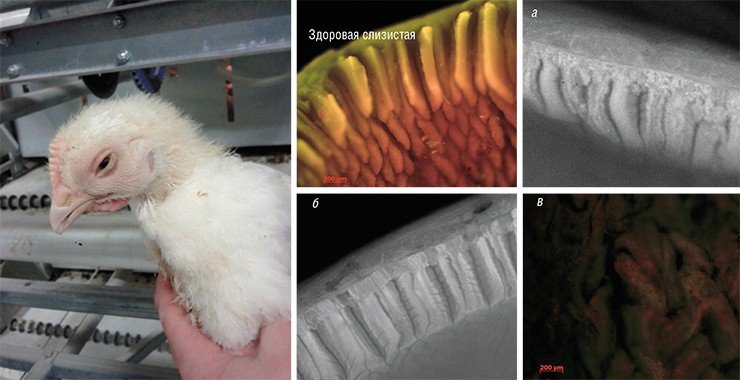
Применение препаратов бактериофагов в условиях крупных агрокомплексов имеет свои особенности, благоприятствующие подобной терапии. Системы обеспечения биологической безопасности на больших сельскохозяйственных предприятиях достаточно эффективно ограничивают разнообразие инфекций и, соответственно, число видов патогенных микроорганизмов там намного меньше, чем в человеческой популяции. По этой причине инфекции на таких предприятиях высоко воспроизводимы, и диагноз, поставленный в одном птичнике, можно экстраполировать на другие. Но при этом надо помнить, что бактерии могут защититься от фагов. Так, эксперименты на бактериальных монокультурах показали, что в результате применения фагов уже через несколько часов возникают бактериальные клетки, устойчивые к их действию. Кроме того, в отличие от антибиотиков с их относительно широким спектром действия, не существует такого «супербактериофага», который будет атаковать большое число различных штаммов и видов микроорганизмов. Поэтому в практике обычно используют сложные коктейли бактериофагов.
В наши дни становится технически и экономически возможным вести поиск бактериофагов и производство соответствующего биопрепарата для отдельно взятого предприятия. Уничтожить таким образом весь спектр патогенных бактерий нельзя, однако против наиболее важных в санитарном или эпидемическом плане бактерий вполне реально подобрать и применить эффективные бактериофаги.
На сегодня уже имеется успешный опыт применения препаратов бактериофагов против сальмонелл и кишечной палочки на крупных птицефабриках. Например, на одной из отечественных птицефабрик, где наблюдался аномально высокий (50—70 %) уровень инфицированности цыплят-бройлеров сальмонеллой, за несколько месяцев удалось снизить этот показатель до нерегистрируемых значений. К тому же на крупных птицефабриках и свинокомплексах, где имеется высокая скученность животных, распространение бактериофагов, вакцинных штаммов вирусов и полезных, пробиотических штаммов бактерий идет по типу эпидемического процесса, что значительно удешевляет и повышает эффективность борьбы с инфекциями.
В приведенном выше примере с сальмонеллой в процессе фаготерапии произошла смена серотипа бактерий, в результате чего появился новый штамм Infantis, оказавшийся устойчивым к используемому бактериофагу. Этот факт наводит на мысль, что бактериофаги могут выступать для бактерий как фактор межвидовой конкуренции. Ведь бактерии рода Salmonella встречаются в кишечнике в относительно низкой концентрации, и можно ожидать, что между разными видами и подвидами этого рода конкуренция будет отсутствовать (Antunes et al., 2016). Однако последовательная смена различных серотипов сальмонелл в популяциях кур позволяет предполагать неслучайный характер этого явления.
Так, в настоящее время сальмонеллы серотипов Gallinarum и Pullorum практически не обнаруживаются в отличие от серотипа Enteritidis, который, в свою очередь, по частоте встречаемости намного уступает новому серотипу Infantis. Интересно, что именно в период роста инфицированности кур сальмонеллами серотипа Infantis сотрудники Института химической биологии и фундаментальной медицины СО РАН и Государственного научного центра вирусологии и биотехнологии «Вектор» выделили из образцов довольно много бактериофагов, активных в отношении сальмонелл серотипа Enteritidis, но с очень большим трудом удалось обнаружить штамм бактериофага против сальмонелл серотипа Infantis. Конечно, этому явлению может быть найдено немало объяснений, но и версия участия бактериофагов в вытеснении бактерий близкородственных генетических групп выглядит весьма правдоподобной.
Для меньших братьев Домашние питомцы, такие как кошки и собаки, также подвержены бактериальным инфекционным заболеваниям. При этом они намного плотнее, чем сельскохозяйственные животные, контактируют с людьми, поэтому могут служить более опасным источником инфекций, таких как лептоспироз, при котором часто поражаются почки и печень, или кишечный иерсиниоз, который у человека сопровождается хроническими болями в животе, диареей и иногда даже приводит к гибели. Высокопатогенные формы кишечной палочки, сальмонеллы, кампилобактерии и клостридии тоже могут попасть в организм человека от собак и кошек, вызывая кишечные инфекции, бактериальный сепсис и гемолитикоуремический синдром. Применение бактериофагов для лечения животных в такой ситуации было бы одновременно и хорошим средством профилактики инфекций у их хозяев, причем в этом случае отсуствовал бы риск заразиться от животных антибиотикоустойчивыми бактериями.
Домашние питомцы, такие как кошки и собаки, также подвержены бактериальным инфекционным заболеваниям. При этом они намного плотнее, чем сельскохозяйственные животные, контактируют с людьми, поэтому могут служить более опасным источником инфекций, таких как лептоспироз, при котором часто поражаются почки и печень, или кишечный иерсиниоз, который у человека сопровождается хроническими болями в животе, диареей и иногда даже приводит к гибели. Высокопатогенные формы кишечной палочки, сальмонеллы, кампилобактерии и клостридии тоже могут попасть в организм человека от собак и кошек, вызывая кишечные инфекции, бактериальный сепсис и гемолитикоуремический синдром. Применение бактериофагов для лечения животных в такой ситуации было бы одновременно и хорошим средством профилактики инфекций у их хозяев, причем в этом случае отсуствовал бы риск заразиться от животных антибиотикоустойчивыми бактериями.
К сожалению, в арсенале ветеринарии на сегодняшний день нет препаратов бактериофагов против таких тяжелых болезней, как лептоспироз и иерсиниоз, хотя исследования по созданию поливалентных противоиерсиниозных бактериофагов ведутся достаточно активно. Поиск в сети, в том числе на форумах владельцев животных, свидетельствует, что в перечень средств для лечения животных ветеринары включают «человеческие» фаговые препараты: «бактерофаг стафилококковый» и «бактериофаг стрептококковый», которые используются для лечения и профилактики гнойных заболеваний кожи и слизистых оболочек, а также других инфекций с участием этих бактерий; «пиобактериофаг комбинированный» («пиополифаг»), который обладает широким спектром антибактериальной активности и используется при лечении ряда гнойно-воспалительных заболеваний. Для специфической терапии колибатериоза, вызываемого патогенными штаммами кишечной палочки, который приводит к гибели щенков и котят, можно использовать «бактериофаг против паратифа и колибактериоза»
В научной литературе достаточно широко освещены и явление полигостальной специфичности (способности заражать широкий спектр видов бактерий) в отношении разных видов бактерий, и феномен разной фагорезистентности у разных штаммов внутри одного вида бактерий по отношению к одному и тому же бактериофагу. Очевидно, что штамм бактерии, способный поддерживать существование бактериофага без гибели клетки-хозяина, может получить эволюционное преимущество, так как станет причиной гибели бактерий-конкурентов, чувствительных к бактериофагу. Этот пример показывает, как много различных биологических идей можно извлечь, наблюдая взаимоотношения бактерий с бактериофагами. Кроме того, изучая спонтанное распространение бактериофагов по птицефабрикам и свинофермам, мы можем совершенно безопасно моделировать эпидемии.

Безусловно, в ближайшем будущем бактериофаги не смогут заменить антибиотики. Но в ситуациях, когда антибиотики уже не помогают, а также, когда нужно снять риск возникновения антибиотико-устойчивых штаммов бактерий, бактериофаги должны занять свое законное место.
В ветеринарии использование бактериофагов намного перспективнее, чем в медицине. Ведь новые ветеринарные лекарства быстрее выводятся на рынок, чем лекарства для человека. К тому же в крупных животноводческих хозяйствах специалисты сталкиваются с меньшим разнообразием инфекций при диагностике, чем у людей, что упрощает этап формирования коллекций бактерий и подбора бактериальных вирусов.
Литература
Андреева И. С., Соловьянова Н. А., Афонюшкин В. Н. и др. Перспективы фаготерапии сальмонеллезов птицы в сельскохозяйственном производстве // Современное общество, образование и наука: Сб. науч. тр. по материалам Международной научно-практической конференции. 2013. С. 10—13.
Акимкин В. Г., Дарбеева О. С., Колков В. Ф. Бактериофаги: исторические и современные аспекты их применения: опыт и клинические перспективы // Клиническая практика. 2010. Т. 4. С. 48—54.
Antunes P., Mourão J., Campos J., Peixe L. Salmonellosis: the role of poultry meat // Clin. Microbiol Infect. 2016. V. 22. P. 110—121.
Klaas M. Pos, Trinity revealed: Stoichiometric complex assembly of a bacterial multidrug efflux pump // PNAS. V. 106. N. 17. P. 6893—6894, doi: 10.1073/pnas.0902837106
Smith, H.W., Huggins, M.B., Shaw, K.M. Factors influencing the survival and multiplication of bacteriophages in calves and in their environment // J. Gen. Microbiol. 1987. V. 133. P. 1127—1135.