Нуклеиновый конструктор
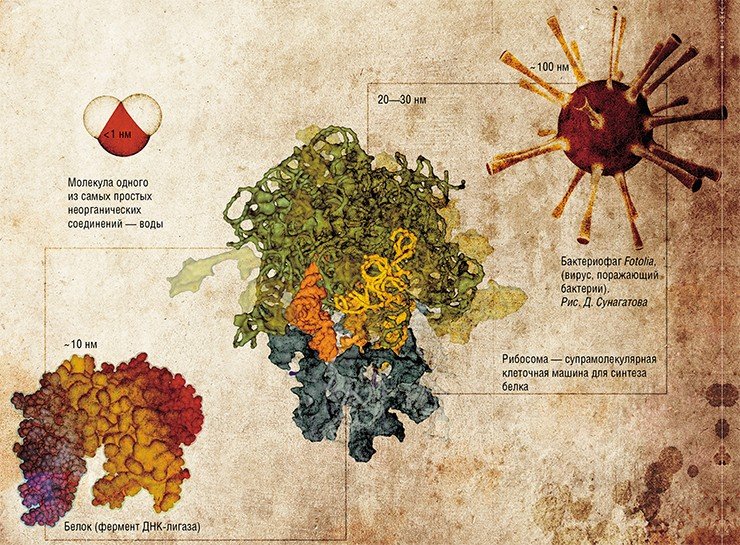
Молекулы относительно простых соединений имеют размеры меньше одного нанометра. Однако в разряд нанообъектов попадают и биологические макромолекулы, такие как белки и нуклеиновые кислоты, а также еще более крупные молекулярные «клеточные машины» и даже самые «простые» живые организмы – вирусы. Фундаментальными исследованиями этих объектов традиционно занималась и занимается молекулярная биология. Наряду с этим ученые работали над проблемами синтеза природных макромолекул, создания и применения их искусственных аналогов с новыми свойствами, причем делали это задолго до того, как нанотехнологии были объявлены государственным приоритетом
В нанодавние времена в наностране люди строили дома из нанокирпичей,
которые валялись в информационном поле. Нанофольклор
Нанотехнологии – современный подход к использованию таких свойств вещества, которые определяются его структурными элементами нанометровых размеров. Последнее означает, что при переходе вещества из макро- и микро- в наносостояние может происходить резкое, скачкообразное изменение его характеристик: физических, химических и биологических. Нанотехнология, а точнее, ее «теоретическая» ветвь, нанонаука (nanoscience), как раз и занимается изучением причин появления у вещества подобных квантовых свойств.
В практической области существование феномена «нановещества» позволяет разрабатывать технологии направленного изменения свойств материалов за счет их специфического структурирования на наноуровне. Продуктом нанотехнологий становятся необычные по свойствам материалы; ультрамалые замысловатые пространственные структуры; невидимые глазу совершенные механизмы, способные выполнять только им посильные операции на микроскопическом уровне.
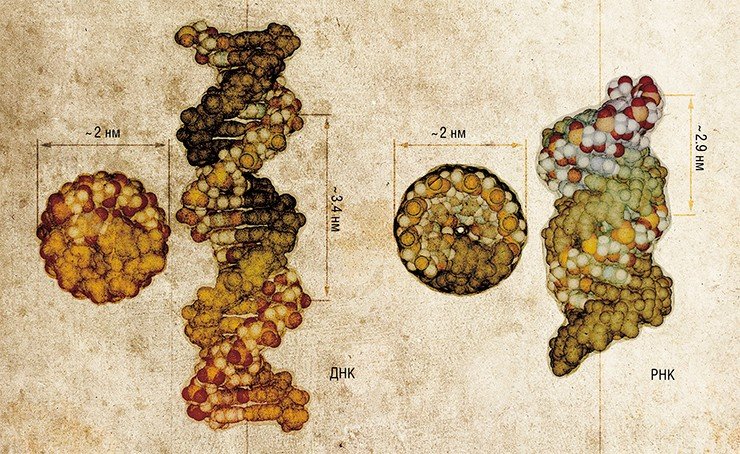
Один нанометр (одна милионная часть миллиметра) соответствует величине несложной молекулы, а наиболее простые соединения, такие как вода, имеют значительно меньший размер. Основными деталями бионанотехнологического конструктора являются значительно более крупные органические молекулы, а также супрамолекулярные комплексы – сложно организованные надмолекулярные структуры. Их размер составляет от нескольких нанометров до десятков и сотен.
Роль главных структурных элементов в бионаноконструировании отводится молекулам нуклеиновых кислот – ДНК и РНК. Дело в том, что эти биополимеры обладают удивительной способностью самоорганизовываться в характерные пространственные конструкции – двуцепочечные структуры, удерживаемые комплементарными взаимодействиями. Это позволяет использовать нуклеиновые кислоты не только в качестве носителя генетической информации (записанной в последовательности биополимера четырьмя «буквами»-нуклеотидами), но и как удобные строительные блоки при создании наноконструкций.
Сегодня нуклеиновые кислоты являются доступным материалом благодаря разработке эффективных методов синтеза. Так, с помощью специальных приборов – синтезаторов можно в автоматическом режиме производить нуклеотидные цепи длиной до сотни звеньев. Поскольку «ассортимент» таких молекул ограничен лишь изобретательностью самого наноконструктора, сфера применения нуклеиновых кислот благодаря их доступности и практичности быстро расширяется.
От покрытий до моторов
Самым простым примером самоорганизованной сборки наноструктур из нуклеиновых кислот является формирование ДНК-конкатемеров – полимерных структур из блоков, образованных лишь парой олигонуклеотидов (фрагментов ДНК). С помощью подобного подхода можно сконструировать также дву- и трехмерные структуры. При создании плоских и объемных конструкций наряду с «простыми» олигонуклеотидами используются также их конъюгаты (от лат. conjugatio – соединение) с другими нанообъектами неорганической или органической природы, например, с молекулами белка.
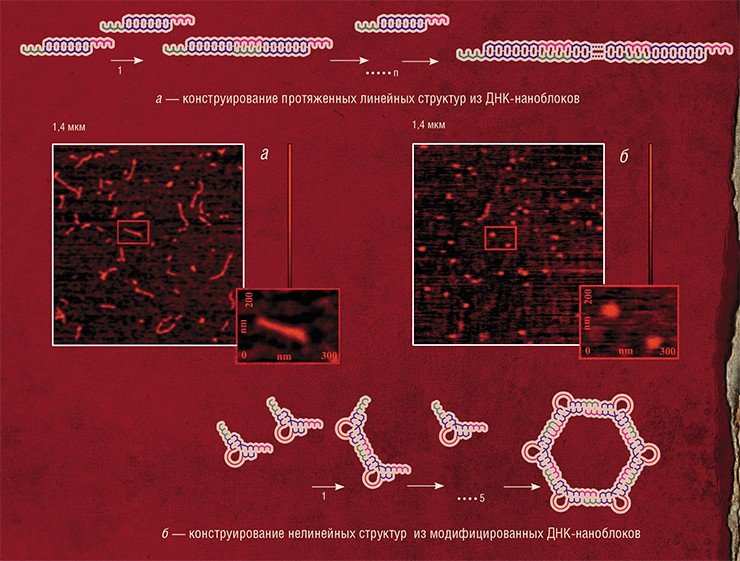
В том числе можно получить упорядоченные пленочные структуры, где неорганические наночастицы выступают в качестве узлов-разветвителей. Такие материалы рассматриваются в качестве перспективных самособирающихся покрытий-шаблонов для полупроводниковых структур при создании современных микросхем. А объемные наноконструкции могут служить в качестве уникальных биосовместимых контейнеров для упаковки фармакологических препаратов и их адресной доставки к органам-мишеням.

Еще одним примером новых материалов служат конъюгаты олигонуклеотидов с квантовыми точками – полупроводниковыми наночастицами, способными к флуоресценции в видимом диапазоне света. Наборы олигонуклеотидных зондов, меченных с помощью такой технологии, упрощают решение ряда биологических задач (например, параллельного отслеживания нескольких процессов в живой клетке), а также используются в области медицинской ДНК-диагностики и компьютерной томографии.
На основе нуклеиновых кислот можно создавать и так называемые клеточные молекулярные машины, или бионанодвигатели, – наноустройста, способные автономно совершать движения, трансформируя энергию химических реакций в механическую работу. Важной характеристикой молекулярных наномашин является их автономность или самоуправление. Наномоторы имеют множество потенциальных применений, таких как обработка информации и регуляция химических реакций, а также молекулярная сборка в различных наноэлектронных приборах и биосенсорах.
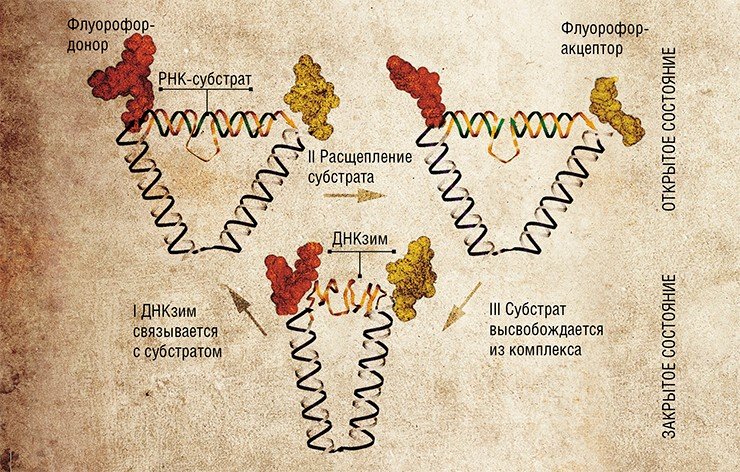
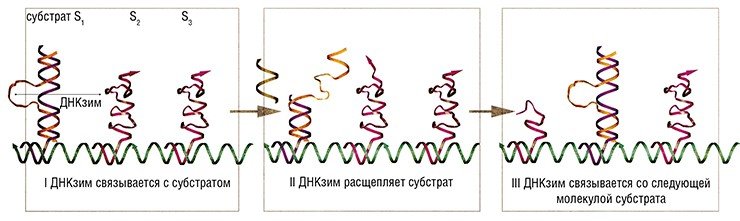
В 2004 г. созданы ДНК-наномоторы, действующим началом которых является ДНКзим «10-23» – своеобразный фермент на основе ДНК. Эти «двигатели» способны производить механические движения до тех пор, пока доступно «топливо» – РНК-субстрат. Хотя эти наноустройства вполне автономны, есть возможность регулировать их работу «извне», например, добавляя или убирая субстрат-топливо (по аналогии с автомобильным «поддаванием» или «сбрасыванием» газа). Более того, наномотор можно остановить и потом запустить вновь – для этих целей служат специально сконструированные олигонуклеотидные цепочки «тормоз» и «удаление».
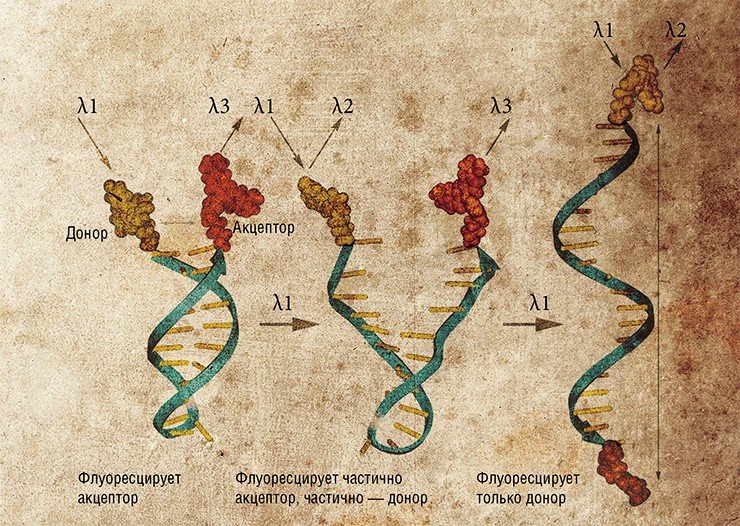
В 2005 г. сконструирован более сложный нанодвигатель, управляемый ДНКзимом «10-23», способный автономно перемещаться по определенной траектории, заданной олигонуклеотидной цепочкой. Подобные системы в будущем могут использоваться для транспортировки молекул-«грузов».
Молекулы нуклеиновых кислот служат потенциальной основой для создания еще ряда устройств и соединений. В так называемых нанопереключателях используется способность двуцепочечной спирали нуклеиновых кислот менять свою конформацию под воздействием внешних факторов, например, при связывании со специфическими веществами-лигандами. Если такой чувствительный участок соединяет два элемента наноконструкции, то при добавлении лиганда конструкция перестраивается. Таким способом можно, например, менять уровень флуоресценции нанообъекта.
Рассматривая различные наноустройства, нельзя не упомянуть об аптамерах – уникальных молекулах, сконструированных на основе нуклеиновых кислот. Аптамер представляет собой трехмерную структуру-«ключ», специфично подходящую к «замку» – определенной молекуле-мишени. В результате их взаимодействия образуются прочные стабильные надмолекулярные комплексы. Благодаря этому можно обнаружить молекулы веществ даже в сверхмалых концентрациях. Аптамеры являются важными деталями бионаноконструктора, которые используются при разработке различных супрамолекулярных устройств, в том числе биосенсоров.
Диагностируем мутации
В то время как одни достижения бионанотехнологии пока следует рассматривать лишь как некие прототипы устройств отдаленного будущего (так, сегодня вряд ли можно найти достойную работу наномотору), другие незамедлительным образом внедряются в важнейшие прикладные области, в частности, в медицинскую диагностику. В их числе – диагностические сенсоры на основе нуклеиновых кислот, часть которых разрабатывалась в последние полтора десятилетия в ИХБФМ СО РАН (Новосибирск). Назначение подобных конструкций – распознавать с высокой точностью целевые последовательности ДНК благодаря специфическому связыванию нанозондов с ДНК-мишенями.
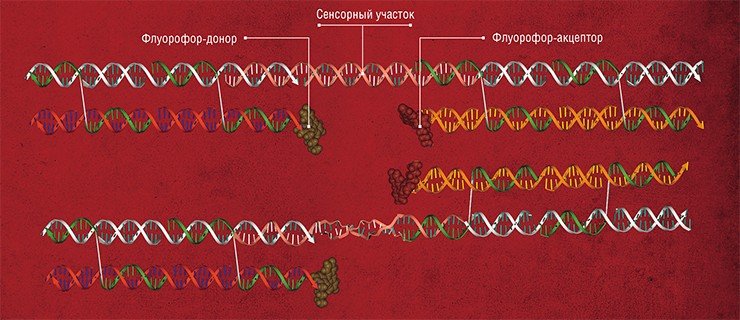
Диагностические системы, предлагаемые новосибирскими биохимиками, представляют собой своего рода кассеты из наборов коротких синтетических фрагментов ДНК. Последние способны связываться с исследуемой ДНК, формируя так называемые тандемные комплексы.

В результате фундаментальных исследований этих комплексов удалось создать на их основе тест-системы для выявления точечных мутаций в ДНК. А ведь подобные мутации нередко являются причиной серьезных наследственных заболеваний, а также определяют патогенность различных штаммов микроорганизмов и вирусов.
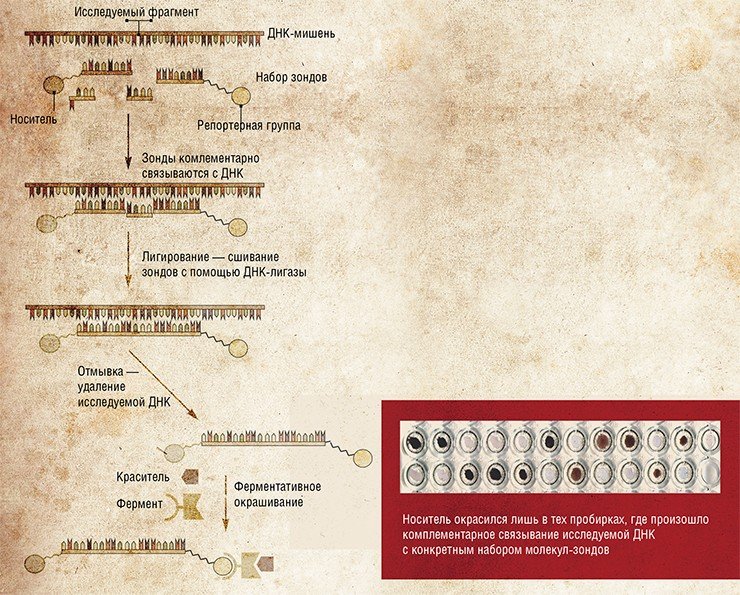
Кроме того, с помощью этих тест-систем можно выявить и другие локальные нарушения в ДНК-последовательностях, такие как потеря сегмента ДНК, олигонуклеотидные замены и т. п.
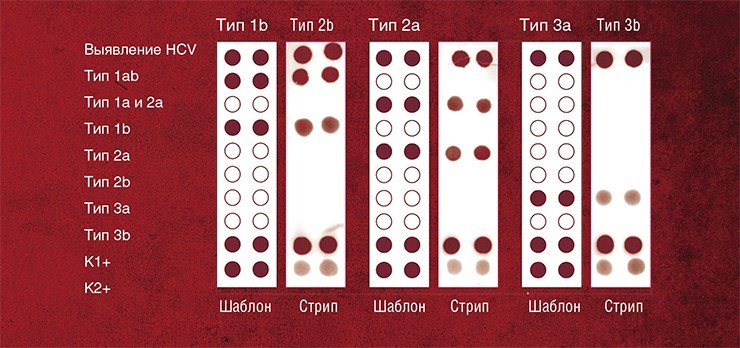
Еще одно перспективное направление использования материалов из арсенала бионанотехнологии в медицинской диагностики — создание новых типов нанозондов для современных методов количественного анализа ДНК, таких как метод «ПЦР в реальном времени» (Real-time PCR). Этот метод используется для детекции и одновременного определения количества молекул ДНК-мишени в образце.
Транспорт для лекарства
Важнейшая проблема в клинической практике – адресная доставка в клетки-мишени биологически активных макромолекул, таких как «терапевтические гены» . Чтобы решить ее, необходимо обеспечить защиту этих препаратов во время транспорта и концентрирование их в определенных клетках.
Одно из основных препятствий для использования препаратов на оcнове нуклеиновых кислот – низкая эффективность их проникновения внутрь клеток, трансфекции. Проблема трансфекции обусловлена тем, что млекопитающие обладают рядом механизмов, препятствующих проникновению в них чужеродных молекул ДНК и РНК – генетического материала потенциально болезнетворных агентов (вирусов, бактерий и т. п.)
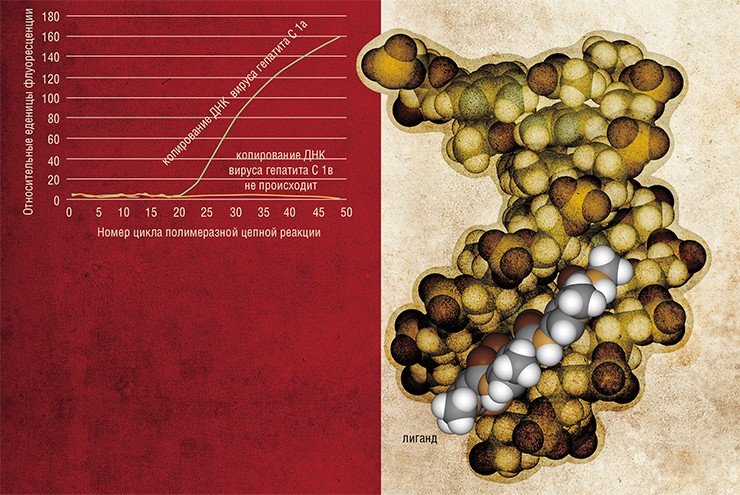
Вдобавок самим клеткам трудно захватывать нуклеиновые кислоты, находящиеся в свободном («раздетом», как говорят специалисты) состоянии, из-за наличия своеобразного электростатического барьера. Дело в том, что клеточная мембрана и сахарофосфатный остов молекул нуклеиновых кислот обладают одноименным – отрицательным – зарядом, вследствие чего между ними возникает электростатическое отталкивание.
Транспорт в клетку протяженных нуклеиновых кислот осложняется еще и их относительно большим размером, жесткой пространственной структурой и невысокой подвижностью в биологических жидкостях и цитоплазме клеток.
Методы трансфекции постоянно совершенствуются на протяжении уже более трех десятилетий. Наиболее современные из них основаны на использовании хитроумных конструкций на основе нанокомплексов нуклеиновых кислот и их конъюгатов с органическими лигандами или наночастицами.
Зримые различияСуть обычной полимеразной цепной реакции (ПЦР) состоит в том, что на основе нуклеотидной последовательности первичной ДНК-матрицы с помощью фермента ДНК-полимеразы синтезируются цепи ДНК, служащие матрицами в следующем цикле копирования. В результате можно получить неограниченное число копий первичной ДНК. Метод «ПЦР в реальном времени» отличается тем, что позволяет определять количество ДНК по мере ее накопления в реакции.
Наиболее перспективным является подход, основанный на использовании TaqMan-зондов.
Они представляют собой олигонуклеотиды с флуоресцентной меткой на одном конце и «тушителем» флуоресценции – на другом, который поглощает излучение от флуоресцентной метки, делая его незаметным для систем детекции.
ДНК-полимераза обладает способностью разрушать фрагменты двухцепочечной структуры, встречающиеся ей по ходу синтеза второй цепи на матрице одноцепочечной ДНК. Та же участь постигает и TaqMan-зонды, которые комплементарно присоединяются к определенному участку ДНК-мишени. В результате разрушения зонда флуоресцентная метка отделяется от тушителя, что приводит к появлению регистрируемой флуоресценции.
Недостатком метода является его низкая чувствительность для распознавания ДНК-мишеней, отличающихся друг от друга всего одной заменой нуклеотида. Для решения этой проблемы в лаборатории медицинской химии ИХБФМ СО РАН предложено использовать в качестве зондов конъюгаты коротких олигодезоксирибонуклеотидов с малобороздочными лигандами — синтетическими молекулами, прочно связывающимися с двойной спиралью ДНК
Некоторые встречающиеся в природе молекулы РНК обладают свойством формировать компактные молекулярные комплексы. Среди них φ29 – короткая (117 нуклеотидов) РНК бактериофага, участвующая в упаковке его ДНК-генома в белковую оболочку. На основе этой РНК сконструированы наночастицы так называемой «упаковочной» pRNA («packing RNA»). Благодаря образованию водородных связей между отдельными доменами она может путем самосборки образовывать димеры, тримеры и гексамеры размерами до 10—30 нм (Shu, Huang et al., 2003; Khaled, Guo, Li et al., 2005).
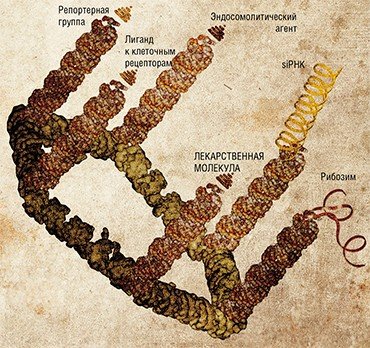 Такие комплексы pRNA служат в качестве упаковывающего каркаса для «терапевтических» молекул нуклеиновых кислот. Их удается еще дополнительно «функционализировать», как говорят биологи, – путем присоединения различных функциональных группировок задать адрес доставки и клеточное назначение. Это могут быть так называемые репортерные группы, позволяющие контролировать эффективность трансфекции; генонаправленные молекулы (рибозимы, малые siРНК), нарушающие выполнение определенных генетических клеточных программ; лиганды клеточных рецепторов и мембранных белков, определяющие адресованный захват наноконструкции клетками-мишенями.
Такие комплексы pRNA служат в качестве упаковывающего каркаса для «терапевтических» молекул нуклеиновых кислот. Их удается еще дополнительно «функционализировать», как говорят биологи, – путем присоединения различных функциональных группировок задать адрес доставки и клеточное назначение. Это могут быть так называемые репортерные группы, позволяющие контролировать эффективность трансфекции; генонаправленные молекулы (рибозимы, малые siРНК), нарушающие выполнение определенных генетических клеточных программ; лиганды клеточных рецепторов и мембранных белков, определяющие адресованный захват наноконструкции клетками-мишенями.
Примером такой адресующей группировки может служить всем известный фолат (фолиевая кислота, витамин В9). Рецепторы к нему обычно отсутствуют на поверхности нормальных дифференцированных тканевых клеток, но во множестве присутствуют на поверхности клеток различных опухолей. В результате остаток фолата, присоединенный к наноконструкции, должен обеспечить ее доставку преимущественно в раковые клетки.
Эксперименты по доставке подобных pRNA-комплексов, несущих биологически активный олигонуклеотид (рибозим или интерферирующую siРНК), показали, что они эффективно проникают в опухолевые клетки, имеющие фолатные рецепторы, где и подавляют работу генов-мишеней.
Поскольку pRNA-молекула способна образовывать гексамерные комплексы, то можно увеличить ее функ-циональность путем присоединения к ней до шести различных субъединиц. В результате селективность и эффективность терапевтической наноконструкции могут значительно возрасти.
Самосборка наночастиц на основе pRNA является контролируемым процессом, что дает возможность определять их размер путем манипуляции со структурными доменами. Димеры и тримеры pRNA образуют частицы размером 20—40 нм. Подобные структуры достаточно крупны, чтобы исключить их быстрое выведение из циркулирующей крови, но при этом не достигают критического (более 100 нм) размера, когда проникновение комплексов в клетки затрудняется.
Холестериновый посыльный
Другой подход к решению проблемы доставки терапевтических нуклеотидных последовательностей в клетку состоит в повышении эффективности их естественного транспорта через клеточную мембрану. Этот подход основан на формировании различных супрамолекулярных структур.
В частности, протяженные олигонуклеотидные нанокомплексы, созданные в ИХБФМ СОРАН, активнее проникают в клетки разного тканевого происхождения из-за своего повышенного сродства к фосфолипидным мембранам клеток.
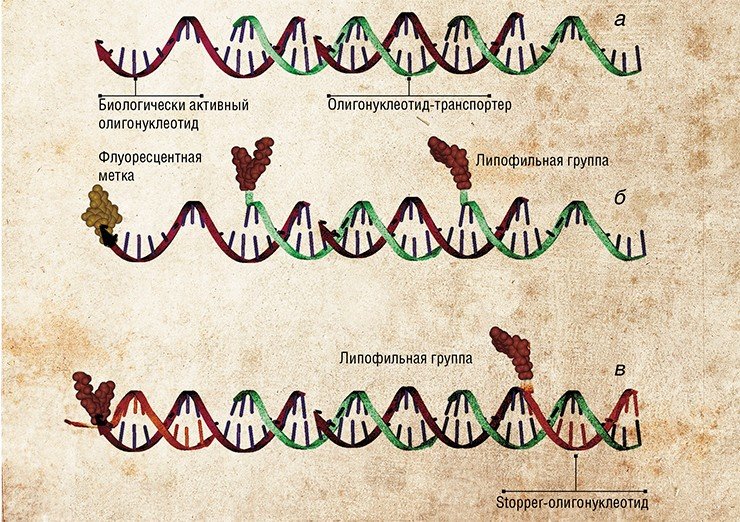
Эти наноконструкции представляют собой конкатамерные комплексы, т. е. длинные двуцепочечные молекулы ДНК с перекрывающимися комплементарными нуклеотидными последовательностями. Одна из цепей представляет собой биологически активную молекулу, которую надо доставить в клетку (адресная молекула); другая цепь – молекулу-транспортер (Gusachenko et al., 2008).
В качестве функциональной группировки в состав олигонуклеотидов-транспортеров вводят липофильный остаток холестерина, который способствует транспорту конструкции в клетку благодаря сродству с фосфолипидной клеточной мембраной. Нужно отметить, что функциональные группировки при этом присоединяют к транспортеру, а не к терапевтической молекуле, что позволяет сохранить высокую биологическую активность последней.
Эта система доставки была испытана в экспериментах по транспорту так называемого антисмыслового олигонуклеотида, который вызывает выключение гена, кодирующего зеленый флуоресцирующий белок.
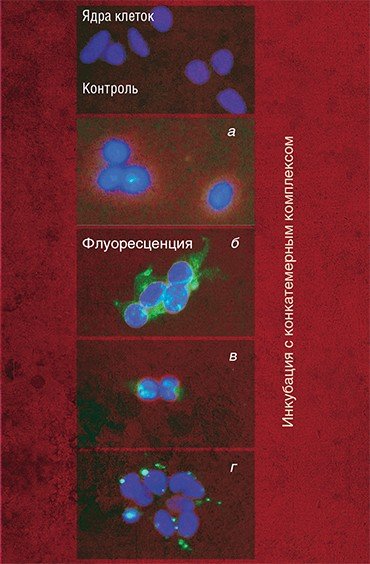 В клетках, постоянно синтезирующих этот белок и обладающих благодаря этому зеленой флуоресценцией, такой нанокомплекс вызывал снижение флуоресценции до 30 %. Это свидетельствует о том, что антисмысловой олигонуклеотид проник в клетки и специфически подавил работу гена, кодирующего флуоресцирующий белок.
В клетках, постоянно синтезирующих этот белок и обладающих благодаря этому зеленой флуоресценцией, такой нанокомплекс вызывал снижение флуоресценции до 30 %. Это свидетельствует о том, что антисмысловой олигонуклеотид проник в клетки и специфически подавил работу гена, кодирующего флуоресцирующий белок.
Сегодня большинство разработок в области бионанотехнологии реализуется в рамках междисциплинарных проектов. Для того, чтобы добиться успеха, принципиально необходимо тесное сотрудничество исследовательских организациий различного профиля.
В связи с этим нельзя не отметить совместные разработки новосибирских биохимиков и специалистов из Института физики полупроводников СО РАН, в распоряжении которых имеются уникальные микро- и нанопористые мембраны на основе кремния. Эти материалы являются перспективными платформами как для разработки современных биосенсорных устройств и проведения ДНК-диагностических исследований, так и для ультраселективного выделения клеток-мишеней.
Другим междисциплинарным проектом является разработка микро- и нанофлюидных устройств для амплификации (умножения) и анализа нуклеиновых кислот, которая проводится совместно со специалистами Института катализа СО РАН.
Кроме того, ряд институтов Сибирского отделения, работающих в областях химии, физики и даже петрографии, готовы предоставить ценные для развития бионанотехнологии объекты: нанопорошки (наносферы, нанотрубки, квантовые точки) и наноканальные материалы.
Возможность такого сотрудничества в области материалов и технологий в рамках интеграционных проектов Сибирского отделения РАН открывает перспективу создания у нас высокотехнологичных интеллектуальных биосенсоров и «умных» лекарственных препаратов, которые будут определять лицо медицины и биотехнологии завтрашнего дня.
Литература:
Aldaye F. A., Palmer A. L., Sleiman H. F. Assembling Materials with DNA as the Guide // Science. 2008. V. 321. P. 1795—1799.
Chen Y., Wang M., Mao C. An autonomous DNA nanomotor powered by a DNA enzyme // Angew. Chem. Int .Ed. Engl. 2004. V. 43. P. 3554—3557.
Gusachenko (Simonova) O. N., Pyshnyi D. V., Vlassov V. V., Zenkova M. A. Modified concatemeric oligonucleotide complexes: new system for efficient oligonucleotide transfer into mammalian cells // Hum. Gene. Ther. 2008. V. 19. P. 532—546.
Khaled A., Guo S., Li F., Guo P. Controllable self-assembly of nanoparticles for specific delivery of multiple therapeutic molecules to cancer cells using RNA nanotechnology // Nano Lett. 2005. V. 5. P. 1797—1808.
Shu D., Huang L. P., Hoeprich S., Guo P. Construction of phi29 DNA-packaging RNA monomers, dimers, and trimers with variable sizes and shapes as potential parts for nanodevices // J. Nanosci. Nanotechnol. 2003. V. 3. P. 295—302.
Simmel F. C., Dittmer W. U. DNA Nanodevices // Small. 2005. V. 1. N. 3. P. 284—299.
Tian Y., He Y., Chen Y. et al. DNAzyme that walks processively and autonomously along a one-dimensional track // Angew. Chem. Int. Ed. Engl. 2005. V.44. P. 4355—4358.