Паразитоз от А до Т
Возможно, что стартующий сегодня в Институте цитологии и генетики СО РАН крупномасштабный научный проект полной геномно- протеомной расшифровки Opisthorchis felineus призван осуществить не только свою программу-минимум – понять природу паразитоза, вызываемого этим возбудителем, и поставить его под надежный контроль, но и заполнить тот почти полный вакуум, который наблюдается сегодня в геномных исследованиях в России...
Исторически исследования в области экспериментальной биологии следовали одной логике развития. Сначала шел этап накопления экспериментальных данных о некоторой биологической системе, часто «мозаичных» и порой противоречивых, что определялось рядом факторов (различиями в экспериментальных подходах, методах обработки результатов и другими, менее очевидными, но не менее весомыми факторами). Накопленный материал позволял осмыслить биологический феномен, устранить видимую противоречивость данных из разных источников и построить теоретическую модель. На основе такой модели планировались новые направления исследований, позволяющие прояснить не до конца понятные стороны явления и определялись факторы, с помощью которых можно регулировать и управлять системой. Затем вновь шло накопление фактов, и цикл познания воспроизводился на новом уровне.
Современное состояние российских геномных исследований обрекает отечественную биологию, медицину и биотехнологию на положение заведомых мировых аутсайдеровНа рубеже веков для фундаментальных и прикладных биологических исследований наступила новая эра. Уровень развития биотехнологий и биоинформатики (математического и компьютерного обеспечения исследований) позволил перейти от «мозаичного» принципа получения информации в ходе разрозненных экспериментов к принципу системному, который нашел свое воплощение в геномных проектах. Ведь вся информация о биологическом виде записана в четырех буквенном коде в геномной ДНК, и расшифровка такого генетического текста дает наиболее полную и, что особенно важно, системную информацию о живом организме и механизмах, определяющих его строение, развитие и функционирование.
Геномный аутсайдер
Конец прошлого и начало нового века породили плеяду геномных проектов, направленных на расшифровку геномов разной сложности – от вирусных и бактериальных до эукариотических. Эти проекты выполняются в интересах самых разных областей человеческой деятельности – медицины, сельского хозяйства, биотехнологии, фундаментальной науки. Предполагается, что с дальнейшим уменьшением стоимости секвенирования геномов станет, например, возможным расшифровывать геномы отдельных исчезающих видов в целях сохранения биологического разнообразия.
Разброс масштабов геномных проектов поразителен: от секвенирования бактериального генома, состоящего из одной хромосомы, до глобальной инициативы Департамента энергетики США под названием Microbial Genome Project, в рамках которой уже расшифровано 485 геномов микробов и исследована геномика 30 микробиологических сообществ. По замыслу организаторов этого проекта детальная геномная информация о сообществах микроорганизмов (а именно они составляют большую часть планетарной биомассы) может лечь в основу работ по очистке водоемов и территорий, предотвращению распространения болезнетворных микроорганизмов и других действий, направленных на поддержание устойчивого развития планетарной экосистемы.
Исторически первым геномным подходом было разбиение генома на перекрывающиеся сегменты (картирование), определение последовательностей этих частей и «сборка» целого генома. Позже Вентер и Смит (лауреаты Нобелевской премии за открытие рестрикционных ферментов) разработали метод полногеномного секвенирования «по методу дробовика» (shotgun sequencuing). С помощью ультразвука геномная ДНК фрагментируется, последовательности фрагментов определяются, а затем полная структура генома восстанавливается из этих фрагментов специальными компьютерными программами.
В структуре геномных проектов выделяют следующие фазы:
1. Подготовка геномной ДНК, ее фрагментация и собственно секвенирование (с помощью автоматических секвенаторов, определяющих последовательность участков ДНК длиной в 900 букв – нуклеотидов)
2. «Сборка» структуры генома – восстановление последовательностей ДНК в каждой хромосоме данного вида из последовательностей фрагментов. Это непростая задача, еще более усложняющаяся наличием в геноме множества идентичных последовательностей, так называемых повторов. Для ее решения разрабатываются специальные пакеты компьютерных программ.
3. Аннотация генома – работа, в ходе которой за каждой последовательностью закрепляется биологическая информация. Эта фаза состоит из двух этапов: идентификации элементов генома (поиск генов или Gene Finding) и «закрепления» за каждой последовательностью биологической информации (структура гена, регуляторные и кодирующие участки, биологическая и биохимическая функции белка – продукта гена, регуляция экспрессии гена и взаимодействие с другими генами). Аннотация генома проводится как с помощью компьютерных программ, так и вручную с использованием опыта экспертов по расшифровке генома.
Часто после расшифровки основной части информации, содержащейся в геноме, остаются еще трудно секвенируемые участки (чаще всего связанные с повторами ДНК): результаты геномного проекта на этой стадии называются working draft – «рабочая версия». Поскольку процесс секвенирования иногда происходит с ошибками, нередко требуется ресеквенирование частей генома.
Многие геномные проекты не ограничиваются «прочтением» всей хромосомной ДНК, но включают в себя транскриптомную и протеомную составляющие, т. е. изучают структуру РНК-транскриптов и соответствующих им белков-продуктов, что позволяет вывести проект на новый функциональный уровень.
Выбор биологического вида для осуществления геномного проекта определяется рядом факторов: в числе первых инициированы проекты геномов человека и модельных организмов, на которых проводятся генетические эксперименты (проект генома плодовой мушки Drosophila melanogaster, нематоды Caenorhabditis elegans, хлебной плесени Neurospora crassa, бактерии Escherichia coli и др.). Ряд проектов направлен на установление структуры генома опасных для здоровья человека патогенов – вирусов, бактерий и грибков. Вообще, вирусные геномы были первыми законченными геномными проектами просто в силу их малого объема. Ряд вирусных геномов (в частности, вирусов энцефаломиелита лошадей, Эбола, Марбург, крымской геморрагической лихорадки и др.) секвенировался в военных целях, а недавно в интересах медицины в кратчайшие сроки был выполнен проект генома вируса атипичной пневмонии SARS. Геномы археобактерий расшифровываются в связи с их способностью населять самые экстремальные экологические ниши – дно океана, метановые месторождения, кипящие природные источники, и т. д. Интерес таких проектов сфокусирован на генах, определяющих эту способность.
Есть геномные проекты важных сельскохозяйственных культур – риса (Oryza sativa), пшеницы (Triticum aestivum), кукурузы (Zea mays). Интересен проект, выполняющийся в рамках Международной программы генома винограда, направленный на улучшение качества и определение генетических детерминант вкуса вина. Наконец, некоторые геномы расшифровываются потому, что информация, полученная в результате их секвенирования, может прояснить серьезные вопросы биологической эволюции. Напри-мер, проект генома шимпанзе пролил свет на эволюцию человека: были определены несколько генов, участвующих в формировании речи человека, и по их отличию от генов шимпанзе, установлено, что они эволюционировали в результате отбора, связанного с речевым поведением человека
Наша страна, к глубокому сожалению, значительно отстает от мировой тенденции. В 2007 г. в НИИ физико-химической медицины РАН закончена полная расшифровка первого «российского» бактериального генома Acholeplasma laidlawii, его компьютерная аннотация и протеомное профилирование; также близится к завершению расшифровка генома психрофильной (холодолюбивой) бактерии в Центре биоинженерии РАН.
Что касается геномов высших эукариотических организмов, то в нашей стране исследования по их полной расшифровке находятся на зачаточном уровне. Участие ряда российских организаций в геномных исследованиях, проводимых за рубежом, не решает проблемы. Сложившаяся ситуация, если она не будет преодолена в ближайшем будущем, обрекает российскую биологию, биомедицину и биотехнологию на отставание не только от мировых лидеров, но даже от заведомых аутсайдеров мировой биологической науки.
Расшифровка генетического текста геномной ДНК дает полную и системную информацию о живом организме и механизмах, определяющих его строение и жизнедеятельностьВозможно, что стартующий сегодня в Институте цитологии и генетики СО РАН крупномасштабный научный проект полной геномно-протеомной расшифровки Opisthorchis felineus призван осуществить не только свою программу-минимум – понять природу паразитоза, вызываемого этим возбудителем, и поставить его под надежный контроль, – но и заполнить тот почти полный вакуум, который наблюдается сегодня в геномных исследованиях в России.
В фокусе – паразит
Даже спектр задач программы-минимум нового проекта отличается своей широтой и возможностями практического применения результатов. Ведь описторхоз представляет собой опаснейшее заболевание, причем почти целиком приходящееся на долю России и стран СНГ. А Западная Сибирь, где находится Новосибирская область, является мощным природным очагом паразитоза с высокой инфицированностью населения, а также многих видов домашних и диких животных.

Проблема санитарно-эпидемиологического мониторинга этого очага, как и постановки диагноза заболевания у зараженных людей, усложняется отсутствием простых и надежных диагностических тест-систем. Наличие в очаге еще нескольких видов трематод (доказано, что как минимум один из них, Methorchis bilis, может паразитировать у человека) еще более усложняет эпидемиологическую и клиническую картину паразитоза и требует разработки не просто высокочувствительных тест-систем, но способных точно диагностировать вид печеночных паразитов.
Результаты проекта по секвенированию генома описторха позволят разработать высокочувствительную специфическую диагностику болезни на основе ДНК-чиповых технологийСегодняшние препараты лечения описторхоза достаточно токсичны, а неполнота современных биологических данных о строении описторха, структуре и функциях его генов и генетическом контроле жизненного цикла задерживает разработку новых противогельминтных средств и вакцин. Достаточно показателен хотя бы тот факт, что до начала пилотной фазы проекта морфология этого организма была описана только на уровне световой микроскопии, т. е. методами, разработанными до середины прошлого века.

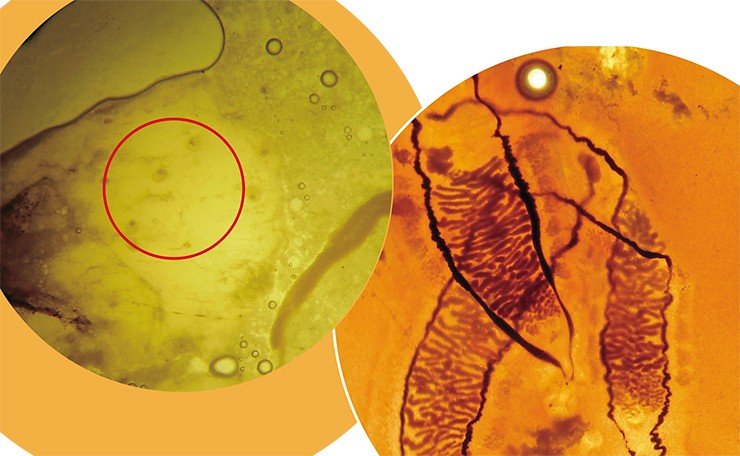
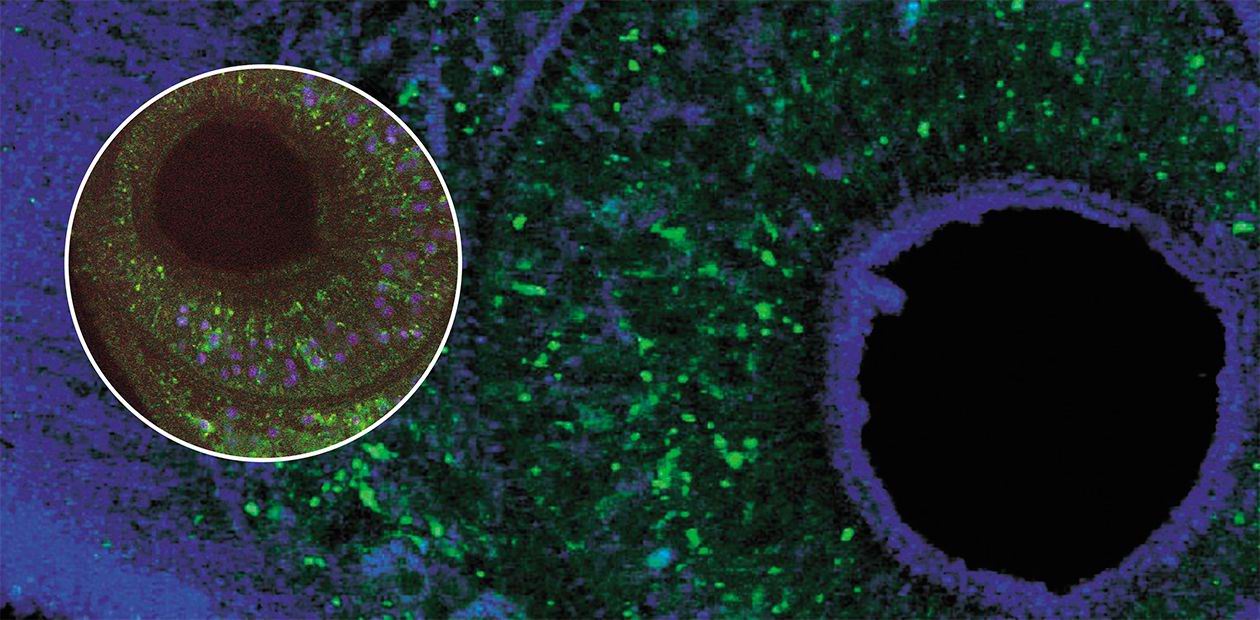
Помимо этих практических проблем, Opisthorchis felineus представляет собой исключительный интерес и для разных отраслей фундаментальной науки. Так, для экологов до сих пор остается неясным, почему в напряженнейшем очаге паразитоза остается совершенно не инфицированным такой крупный пресноводный водоем, как оз. Малые Чаны в НСО. Генетиков интригует тот феномен, что паразит способен размножаться не только на взрослой, но и на личиночной стадии! Подобное явление редко встречается в природе (оно описано, помимо трематод, для нескольких видов жуков, морских ракообразных и др.). В результате на одной из начальных фаз своего жизненного цикла из одной личинки описторха возникает сотня генетически идентичных копий – настоящее масштабное клонирование. Но молекулярно-генеические механизмы, лежащие в основе этого процесса, пока остаются загадкой.
Проблемный описторхоз
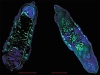
Итак, в фокусе проекта – печёночный сосальщик (кошачья / сибирская двуустка) Opisthorchis felineus, являющийся низшим многоклеточным животным. Как возбудитель описторхоза человека O. felineus был открыт известным патоморфологом К. Н. Виноградовым более 100 лет назад, однако и сегодня проблема описторхоза не решена ни с эпидемиологической, ни с медицинской точек зрения. В Западной Сибири описторхоз остается распространенным заболеванием с упорным, рецидивирующим течением. Характер этой болезни позволил клиницистам отнести ее к системным заболеваниям человеческого организма, требующим системного лечения, а значит – и систематических, исчерпывающих знаний о биологии описторха и его особенностях, обеспечивающих устойчивость в системе «паразит—хозяин».

Вредные последствия инвазий описторха и других паразитарных гельминтов, также имеющих большое медико-социальное значение (например, дифиллоботриоз), не следует недооценивать. Все они способны значительно снижать сопротивляемость организма, истощать иммунную систему, осложнять задачи точной диагностики и эффективного лечения других патологий, что приводит к значительной потере трудоспособности населения.
Медики Западной Сибири давно озабочены проблемами региональных гельминтозов. В Новосибирске в Институте клинической и экспериментальной медицины СО РАМН под руководством профессора А. И. Пальцева и в 1-й инфекционной клинике под руководством профессора Н. П. Толоконской проводятся работы по мониторингу и детализации эпидемиологии описторхоза, исследуются особенности развития патологии и разрабатываются наиболее эффективные стратегии лечения. Аналогичные работы проводятся в тюменском Научно-исследовательском институте краевой инфекционной патологии. Однако и сегодня узким местом всех медицинских исследований является отсутствие надежной диагностики возбудителя описторхоза и невозможность надежно отличить его от других, более редких гельминтов, вызывающих сходную симптоматику. А без такой диагностики неэффективны ни схемы лечения, ни профилактические мероприятия.

Первый шаг в нужном направлении уже сделан: в ЗАО «Вектор-Бест» под руководством Т. Н. Ткаченко разработана пробная тест-система диагностики описторхной инвазии, основанная на выявлении антител пациента к антигенам описторхов на разных стадиях инвазии. К сожалению, этот метод оказался не строго специфичным к O. felineus. Поэтому сейчас в «Вектор-Бест» под руководством В. Б. Локтева разрабатывается другая тест-система для иммуноферментной диагностики специфических антител к белку описторха, парамиозину. Ученым сначала пришлось проклонировать ДНК-копию транскрипта гена парамиозина описторха, затем наработать чистый белок и получить против него специфические антитела. Такой комбинированный генно-инженерный и иммунологический подход перспективен для создания специфической диагностики описторхоза.
Однако помимо совершенствования методов диагностики важнейшей задачей в борьбе с гельминтозами является разработка эффективных и безопасных лекарственных препаратов. В настоящее время в основу разработки таких препаратов в развитых странах закладываются самые современные подходы, основанные на методах геномики, протеомики, метаболомики, биоинформатики, генетической инженерии, комбинаторной молекулярной биологии. Реализовать подобный высокотехнологичный подход в рамках геномного проекта «Описторхоз» призван создаваемый сегодня в Новосибирском научном центре Сибирский центр геномных, протеомных и биоинформационных технологий, оснащенный современным высокопроизводительным оборудованием для секвенирования геномов бактерий и эукариот; изучения протеом (т. е. всех белков) микроорганизмов, растений, животных и человека, а также для высокопроизводительных вычислений в области биоинформатики.
Первый российский эукариотический
Создание нового центра ведется в рамках программы Сибирского отделения РАН «Геномика, протеомика, биоинформатика», возглавляемой академиком РАН Р. З. Сагдеевым, на базе ряда институтов СО РАН: Института цитологии и генетики, Института химической биологии и фундаментальной медицины, Международного томографического центра, Института биофизики и Лимнологического института. Эта программа впервые в России открывает возможность осуществления полного цикла исследований бактериальных и эукариотических геномов: от их секвенирования до компьютерной аннотации и предсказания пространственных структур белков и реконструкции генных сетей.
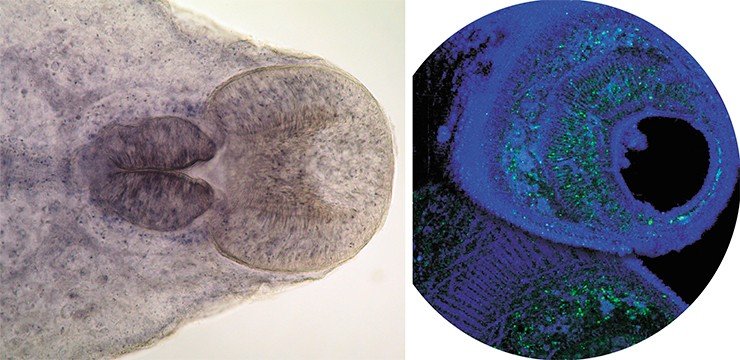
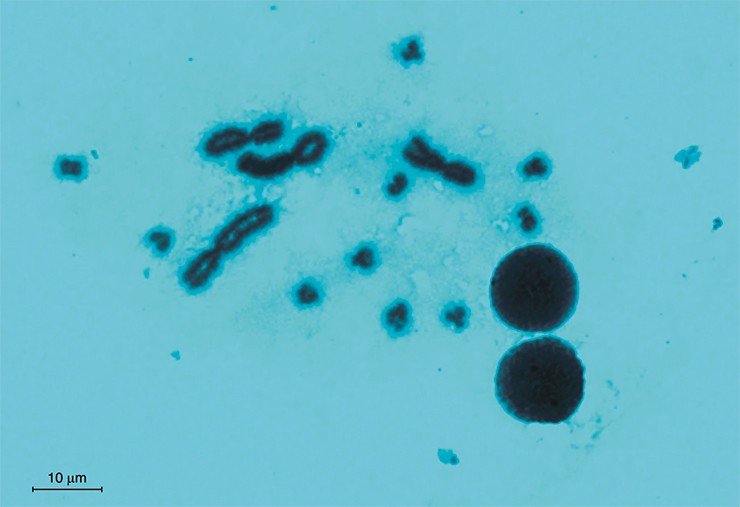
Геном O. felineus хорошо подходит в качестве объекта для полногеномных исследований. Он имеет компактный размер – около 300 млн пар оснований, которые, как показывают исследования, проведенные в ИЦиГ СО РАН, распределены по семи хромосомам. Следует отметить, что реализация первого российского эукариотического геномного проекта – расшифровка генома возбудителя описторхоза O. felineus – стала реальной именно в Новосибирском научном центре потому, что здесь имеется уникальная возможность координации усилий фундаментальной науки и практической медицины на базе самых современных экспериментальных и биоинформационных возможностей.
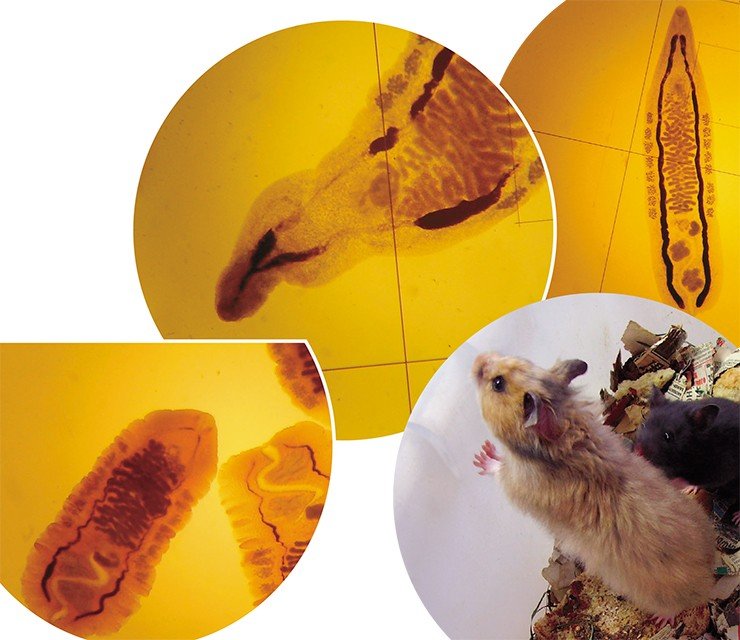
В фокусе проекта – разработка лекарственных препаратов на основе геномных и протеомных исследований. В результате секвенирования генома возбудителя будут определены молекулярные мишени для терапии – гены и белки, ответственные за развитие болезней или участвующие в контроле жизненного цикла и размножения паразита. На основе этих данных будут смоделированы и синтезированы ингибиторы, блокирующие функцию генов-мишеней. В перспективе широкое применение должны найти генетические модели заболеваний – экспериментальные животные, полученные методами генной, хромосомной инженерии и селекции.
Создавая будущее
На первом этапе проекта было впервые изучено генетическое разнообразие O. felineus и близких к нему видов печеночных трематод в природных популяциях на обширной территории: в Новосибирской, Томской, Омской областях и в Ханты-Мансийском автономном округе. Результаты этих исследований заложили основу для развития методов ДНК-диагностики возбудителей описторхоза, выявления и оценки напряженности природных очагов этого заболевания.
На втором этапе предполагается полностью описать морфологию, структуру хромосом и расшифровать геном O. felineus. Для решения этой задачи центр укомплектовывается самым современным оборудованием для секвенирования, физико-химического анализа, микроскопии.
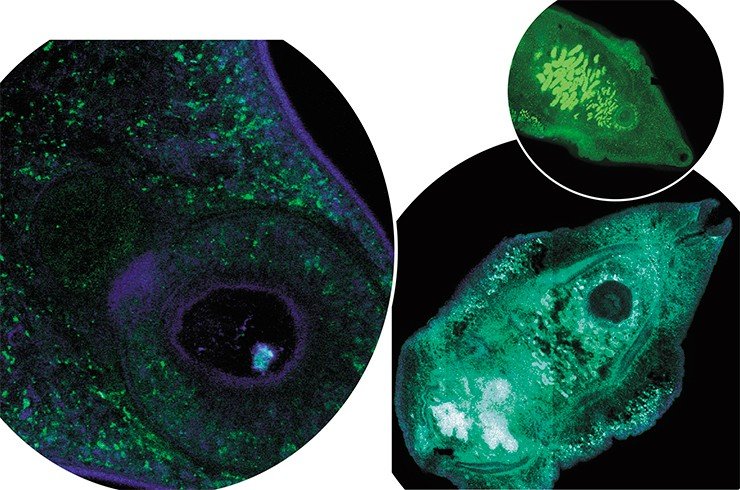
Однако получение такой информации – это далеко не все. Парадоксальность ситуации, складывающейся сейчас в геномике, состоит в том, что объем информации, которым располагают исследователи, намного больше того, что можно осмыслить, проанализировать и использовать в экспериментальной работе. Поэтому чрезвычайно актуальным становится развитие новых математических методов, вычислительной техники, программного обеспечения, совершенствование способов описания и хранения геномной информации. Этими проблемами активно занимается биоинформатика, включающая в себя и геноинформатику.
Биоинформационный подход давно и продуктивно развивается в ИЦиГ СО РАН, причем в этой сфере сибирские ученые занимают лидирующие позиции как в России, так и в мире. Биоинформатика позволяет проанализировать ситуацию на четырех тесно связанных друг с другом уровнях. Первый – генетический текст, т. е. нуклеотидная последовательность ДНК; второй – тоже текст, но сначала в форме РНК, а затем в форме аминокислотной последовательности белка; третий уровень – пространственная структура белка. И, наконец, последний уровень – предсказание функции белка на основе знания его первичной и предсказанной трехмерной структур. Таким образом, структурная и сравнительная геномика посредством биоинформатики перерастают в новую геномную дисциплину, которую называют функциональной геномикой.
Функциональная геномика тесно соприкасается и фактически перекрывается с новым направлением биологии, получившим название «протеомика», основным предметом изучения которого являются белки и их взаимодействия в живых организмах, в том числе в человеческом. В ИЦиГ СО РАН уже приняты на вооружение самые современные методы экспериментальной протеомики: двумерный гель-электрофорез белков, высокоэффективная жидкостная хроматография с последующим анализом индивидуализированных фракций белков с помощью времяпролетных масс-спектрометров и др.
Все эти методы будут использованы для анализа и реконструкции протеомного портрета зрелой паразитирующей формы O. felineus. В первую очередь будут охарактеризованы белки, пептиды и метаболиты, выделяемые паразитом при взаимодействии с организмом хозяина. Результаты этой работы позволят выявить фармакологические мишени, при воздействии на которые происходит отторжение паразитов, восстановление тканей и функций пораженного органа, что даст возможность приступить к созданию высокоспецифичных и эффективных лекарственных антипаразитарных препаратов.
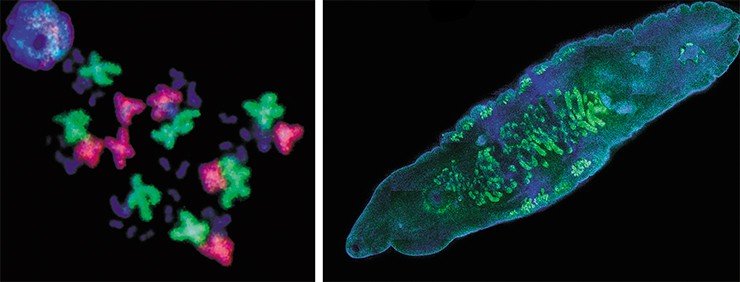
Реализация подобных проектов в современной биологии и биотехнологии сулит революционные изменения в области фармакологии. Расшифровка геномов болезнетворных организмов приведет к идентификации целых спектров новых мишеней для терапии, а это, в свою очередь, – к появлению новых препаратов, более избирательных и более эффективных. Возможно, что грядущий фармакологический бум приведет к значительному удлинению средней продолжительности жизни людей в высокоразвитых странах, в числе которых хочется видеть и Россию.
Геномный проект «Описторхоз» – первый и пока единственный крупный проект такого рода в России. Не хотелось бы, чтобы он так и остался стоять одинокой «потемкинской деревней» в чистом поле российской геномики. Значит, нужно искать новые проблемы, генерировать новые идеи, планировать новые инициативы. Потому что инструмент для реализации таких планов – Сибирский центр геномных, протеомных и биоинформационных технологий – будет работать в новосибирском Академгородке и через годы после того, как завершится проект «Описторхоз». И возможно, со временем, станет ясно, что в этом и есть главная заслуга проекта.
Литература
Беэр С. А. Биология возбудителя описторхоза. М.: Товарищество научных изданий КМК. 2005. 336 с.
Федоров К. П., Наумов В. В., Кузнецова В. Г., Белов Г. Ф. Некоторые реальные проблемы описторхоза человека // Мед. паразитол. 2002. T. 3. C. 7—9.
Kaewkes S. Taxonomy and biology of liver flukes // Acta Tropica. 2003. T. 88. C. 177—186.
King S., Scholz T. Trematodes of the family Opisorchiidae: a mininreview // The Korean Journal of Parasitology. 2001. T. 201. C. 209—221.
Pauly A., Schuster R., Steuber S. Molecular characterization and differentiation of opistorchiid trematodes of the species Opistorchis felineus (Rivolta, 1884) and Metorchis bilis (Braun, 1790) using polimerase chain reaction // Parasitol Res. 2003. T. 90. C. 409—414.
Wongratanacheewin S., Sermswan R. W., Sirisinha S., Immunology and molecular biology of Opistorchis viverrini infection // Acta Tropica. 2003. T. 88. C. 95—207.
В работе по подготовке материала для публикации участвовали: Н. Б. Рубцов, д.б.н., зам. директора, зав. лабораторией регуляции экспрессии генов ИЦиГ СО РАН, руководитель Центра коллективного пользования микроскопического анализа биологических объектов СО РАН; С. И. Байбородин, к.б.н., с.н.с. лаборатории регуляции экспрессии генов ИЦиГ СО РАН; А. В. Катохин, к.б.н., с.н.с. сектора функциональной геномики ИЦиГ СО РАН; О. И. Синицина, к.б н., с.н.с. сектора мутагенеза и репарации ИЦиГ СО РАН