Протеомика - высокотехнологичная «рыбалка»
Мы живем в эпоху, которая регулярно обогащает язык массой новых слов, терминов и понятий. Области знания и информация, наполняющая их, множатся быстрее, чем возможности человека позволяют осознать этот процесс. «Протеомика» – новое направление науки, появившееся совсем недавно. Объектом ее изучения являются белки – «рабочие лошадки» любой клетки. Интерес к этим соединениям вызван не только их огромной ролью в функционировании живых организмов, но и тем, что они могут служить мишенями при создании новых лекарств
Слово «протеин», которым в научной литературе принято обозначать белок (высокомолекулярное органическое соединение, представляющее собой цепочку аминокислот), является производным от греческого proteios – «первоначальный». Его этимология точно описывает роль белков в поддержании жизни клетки любого организма – от бактерии до человека.
А вот термин «протеом» знаком, пожалуй, только специалистам. Интересно, что его придумал в 1994 г. австралийский студент М. Уилкинс, пытаясь в своей дипломной работе найти короткое название полному набору человеческих белков вместо неуклюжего словосочетания «все белки, экспрессируемые геномом». Уже на следующий год в научной печати появился термин «proteomics» (протеомика), обозначивший новое направление в молекулярной биологии (Wasinger et al., 1995).
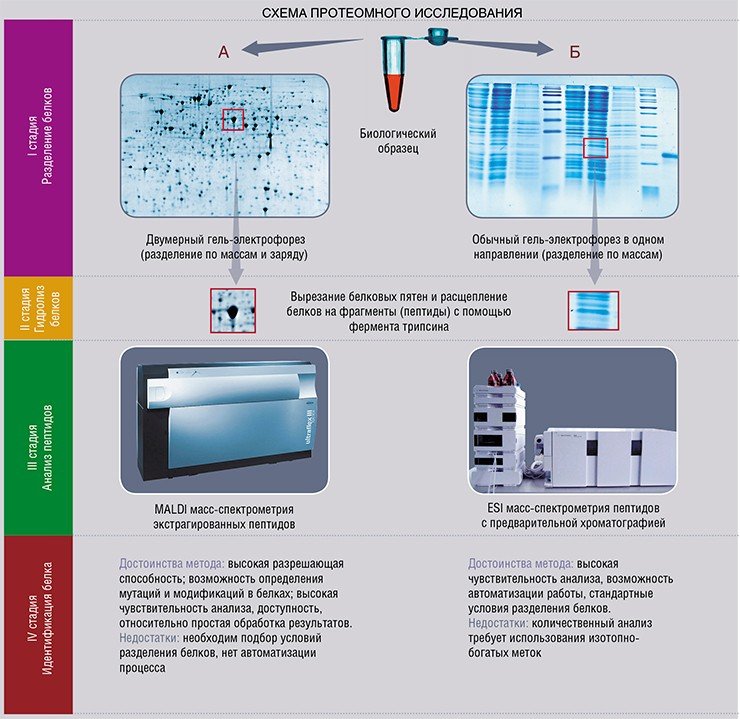
Следует отметить, что само предложение «создать молекулярный белковый атлас человека» было озвучено еще около тридцати лет назад (Anderson, 1985). Но в то время оно было, скорее, пожеланием, технологически невыполнимым. Что же изменилось за прошедшие десятилетия? Во-первых, была успешно реализована программа по геномике, включающая разработку технологий быстрого секвенирования ДНК, создание баз данных нуклеотидных последовательностей. Вторая предпосылка связана со взрывным развитием инструментальных методов: масс-спектрометрии белков и пептидов (небольших цепочек аминокислот), а также электрофореза и хроматографии, использующихся для разделения органических молекул.
Эти факторы сделали возможным появление новой «высокотехнологичной» биологической дисциплины.
Белковое изобилие
В отличие от геномов, протеомы, т. е. полные наборы белков клетки, представлены активным набором молекул, которые постоянно модифицируются. При этом, если биохимия имеет дело с отдельными выделенными молекулами, то в случае с протеомом мы имеем дело с огромным молекулярным пулом (уместно провести аналогию с рыбой, пойманной на удочку, и рыбным изобилием принесенным неводом).
Из этих положений вытекают цели и задачи науки протеомики. Прежде всего, эта дисциплина отвечает за белковую «систематику» – инвентаризацию всех белков, закодированных в геноме определенного организма, которая предполагает также и построение молекулярных белковых атласов отдельных клеток, органов и тканей.
Однако более интересна и намного более существенна задача (назовем ее «физиологической»), которая заключается в определении принципов взаимодействия между белками, а также в установлении закономерностей регуляции их работы при так называемой пост-трансляционной модификации (изменении) белков. Это важно для поиска новых маркеров патологических процессов (болезней) в организме человека.
Дело в том, что пост-трансляционная модификация белков происходит в клетке уже после их синтеза в ответ на какое-либо внешнее возмущение или болезнь. В результате свойства белков могут быстро измениться, что влияет на скорость их синтеза и деградации. В итоге результат таких процессов отразится на общем профиле белков. Изучая его, можно обнаружить белки, «производство» которых в состоянии болезни отличается от «здоровой нормы». Такие белки могут использоваться в диагностических целях в качестве биомаркеров того или иного заболевания.
Функциональная, структурная и медицинская
Протеомика – наука молодая, но исследования в этой области уже имеют хорошую организационную поддержку. В 2001 г. была основана «Human Proteome Organisation» (HUPO) – международная организация, которая объединяет и направляет усилия ученых.
На официальной странице HUPO подробно изложены основные направления исследований, перечень которых может многое сказать даже неспециалисту: протеом человека, протеомика мозга, изучение антител, болезни, вызванные нарушениями метаболизма сахаров, протеомика сердечно-сосудистых заболеваний, протеомика стволовых клеток, определение биомаркеров заболеваний, изучение заболеваний человека на мышиных моделях и т. д.
Методологически в протеомике выделяют несколько направлений, главными среди которых являются функциональная, структурная и медицинская (клиническая) протеомика.
О целях функциональной протеомики уже упоминалось выше. Это получение информации о межбелковых взаимодействиях и их влиянии на экспрессию и модуляцию активности генов, а также пост-трансляционную модификацию белков в составе белковых комплексов.
Структурная протеомика, несмотря на то что является классическим направлением исследования белков, тем не менее, продолжает активно развиваться вследствие усовершенствования аналитических методов, таких как новые варианты ЯМР-спектроскопии, рентгеноструктурного анализа и масс-спектрометрии.
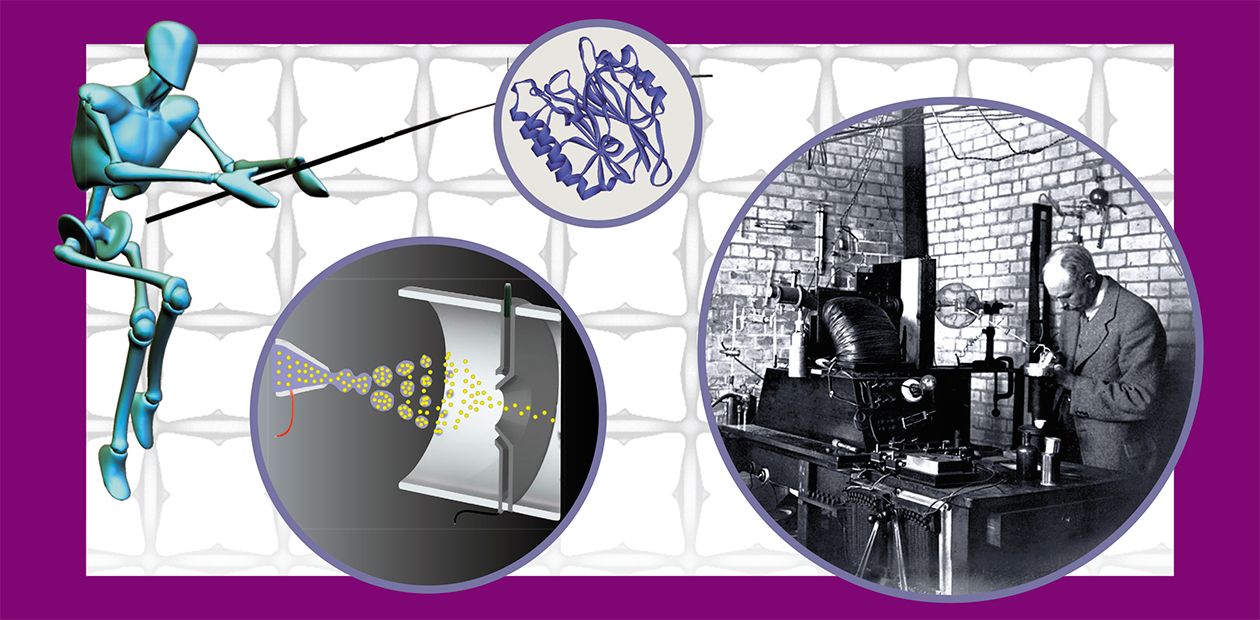
КАК МОЛЕКУЛЫ НАУЧИЛИСЬ «ЛЕТАТЬ»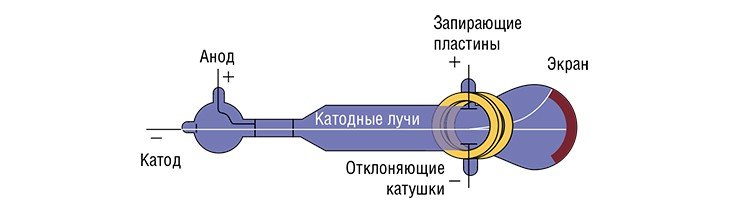
Что же измеряет масс-спектрометр? Строго говоря, он детектирует не массу молекулы, а соотношение m/z (соотношение массы иона к его заряду). В масс-спектрометре зачастую одни и те же молекулы могут иметь различные заряды и, соответственно, детектироваться в разное время. Понятно, что не имеющие заряда молекулы (нейтральные) не взаимодействуют с электрическим и (или) магнитным полем и для масс-спектрометра невидимы.
Вся история этой молодой науки пестрит именами Нобелевских лауреатов. Создателем первого масс-спектрометра заслуженно считают профессора Кембриджского университета Дж. Томпсона (Нобелевская премия по физике 1906 г.), который еще в самом начале XX в. века наблюдал изменения в движении ионов под действием электромагнитного поля. Основываясь на этих наблюдениях, он создал «параболический спектрограф», в котором молекулярные ионы двигались в электрическом поле по параболическим траекториям и детектировались по свечению люминесцентного экрана.
Эта работа была развита и усовершенствована коллегой Томпсона профессором Ф. Астоном, который за создание масс-спектрографа был удостоен Нобелевской премии по химии в 1922 г.

В это же время профессор Чикагского университета А. Демпстер работал над повышением эффективности ионизации молекул в масс-спектрометре. В 1918 г. он создал масс-спектрометр, в котором молекулы ионизировались под действием направленного потока электронов. Этот метод до настоящего времени является основным для ионизации небольших, легко летучих молекул. Сам же автор использовал прибор для определения изотопного состава элементов. Став полноправным участником «ядерной гонки», он в 1935 г. открыл изотоп урана 235U. Его последователь – профессор Университета Миннесоты А. Ниер стал одним из ключевых участников Манхэттенского проекта: первая атомная бомба была создана из 235U, выделенного Ниером с использованием масс-спектрометра.
Развитие и совершенствование методов разделения-идентификации молекулярных ионов велось в направлении создания физических моделей, позволяющих дискриминировать ионы по их характеристикам. Самый очевидный способ – позволить ионам лететь в вакууме и разделяться по скоростям, как производные массы молекулы. Так, в 1946 г. профессор Университета Пенсильвании У. Стефенс предложил время-пролетную масс-спектрометрию. Этот метод основан на том, что все ионы ускоряются электрическим полем и получают одинаковую кинетическую энергию. Скорость же каждого из них зависит от соотношения m/z, что позволяет легко их определять.
Альтернативный метод разделения молекулярных ионов в середине 1950-х гг. был предложен профессором Боннского университета В. Паулем. Он разработал метод разделения ионов в переменном электрическом поле, положив начало другому типу масс-спектрометров – ионной ловушке. Квадрупольная ловушка Пауля использует для удержания (разделения) ионов постоянные и переменные (радиочастотные) электрические поля. Хотя точность такого метода по сравнению с время-пролетным масс-спектрометром существенно ниже, он выигрывает в скорости сканирования и ширине динамического диапазона. Поэтому ионные ловушки являются идеальными детекторами для анализа в метаболомике, фармакологии, экологических исследованиях, а их создатель также удостоен Нобелевской премии по физике в 1989 г. (совместно с Х. Демельтом).

С другой стороны, с помощью традиционных масс-спектрометров оказалось невозможным проводить анализ биологических макромолекул, поскольку биополимеры невозможно ионизовать и перевести в газообразное состояние нагреванием либо облучением пучков электронов. (Почти каждый из нас убедился в справедливости этого утверждения на своем опыте: яичница, забытая на плите, пригорает к сковородке, а не испаряется.)
Широкое использование масс-спектрометрии в изучении структуры и функций белков и пептидов стало возможным лишь благодаря технологическому прорыву, случившемуся в 1980-х гг., когда были разработаны новые, подходящие для биомолекул методы ионизации.
В 1983 г. команда профессора Йельского университета Дж. Фенна предложила метод ионизации электроспреем, в котором образование ионов достигалось путем распыления раствора образца при прохождении его через капилляр, на который подается высокое напряжение.
В это же время немецкая команда Ф. Хиленкампа предложила метод ионизации органических молекул путем облучения их высушенных образцов ультрафиолетовым лазером. При этом молекулы испарялись и ионизировались вместе с твердым летучим органическим веществом – матрицей. Это было рождение, пожалуй, самого популярного и востребованного в настоящее время метода биологической масс-спектрометрии – MALDI («Matrix-Assisted Laser Desorption/Ionization»).
Выбор вещества матрицы и подбор оптимального соотношения вещество/матрица обусловливает чувствительность метода за счет максимально эффективного перевода исследуемого вещества в газообразную фазу.
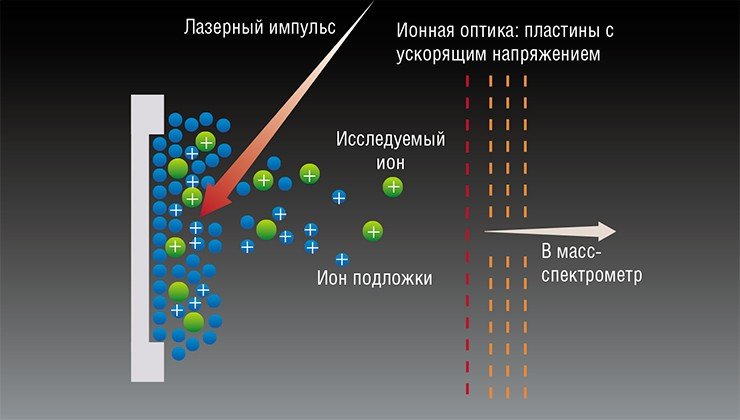
Уже через три года после публикации Хиленкампа сотрудник японской компании «Shimadzu» К. Танака предложил готовое решение для масс-спектрометрии белков массой до 100 кДа – время-пролетный MALDI масс-спектрометр. Справедливости ради нужно отметить, что используемые в нем матрицы были жидкими: белки растворялись в глицерине, в котором были взвешены микрочастицы металлического кобальта.
Эти работы отмечены Нобелевским комитетом в 2002 г.: Фенн и Танака разделили премию по химии за развитие мягких методов ионизации биомолекул в масс-спектрометрии.
Эффективность получения (регистрации) ионов в MALDI масс-спектрометрии зависит от многих параметров: способа приготовления и очистки образца; количественного соотношения матрицы к анализируемому веществу и правильного выбора материала подложки. Важными условиями получения устойчивого сигнала являются мощность лазерного излучения, выбор «горячей точки» на образце, давление в области ионизации.
Для масс-спектрометров с электроспрейным ионным источником в качестве анализаторов наиболее часто используют ионные ловушки. В настоящее время сочетание квадруполя с электроспрейным источником ионов – один из наиболее часто применяемых инструментов в биохимии и метаболомике.
Оба масс-спектроскопических метода имеют свои достоинства и недостатки. Во-первых, для них требуется высокая химическая чистота анализируемого вещества. ESI является более «мягким» способом ионизации, чем MALDI. При ESI образуется непрерывный поток ионов, при MALDI – очень ограниченный во времени (до 10 нс) пакет ионов; при этом ESI-анализу подлежит более 10 фемтомолей вещества, MALDI – в 10 раз меньше.
Но все эти замечания чисто технические и свидетельствуют лишь о том, что методы масс-спектрометрии биологических молекул сегодня стали доступны и широко используются в научных экспериментах и клинических исследованиях. Кроме того, сильные стороны этих методов хорошо дополняют друг друга, исполняя роль поистине мощного аналитического инструмента.
...К настоящему моменту история развития масс-спектрометрии насчитывает вторую сотню лет. Но лишь совсем недавно, как сказал Джон Фенн в своей Нобелевской лекции, «…молекулярные слоны смогли летать на ионных крыльях».
Медицинская протеомика – новая и перспективная область биомедицинских исследований, позволяющая адаптировать достижения функциональной протеомики, геномики и биоинформатики в буквальном смысле непосредственно «к жизни», т. е. использовать имеющиеся знания для клинического анализа биологических образцов, взятых у пациентов.
Современные достижения
Над поиском протеомных маркеров значимых заболеваний интенсивно работают исследователи всего мира – не только ученые из академических институтов, но и специалисты из исследовательских подразделений крупных и средних фармацевтических компаний.
Уже достигнуты определенные успехи в одной из самых проблемных областей медицины – ранней диагностике тяжелых заболеваний. В первую очередь это относится к раку предстательной железы (Downes et al., 2007; Larkin et al., 2010). Диагностика этого широко распространенного заболевания, проводящаяся по наличию в моче пациента белка простатспецифического антигена, – на сегодняшний день одна из самых ранних и точных.
К настоящему времени достигнуты неплохие результаты и в выявлении маркеров рака молочной железы (Mathelin et al., 2006; Gast et al., 2009). Из-за широкой клинической вариабельности этого заболевания в качестве маркеров предлагается использовать набор из 40 белков. Такой белковый профиль позволяет не только с высокой точностью диагностировать заболевание, но и прогнозировать эффективность лечения. Основные диагностические белки этого набора – гаптоглобин, трансферрин, аполипопротеины A-I и C-I – уже сегодня используются при диагностике рака молочной железы.

Ведутся исследования и по обнаружению маркеров нейродегенеративных заболеваний, таких как болезнь Альцгеймера, склерозов различной этиологии и т. д. (Cedazo-Minguez, Winblad, 2010). В этой области основными прогностическими маркерами являются ангиогенин (фермент, обеспечивающий рост кровеносных сосудов), креатининкиназа, фибриноген, аполипопротеин Е (Bowser, Lacomis, 2009)
В Сибири проблемами структурной и функциональной протеомики интенсивно занимаются в новосибирском Институте химической биологии и фундаментальной медицины СО РАН. В результате совместной работы с НИИ Психического здоровья ТНЦ СО РАМН проведена большая работа по поиску белков-маркеров шизофрении.
Этиология и патогенез этой тяжелейшей психической болезни неизвестны. Согласно одной из теорий возникновения шизофрении, в основе заболевания лежит нарушение белкового обмена. Сравнение протеомных профилей статистически достоверной выборки людей, страдающих шизофренией, и протеомных профилей здоровых добровольцев уже позволило исследователям выявить опредленный набор белков в качестве маркеров: аполипопротеин A-II, фосфомевалонат киназу и сериновую (треониновую) киназу. Дальнейшие усилия ученых будут направлены на уточнение роли этих белков в патогенезе болезни и внедрение этих маркеров в клиническую биохимию.
У работы исследователей-протеомщиков огромный потенциал и перспективы. Учитывая то, что в организме человека число различных белковых молекул и их вариантов может составлять миллионы, ученые уверены, что их высокотехнологичная белковая «рыбалка» будет и в дальнейшем гарантированно приносить богатый улов. Успехи последних лет в этой новой биомедицинской области внушают обоснованный оптимизм.
Литература
Cox J., Mann M. Is proteomics the new genomics? // Cell. 2007. V. 130(3). P. 395—398.
Capelo J.L., Carreira R., Diniz M. et al. Overview on modern approaches to speed up protein identification workflows relying on enzymatic cleavage and mass spectrometry-based techniques // Anal. Chim. Acta. 2009. V. 650. N 2. P. 151—159.
Ulrich-Merzenich G., Panek D., Zeitler H. et al. New perspectives for synergy research with the «omic»-technologies // Phytomedicine. 2009. N. 6—7. P. 495—508.
Feng X., Liu X., Luo Q., Liu B.F. Mass spectrometry in systems biology: an overview // Mass Spectrom. Rev. 2008. V. 6. P. 635—660.