Регенеративная медицина: в поисках «эликсира жизни»
Регенерация (от лат. regeneratio – «возрождение») – это естественный процесс восстановления клеток, тканей и органов. Конечно, у человека, в отличие от той же саламандры, не происходит восстановления утраченных конечностей, но так называемая физиологическая регенерация идет в каждом из нас: клетки почти всех тканей непрерывно обновляются, срастаются сломанные кости, заживают раны… При этом еще не так давно считалось, что при таких серьезных патологиях, как хроническая почечная недостаточность или сахарный диабет, восстановление пострадавших из-за болезни органов в принципе невозможно. Однако бурное развитие клеточных технологий в последние десятилетия открыло заманчивые перспективы регенеративной медицины в случаях, ранее считавшихся неизлечимыми
Большинство клеток нашего организма выполняют строго определенные, свойственные только им функции. Так, в миоцитах – клетках мышечной ткани, синтезируется сократительный белок миозин; в β-лимфоцитах крови – специфические иммуноглобулины, позволяющие бороться с инфекциями; нейроны – клетки нервной ткани, способны генерировать электрический импульс и т. д. Все такие клетки имеют свои морфофизиологические особенности, т. е. являются высоко дифференцированными и не способны превращаться друг в друга.
При дальнейшем развитии организма эти клетки приобретают более специализированные свойства, превращаясь в мультипотентные стволовые клетки. Такие клетки способны давать начало клеткам одного из трех так называемых зародышевых листков: эктодермы, из которой происходят, в частности, клетки кожи и нервной системы; мезодермы – родоначальницы клеток соединительной и мышечной ткани; эндодермы, из которой развиваются внутренние органы, такие как печень и легкие.
Стволовые клетки, способные быть предшественниками лишь некоторых, «родственных» типов клеток, называются олигопотентными; только одного типа клеток – унипотентными.
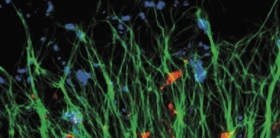
Во взрослом организме имеются гемопоэтические стволовые клетки (родоначальницы всех клеток крови), стволовые клетки кожи, скелетной мускулатуры, миокарда, нейрональные стволовые клетки. Все эти клетки, «обитающие» в конкретных тканях, обладают высоким потенциалом к размножению и дифференцировке – и не только в клетки соответствующей ткани! Так, стволовые клетки кожи способны дифференцироваться в нейроны
Однако в организме имеются и клетки совершенно другого типа – стволовые. Стволовая клетка не принадлежит ни к какой конкретной ткани, однако она способна превратиться в специализированную клетку: нейрон, миоцит, гепатоцит и т. д. Именно универсальные стволовые клетки, способные бесконечно делиться и порождать клетки всех тканей организма, стали одной из центральных фигур регенеративной медицины – современного терапевтического направления, занимающегося восстановительными процессами в организме.
Клеточные технологии: «за» и «против»
Исходно все узкоспециализированные клетки организма образуются в процессе эмбрионального развития из неспециализированных стволовых клеток подобно тому, как из ствола дерева растут ветки и листья. Но стволовые клетки присутствуют не только у эмбриона: они обеспечивают развитие ребенка, а в течение всей дальнейшей жизни отвечают за обновление тканей как при естественной убыли клеток (например, популяция эритроцитов обновляется каждые три-четыре месяца), так и при повреждениях.
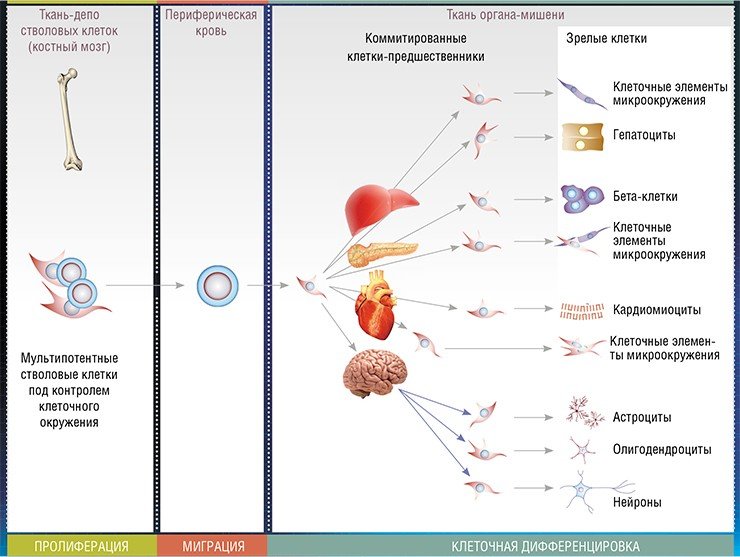
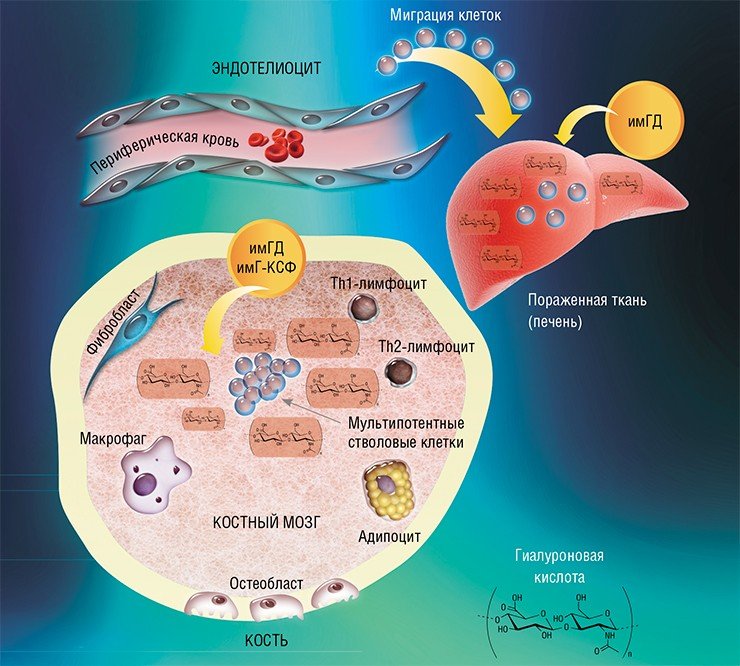
Наиболее изученной популяцией стволовых клеток во взрослом организме является популяция мультипотентных мезенхимальных стволовых клеток костного мозга. Такие клетки способны мигрировать по кровотоку в отдаленные органы и дифференцироваться во многие специализированные клеточные типы. Восстанавливая численность поврежденных и погибших клеток ткани, они восстанавливают структуру и, следовательно, функцию соответствующего органа.
Полученные за последние десятилетия сведения о свойствах и закономерностях жизнедеятельности стволовых клеток послужили толчком к развитию нового направления в лечении многих заболеваний – клеточной терапии. Но хотя сегодня эта область входит в число наиболее популярных в мировой медицинской науке, здесь имеется много проблем. Для терапевтических целей наиболее идеальными являются стволовые клетки 4—7-дневного эмбриона, так как при их использовании не возникает реакция отторжения трансплантата. Но в этом случае имеется немалый риск возникновения онкологических заболеваний, не говоря уже об этической проблеме использования эмбриональных клеток.
Поэтому наиболее рациональным (и наиболее физиологичным!) подходом к решению задач регенеративной медицины можно считать стимуляцию функций эндогенных, т. е. собственных стволовых клеток организма, имитируя деятельность его естественных регуляторных систем. Именно такими исследованиями занимаются в «НИИ фармакологии» СО РАМН (Томск), где разрабатываются фармакологические средства воздействия на эндогенные стволовые клетки.
Исследования начались с поиска ответа на важный вопрос: как реагируют стволовые клетки взрослого организма на серьезные патологические состояния? Для этого на экспериментальных животных моделировались такие патологии, как тяжелая форма гепатита с начальной стадией цирроза печени или сахарный диабет. При этом фиксировались маркерные показатели: количество мультипотентных стволовых клеток в костном мозге, периферической крови и в пораженном патологией органе.
Оказалось, что независимо от характера повреждений число стволовых клеток гемопоэтической ткани в костном мозге возрастает, однако при этом не наблюдается увеличения их выхода в кровь, миграции к поврежденному органу и дифференцировки в соответствующие типы клеток. Требовалось заставить эндогенные стволовые клетки работать в полную силу – эту задачу удалось решить с помощью препаратов, созданных на основе веществ и в естественных условиях участвующих в процессах кроветворения.
Мобилизация ресурсов
Гранулоцитарный колониестимулирующий фактор (Г-КСФ) – полипептид, который стимулирует пролиферацию (размножение) и запускает дифференцировку кроветворных клеток гранулоцитарного ряда (эритроцитов, сегментоядерных лейкоцитов – нейтрофилов, базофилов, эозинофилов, клеток иммунной системы – моноцитов и макрофагов). Кроме того, он способен стимулировать мобилизацию и миграцию в органы-мишени мультипотентных мезенхимальных стволовых клеток костного мозга, а также их последующую клеточную дифференцировку.
Еще более широкий спектр действия имеет гиалуронидаза – фермент, который разрушает гиалуроновую кислоту, один из компонентов межклеточного матрикса, (вещества, заполняющего пространство между клетками). В нативном виде гиалуроновая кислота способна взаимодействовать со специфическими рецепторами стволовых клеток; расщепляясь на фрагменты в результате действия фермента, она активирует процессы их деления, дифференцировки и миграции. В результате гиалуронидаза способна опосредованно повышать активность мезенхимальных стволовых клеток костного мозга и кроветворных клеток-предшественников, а также усиливать действие гранулоцитарного колониестимулирующего фактора.
Идея использовать эти биологически активные вещества для активации стволовых клеток, достаточной для регенерации тех или иных пораженных органов, кажется очень привлекательной. Однако в дозах, превышающих их нормальное содержание в организме (но необходимых для такой стимуляции!), и Г-КСФ, и гиалуронидаза очень токсичны, настолько, что это делает невозможным их широкое применение в качестве средств регенеративной медицины.
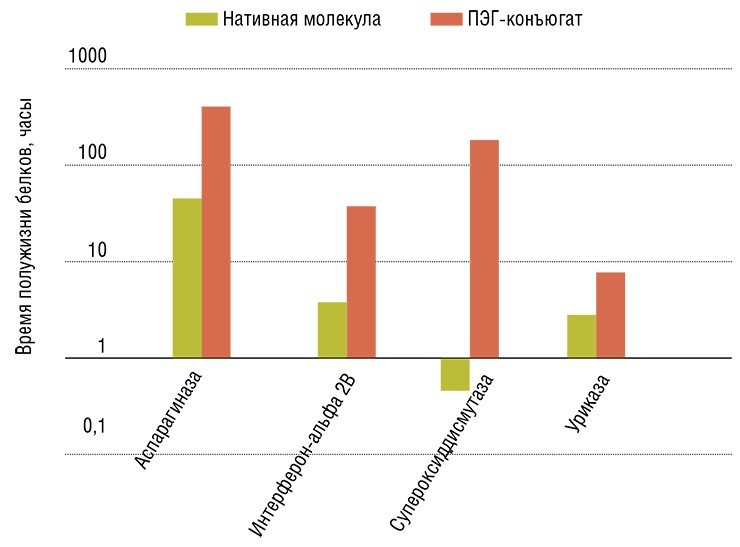
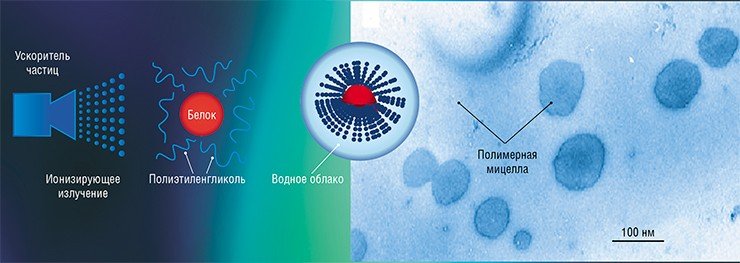
Однако выход из тупика был найден: нужно использовать для этих веществ специальные носители. Создание специфических носителей для лекарств – реальная перспектива приложения нанотехнологий в практической фармакологии. Конечно, в этом случае мы имеем дело не с такими футуристическими продуктами, как оснащенные по последнему слову техники нанороботы, способные работать внутри человеческого организма. Однако благодаря относительно простой манипуляции – «пришиванию» фармакологически активных веществ к долгоживущим полимерным молекулам, удается повысить способность терапевтических молекул преодолевать тканевые барьеры, уменьшить негативные побочные действия (токсичность, аллергенность) лекарства и повысить его эффективность за счет увеличения продолжительности «жизни» в организме.
Следует упомянуть, что классические технологии создания комплексов «лекарство+носитель» очень затратны. Однако специалисты ряда новосибирских научных и научно-производственных организаций – Института ядерной физики СО РАН, Института цитологии и генетики СО РАН и ООО «Саентифик фьючер менеджмент», создали новую технологию радиационного (электронно-лучевого) синтеза, позволяющую в разы снизить затраты на производство таких препаратов при сохранении высокой эффективности.
«Чистые» проигрывают
С использованием технологии радиационного синтеза в «НИИ фармакологии» СО РАМН совместно с ООО «Саентифик фьючер менеджмент» были разработаны нанотехнологичные модификаторы функций стволовых клеток. Это все те же гранулоцитарный колониестимулирующий фактор и гиалуронидаза, но иммобилизованные (химически присоединенные) на полиэтиленгликоле.
Такие модифицированные препараты показали не только более высокую эффективность по сравнению с обычными «чистыми» веществами, но и отличались от них по механизму действия. Так, оказалось, что иммобилизованный на полиэтиленгликоле Г-КСФ в большей степени влияет на пролиферацию и дифференцировку коммитированных стволовых кроветворных клеток, которые более специализированы, чем мультипотентные. В результате снижается риск истощения популяции этих клеток, которые служат «глубоким резервом» регенерации в костном мозге. И хотя пока неизвестно, насколько велика для организма опасность снижения пула недифференцированных мультипотентных стволовых клеток при их искусственной активации, в данном случае разумнее подстраховаться.
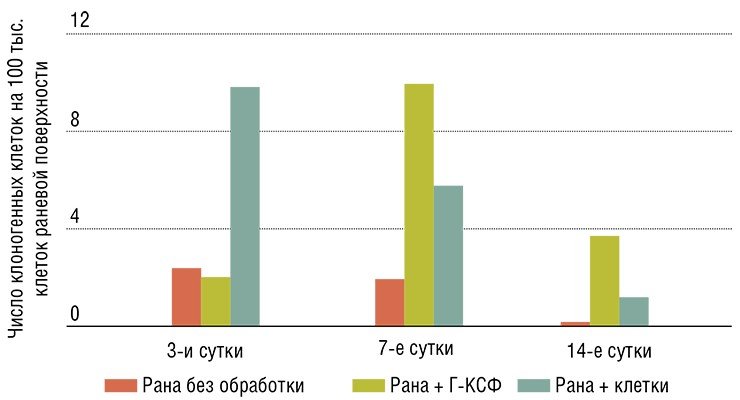
Препараты природной гиалуронидазы (в безопасных дозах) эффективны только при местном применении. Модифицированная же гиалуронидаза обладает в организме системными эффектами, так как не разрушается соответствующими ферментами. Она стимулирует процессы пролиферации и дифференцировки стволовых клеток различных классов, а при патологических состояниях вызывает их выход в кровь и миграцию в орган-мишень.
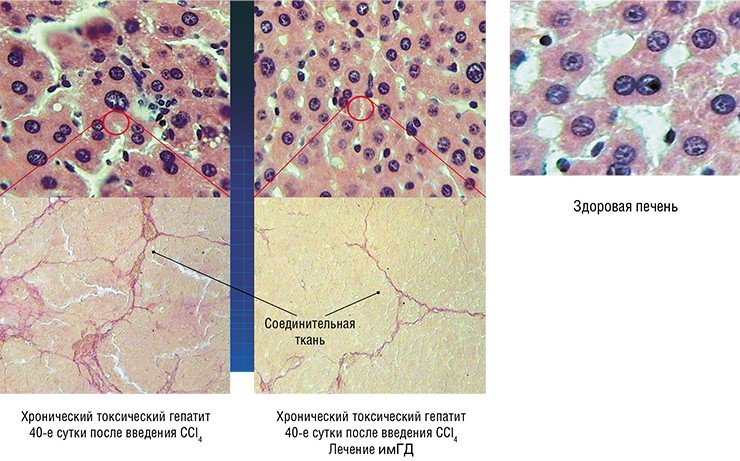
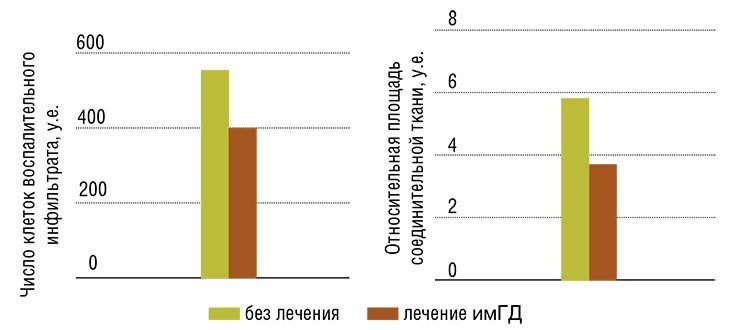
Результаты применения впечатляют: так, ее пятикратное введение лабораторным животным после экспериментально вызванного токсического гепатита привело практически к полному восстановлению морфологии и функции печени. При этом необходимые дозы препарата очень низки, а сам препарат можно принимать перорально (т. е. через рот), а не только с помощью инъекций.
Споявлением клеточных технологий у человечества появилась реальная надежда на излечение многих недугов, которые до настоящего времени считались неизлечимыми. Работы сибирских ученых по созданию фармакологических модификаторов функций стволовых клеток подтверждают, что таким образом можно нормализовать структуру и, следовательно, функцию практически любого органа – если вмешаться в патологический процесс вовремя.
Например, в условиях эксперимента удалось полностью излечить начальную стадию цирроза печени. Разрабатываются и методы безинсулиновой терапии сахарного диабета: не исключено, что за счет эндогенных стволовых клеток появится возможность восстанавливать структуру пораженной поджелудочной железы, чтобы в организме в достаточном количестве вырабатывался собственный инсулин. Из распространенных патологий нервной системы наиболее перспективными для такого лечения являются энцефалопатии, с возможностью полного восстановления когнитивных функций головного мозга; а в отдаленной перспективе – ряд таких тяжелых патологий, как болезни Паркинсона и Альцгеймера.
Конечно, пока все эти разработки находятся на доклинической стадии исследования: полный же цикл создания нового лекарственного средства долог и требует больших материальных и финансовых вложений. Но, как известно, «дорогу осилит идущий»…
Литература
Дыгай А. М., Артамонов А. В., Бекарев А. А. и др. Нанотехнологии в фармакологии. М.: Издательство РАМН, 2011. 136 с.
Дыгай А. М., Зюзьков Г. Н. Клеточная терапия: новые подходы // Наука в России. Москва: Наука, 2009. Т. 169, № 1. С. 4—8.
Дыгай А. М., Зюзьков Г. Н., Жданов В. В. и др. Иммобилизированный гранулоцитарный колониестимулирующий фактор. Фармакологические свойства и перспективы использования. Томск: ООО «Печатная мануфактура», 2011. 149 с.
Дыгай А. М., Жданов В. В., Зюзьков Г. Н. и др. Гепатопротекторные эффекты иммобилизированных препаратов гранулоцитарного колониестимулирующего фактора и гиалуронидазы и механизмы их развития // Клеточные технологии в биологии и медицине. 2012. № 1. С. 14—18.