Вакцины завтрашнего дня
Благодаря развитию новых технологий наш словарь обогащается новыми понятиями. Свежий пример – съедобные вакцины. Это уже почти реальность: крепкий сибирский помидорчик с трансгенной «начинкой», кандидатная вакцина против вирусов гепатита и ВИЧ.
Вакцинация, изобретенная более 200 лет назад, стала эффективным и доступным способом защиты населения от инфекционных заболеваний. Первые вакцины получали методом проб и ошибок, но благодаря бурному развитию молекулярной биологии и генетической инженерии открылись небывалые возможности для создания новых способов иммунизации и новых вакцин.
Сибирские ученые задались целью создать съедобную профилактическую вакцину против двух грозных заболеваний современности – гепатита В и СПИДа, использовав в качестве носителя один из наиболее популярных овощей. Весьма необычным был сам подход – исследователи решили встроить в «сеньора Помидора» ген, кодирующий искусственный белок-иммуноген. Насколько удачной оказалась эта попытка – судить вам, читатель!
Пища необходима нам, как свет – растениям. Она дает нам энергию для умственных упражнений и физической активности, поставляет строительный материал мышцам, костям и нервам. Она может радовать наш вкус, осязание и обоняние, даже – наше чувство прекрасного. В XXI веке у пищи есть шанс обрести новые свойства: она сможет предохранять нас от болезней, перейдя из разряда «вкусной и питательной» в разряд «функциональной».
Знакомьтесь – съедобные вакцины!
В мае 1796 года произошло событие «ценою» в миллионы спасенных человеческих жизней. Английский врач Эдуард Дженнер открыл способ предохранения от грозного заболевания – натуральной оспы – путем заражения легкой формой схожего заболевания, оспой коров. Эстафету Дженнера принял знаменитый французский ученый Луи Пастер – настоящий «микробный» Леонардо Да Винчи XIX века. С этого времени вакцинация (от лат. vaccus – корова) стала наиболее популярным, эффективным и доступным способом защиты населения от заболеваний, вызванных патологическими микроорганизмами, особенно – вирусами, фармацевтические препараты против которых практически отсутствуют.
Суть вакцинации заключается в том, что в организм вводятся убитые или ослабленные микробы, что обеспечивает развитие у человека иммунитета, т. е. невосприимчивости к болезни. Патогенные агенты «несут» на себе антигены, молекулы разной природы (белки, полисахариды и т. д.), которые распознаются организмом и вызывают защитный иммунный ответ. Первые вакцины получали методом проб и ошибок, но в наше время, благодаря развитию молекулярной биологии и генетической инженерии, открылись небывалые возможности для создания новых способов иммунизации и новых вакцин.
Среди них – ДНК-вакцины на основе генно-инженерных плазмид, микрокапсулированные и «леденцовые» вакцины с углеводом трегалозой, синтетические вакцины из искусственно синтезированных белков и полисахаридов... Требования к новым вакцинам едины: они должны быть безопасными, недорогими, простыми в использовании, длительно сохраняться и транспортироваться без использования холодильного оборудования. Все эти требования сполна удовлетворяют вакцины на основе генетически модифицированных растений со встроенными фрагментами ДНК патогенных микроорганизмов: их применение может стать революционным событием в профилактической медицине.
Съел – и в порядке!
В чем же состоит уникальность и привлекательность такого типа вакцин – съедобных? Во-первых, сам способ иммунизации – оральный, т. е. через рот – является простым, удобным и безопасным, так как снижает риск заражения другими микроорганизмами по сравнению с инъекциями или скарификацией, нарушающими кожные покровы. Во-вторых, съеденная вакцина попадает прямиком в желудочно-кишечный тракт, а конкретно – к его слизистым оболочкам.
Слизистые (иначе мукозные, от англ. mucosal) оболочки пищеварительного, дыхательного и мочеполового трактов являются обычными местами проникновения и колонизации для многих патогенных микроорганизмов. Защита этих оболочек обеспечивается иммунокомпетентными клетками, организованными в специальные лимфоидные ткани. Эта так называемая мукозная иммунная система является первым барьером на пути инфекций в отличие от исторически первой изученной системной иммунной системы, обеспечивающей защиту внутренних органов организма.
Стимуляция гуморального иммунитета в результате инъекционной вакцинации обычно эффективно предотвращает системные инфекции, но при этом не защищает слизистые оболочки. Мукозная же иммунизация чаще всего приводит к стимуляции как мукозного, так и системного иммунных ответов.
Однако проводить иммунизацию через слизистые оболочки непросто из-за ряда физиологических барьеров, препятствующих проникновению антигенов. Оболочка же растительных клеток обеспечивает антигену естественную защиту при прохождении через пищевод и желудок с кислым пищеварительным соком. Затем «упакованный» антиген благополучно достигает кишечника и соответственно, – мукозной иммунной системы.
Привлекательным свойством растительных вакцин является не только их потенциальная дешевизна, простота хранения и применения, но и огромный спектр самих пищевых прототипов – овощей, фруктов, злаков. Более того, можно создать растения, продуцирующие одновременно антигены разных инфекционных агентов, т. е. съедобные многокомпонентные вакцины! Не такой ли – почти «идеальной» – представлялась вакцина будущего основоположникам вакцинологии более 200 лет назад?
Начинка для Сеньора Помидора
Саму идею создания трансгенных растительных вакцин высказал в 1992 году американец Х. Мейсон. Через три года исследователи предприняли успешную попытку получения вакцины против гепатита В на основе трансгенного табака, в котором синтезировался поверхностный антиген (HBsAg) вируса. Рекомбинантный белок, вы-деленный из табака, при инъекции мышам вызывал у них такой же специфичный иммунный ответ, как и при использовании стандартной трансгенной вакцины из дрожжей. Затем был создан трансгенный картофель, продуцирующий HBsAg, а в 1999 году были начаты эксперименты на добровольцах, давшие положительный результат.
 В последнее время одним из самых важных и перспективных направлений в создании съедобных вакцин считается использование растений, которые могут широко использоваться в пищу без термообработки.
В последнее время одним из самых важных и перспективных направлений в создании съедобных вакцин считается использование растений, которые могут широко использоваться в пищу без термообработки.
Ученые из Государственного научного центра вирусологии и биотехнологии «Вектор» (наукоград Кольцово, Новосибирская область) в содружестве с сотрудниками Сибирского института физиологии и биохимии растений СО РАН (г. Иркутск) и новосибирского Института химической биологии и фундаментальной медицины СО РАН поставили перед собой задачу создать кандидатные съедобные вакцины против вируса гепатита В человека и вируса иммунодефицита человека на основе трансгенных растений томата. Проект получил финансовую поддержку Министерства сельского хозяйства США (грант № 2176р Международного научно-технического центра).
Вирусы иммунодефицита человека (ВИЧ) и гепатита В, к сожалению, хорошо известны и не нуждаются в «ре-кламе». Отметим только, что в современном мире распространение этих инфекций приобретает характер эпидемии. По данным ВОЗ смертность от СПИДа достигает 2–3 млн, а от гепатита В – 1 млн человек в год! Поэтому неудивительно, что эти болезни привлекают к себе пристальное внимание биотехнологов во всем мире.
Конструируем химеру
В создании генно-инженерных вакцин существует несколько подходов. При первом – в качестве встраиваемого фрагмента используется реальный ген инфекционного агента. Более нетрадиционным и многообещающим является конструирование генов, кодирующих искусственные белки, так называемые синтетические вакцины. Это – молекулы с заранее заданной третичной структурой и с оптимально подобранным составом эпитопов, т. е. «активных» центров инфекционного антигена, которые и запускают каскад иммунных реакций организма.
На основе этой методологии сотрудником ГНЦ ВБ «Вектор» А. М. Ерошкиным вместе с коллегами был рассчитан полиэпитопный белок-иммуноген против ВИЧ, названный ТВI (T- and B-cellular immunogen). Затем для этого белка синтезировали кодирующую ДНК-последовательность и встроили ее в кишечную палочку E. coli. У животных, иммунизированных полученным рекомбинантным белком, был обнаружен как гуморальный, так и клеточный иммунный ответ против вируса иммунодефицита, что доказало правильность используемого подхода.
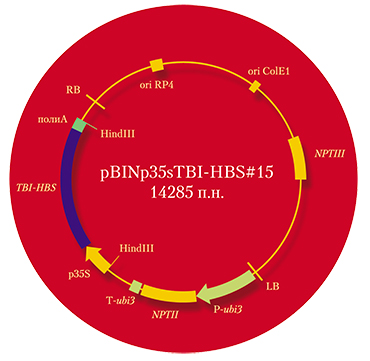
Исследователи пошли дальше по пути создания именно съедобных вакцин. Было решено встроить подобную генетическую конструкцию в растения томатов, в результате чего в них должен был синтезироваться «неприродный» белок. И не просто искусственный, но еще и химерный, поскольку к набору из девяти иммуногенных эпитопов белков ВИЧ-1 (TBI) был добавлен еще и поверхностный антиген вируса гепатита В (HBsAg). В результате ожидалось получить мультивалентную синтетическую вакцину одновременно против двух вирусных заболеваний. Генетические конструкции для переноса в растения были созданы сотрудниками «Вектора» и ИХБиФМ, а перенос их в растения томата и селективный отбор трансгенных растений осущестили сотрудники СИФИБРа.
Цена «золотых яблок»
В листьях и плодах полученных трансгенных растений томата действительно были обнаружены антигенные детерминанты TBI и HBsAg, что, безусловно, подтверждало синтез в них целевого химерного белка TBI-HBsAg. Чтобы избежать возможной ошибки, определение белка иммуноферментными методами проводилось независимо в СИФИБРе и «Векторе». Но вот вопрос – оправдают ли эти аппетитные помидорчики свое итальянское имя – «золотые яблоки»? Иначе – будут ли трансгенные плоды «работать» как вакцина?
 Здесь следует обратить внимание на следующий нюанс. Вакцина – не лекарство, она является лишь профилактическим средством. Как проверить ее эффективность, особенно в случае тяжелейших, более того – смертельных заболеваний? В этом случае нам, пожалуй, не стоит следовать не слишком гуманному примеру гениального Дженнера, проверившего свое открытие на восьмилетнем ребенке. Нельзя ведь, в самом деле, накормив добровольцев (если таковые и нашлись бы) помидорами, затем заражать их ВИЧ-инфекцией и смотреть на результат?
Здесь следует обратить внимание на следующий нюанс. Вакцина – не лекарство, она является лишь профилактическим средством. Как проверить ее эффективность, особенно в случае тяжелейших, более того – смертельных заболеваний? В этом случае нам, пожалуй, не стоит следовать не слишком гуманному примеру гениального Дженнера, проверившего свое открытие на восьмилетнем ребенке. Нельзя ведь, в самом деле, накормив добровольцев (если таковые и нашлись бы) помидорами, затем заражать их ВИЧ-инфекцией и смотреть на результат?
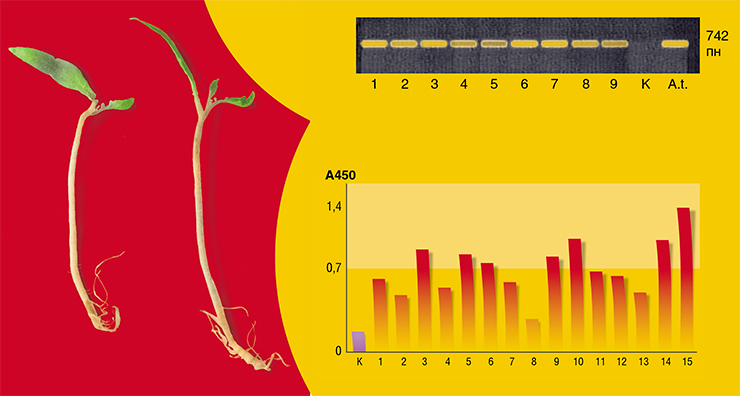
Поэтому в «бой», как всегда, вступили лабораторные мыши. Правда, СПИДом, как, впрочем, и гепатитом, мыши не болеют, однако их иммунная система должна была отреагировать на интервенцию антигенного белка. Помидоры мыши тоже недолюбливают, поэтому массу из измельченных плодов сотрудники «Вектора» через катетер вводили животным прямо в пищевод. Для оценки же мышиного иммунитета использовался стандартный иммуноферментный анализ (ИФА) на наличие антител к вирусам гепатита В и ВИЧ-1.
Эксперимент, в котором мышей кормили помидорами три раза с интервалом в 2 недели, закончился совсем недавно – в сентябре этого года. И его можно однозначно назвать успешным: уже после второго кормления в крови иммунизированных животных значительно увеличился уровень антител против вируса гепатита В. Более того, мукозный иммунный ответ, судя по результатам анализа мышиных фекалий, начинался еще раньше – уже после первого кормления – и сохранялся до конца эксперимента. В отношении ВИЧ картина была схожей и, хотя уровни выявленных антител были не столь высоки, они достоверно отличались от аналогичных анализов у контрольных животных, сидевших на «диете» из обычных нетрансгенных томатов.
Таким образом, можно сказать, что кандидатная съедобная вакцина одновременно против двух вирусных инфекций – гепатита В и ВИЧ-инфекции (СПИДа) – в принципе получена. В этой фразе отметим два слова – в принципе и кандидатная, которые, как макушка айсберга, обозначают проблему.
Вообще-то, планов у участников проекта много: кроме томатов, хотелось бы использовать и другие привлекательные носители трансгенов, например, морковь, сладкий перец, злаки, объединяя свои усилия с учеными из других городов и институтов. А еще можно попробовать увеличить продуктивность растений-вакцин, трансформируя не только их ядерный геном, но и генетический материал многочисленных хлоропластов, в которых происходит фотосинтез. Судя по нашим предварительным результатам, перспективным может оказаться «комбинированный» путь, т. е. сочетание съедобной вакцины с инъекцией плазмидных ДНК-вакцин. Эффективность полученной вакцины оценивалась косвенным путем, – почему бы не перейти к прямым клиническим испытаниям – например, на приматах? Но в Сибири бананы не растут, а уж сколько стоят здесь обезьяны…
И так во всем, – когда речь заходит о каких-то масштабных проверках, доклинических и прочих, о выведении устойчивых трансгенных линий растений, на передний план выходит сакраментальный для нашей страны призыв: «Ищите деньги!». Пока будущее – в тумане. А для продолжения работ требуется не менее 200 тысяч долларов в год. Интересно было бы знать – покрывает ли такая сумма хотя бы суточные траты Центра исследования СПИДа, что под Вашингтоном?