VITA значит жизнь. Бор-нейтронозахватная терапия рака
Онкозаболевания остаются одной из ведущих причин смертности, несмотря на все успехи, достигнутые в борьбе с ними. Идея бор-нейтронозахватной терапии рака, оказавшейся эффективной при лечении неизлечимых пока видов опухоли, появилась 75 лет назад, однако в мире до сих пор нет действующего специализированного комплекса, работающего по этой методике. Институт ядерной физики СО РАН, подключившийся к решению проблемы немногим более десяти лет назад, достиг успеха, создав действующий прототип установки, которую можно использовать в онкологических клиниках
Идея избирательного поражения клеток злокачественных опухолей методом бор-нейтронозахватной терапии (БНЗТ) впервые была предложена в 1936 г. – спустя всего четыре года после открытия нейтрона.
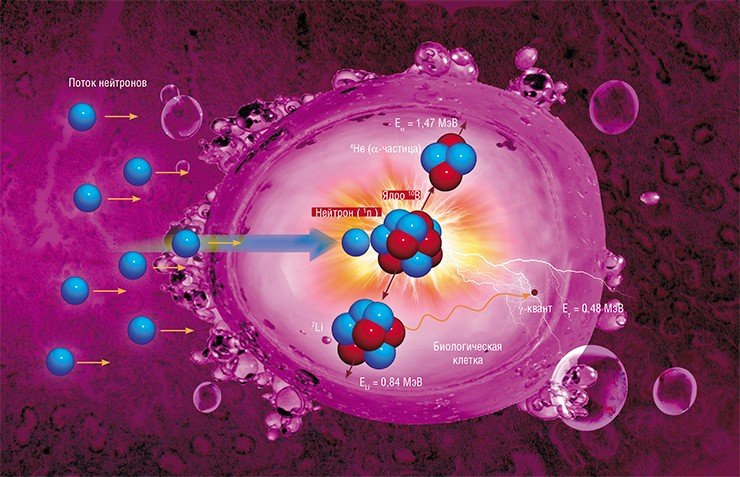
Ее физический принцип прост и элегантен. Cтабильный изотоп бора 10B вводят в опухоль, которую затем облучают потоком нейтронов. При поглощении нейтрона ядром бора-10 происходит образование двух массивных частиц, которые отдают свою энергию при торможении на микрометровом расстоянии, т. е. в пределах именно «меченой» бором клетки, что приводит к ее необратимому разрушению.
Своей красотой методика обязана нескольким подаркам природы. Во-первых, ядро бора-10 необычайно эффективно захватывает нейтрон: площадь сечения поглощения теплового нейтрона составляет 4•10-25 м2, что в тысячи раз больше, чем у ядер большинства других элементов. Вторая благоприятная особенность бора – быстрое торможение продуктов его распада, что обеспечивает локальность процесса: около 80 % энергии ядерной реакции выделяется внутри самой раковой клетки. Наконец, огромное преимущество бора состоит в том, что он образует соединения, не токсичные для организма человека, такие как борфенилаланин (BPA) или борный сульфгидрил (BSH), которые обычно используются в качестве контрастных средств для диагностики опухолей на магниторезонансном томографе, но могут быть использованы также и для адресной доставки бора в опухоль.
Несмотря на кажущуюся простоту, методика БНЗТ оказалась чрезвычайно сложной в реализации. В своем развитии она испытывала взлеты и падения, и сегодня возведена в статус искусства, которое в ближайшее время, возможно, позволит бороться с доселе неизлечимыми опухолями.
Излечить неизлечимое
Первые биологические эксперименты по БНЗТ были начаты на мышах еще во время Второй мировой войны. В 1951 г. было впервые продемонстрировано на практике, что при использовании соединений бора с некоторыми аминокислотами концентрация этого элемента в раковых клетках оказывается выше, чем в здоровых. Действительно, раковые клетки склонны к усиленному размножению, которое сопровождается интенсивным синтезом белка, поэтому они нуждаются в большом количестве аминокислот. И когда в кровь пациента вводили раствор бор-содержащей аминокислоты, уже через считанные минуты бор концентрировался преимущественно в клетках опухоли.
К концу 1950-х гг. в Брукхевене и Массачусетсе (США) построили специальные ядерные реакторы для первых клинических испытаний. К сожалению, ожидаемой терапевтической эффективности достичь не удалось, и эксперименты прекратили. Как выяснилось впоследствии, причиной неудачи стала недостаточная клеточная концентрация бора. Дело в том, что нейтроны взаимодействуют не только с бором, но и с ядрами азота и водорода, из которых более чем на 70 % состоят биологические ткани. Из-за низкой концентрации бора основную часть поглощенной пациентом радиации составило неизбирательное «фоновое» излучение, обусловленное таким взаимодействием.
Несмотря на неудачу, один из участников испытаний – японский нейрохирург Хатанака, вернувшись на родину в 1968 г., продолжил заниматься методикой БНЗТ. Прямо в помещении ядерного реактора он трепанировал пациенту череп, на открытом мозге проводил хирургическую операцию по удалению опухоли, а затем облучал операционное поле пучком тепловых нейтронов, предварительно введя в организм пациента борсодержащие препараты. Таким способом в Японии успешно пролечили более двухсот пациентов. Первый же пациент Хатанаки с глиобластомой мозга прожил впоследствии 21 год вместо обычного при таком диагнозе полугода. Благодаря этим результатам, а также прогрессу в синтезе эффективных препаратов доставки бора в клетки опухоли, с 1990-х гг. клинические испытания нового метода стали проводиться во многих странах мира.
Важнейшее достоинство этого метода заключается в том, что он ориентирован на лечение практически не поддающихся терапевтическому воздействию злокачественных образований, в том числе глиобластом мозга и метастазов меланомы. Судите сами: глиобластома мозга сегодня ежегодно диагностируется у одного человека из каждых 20 тысяч, и исход всегда фатальный, – хирургия и традиционная радиотерапия не могут остановить распространение опухоли по мозгу, они позволяют лишь продлить пациенту жизнь, причем не более, чем на год.
Не менее обнадеживающие результаты получены при нейтронозахватной терапии рака печени, которую для облучения временно изымают из тела пациента. Сегодня рассматривается возможность использовать новый метод для лечения рака полости рта и щитовидной железы, а также ревматоидного артрита – очень тяжелого и пока неизлечимого неонкологического аутоиммунного заболевания.
Конкурс на роль мишени
Атомный реактор – не самый удобный инструмент для отработки медицинской методики, тем более для клинического использования в условиях онкологического стационара. Нужны более дешевые и компактные нейтронные источники.
В 1994 г. состоялся первый международный семинар по «ускорительным» источникам нейтронов для БНЗТ, на котором было рассмотрено множество проектов и сформулированы требования к техническим характеристикам ускорителей. Однако при практической реализации этих проектов специалисты столкнулись с рядом трудностей.

Дело в том, что облучение потоком тепловых нейтронов должно быть однократным, длительностью не более часа – такой режим терапии обусловлен высокой стоимостью препарата бора и особенностью кинетики его накопления во внутренних органах. Это означает, что поток нейтронов должен иметь достаточную плотность, а максимум их поглощения достигатся на той глубине, где расположена опухоль. Лучше всего этому соответствуют нейтроны с энергией от 0,5 эВ до 10 кэВ. При этом нужно сформировать поток нейтронов с предельно узким распределением по энергии, чтобы сопутствующие потоки медленных нейтронов, быстрых нейтронов, а также гамма-лучей не вносили значительного вклада в поглощенную пациентом дозу. Но получить такие «промежуточные», эпитепловые нейтроны оказалось непростой задачей.
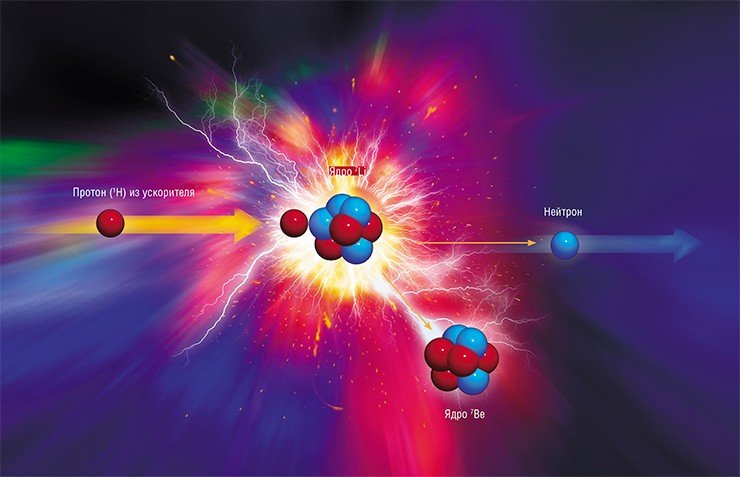
Наилучшим способом генерации эпитепловых нейтронов повсеместно считают бомбардирование протонами ядер лития: поток «выбиваемых» нейтронов при этом достаточно плотный, а их энергетический спектр сравнительно мягкий. Однако 10 лет назад полагали, что мишень из металлического лития практически невозможно реализовать в силу его мягкости, низкой температуры плавления, слабой теплопроводности и высокой химической активности. Альтернативными вариантами являются бериллий-9 и углерод-13. Изготовить мишени из них проще, но пучки заряженных частиц для их бомбардировки должны быть намного мощнее.

В конце 1990-х гг. вопросами реализации методики БНЗТ заинтересовались в новосибирском Институте ядерной физики СО РАН. В то время потенциально пригодные для этого ускорители обеспечивали токи пучков заряженных частиц лишь в единицы миллиампер. При использовании же литиевой мишени требовалось не менее 10 мА, а для других мишеней – свыше 30 мА. И новосибирские физики решили идти непроторенным путем.
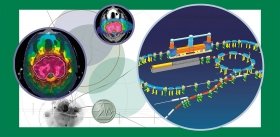
VITAльный ускоритель
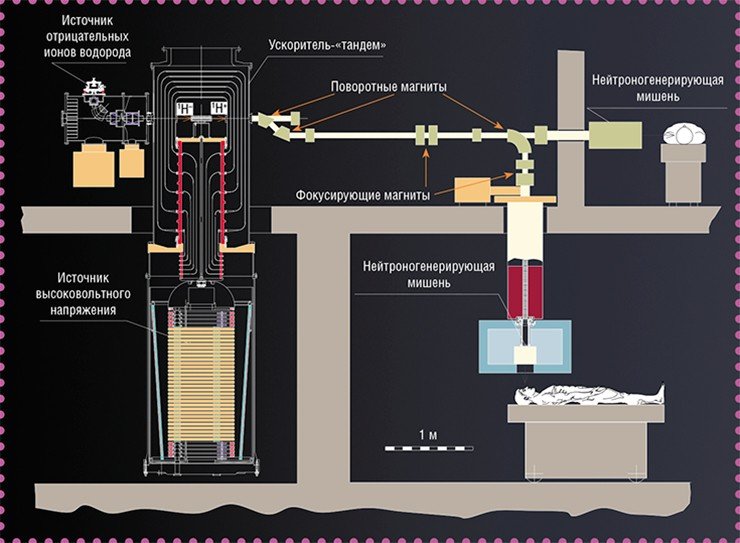
В институте родился замысел создать новый тип ускорителя. В обычных ускорителях заряженные частицы накачивают энергией в ускорительной трубке. Она представляет собой ряд металлических колец – электродов, на которые подается последовательно возрастающий потенциал. Электроды изолируют друг от друга кольцами из диэлектрика, но при усилении тока на них попадают вторичные частицы и ультрафиолет от прохождения пучка в остаточном газе. Результат – пробои по изолятору, что снижает энергетическую эффективность и стабильность устройства.
 Основная идея состояла в том, чтобы максимально удалить изолятор от пучка частиц. Создатели нового ускорителя решили отказаться от стандартной ускорительной трубки, предположив, что нетрадиционная конструкция позволит получить больший ток. Образно новый ускоритель можно представить в виде кочана капусты, где на «кочерыжке» – изоляторе в вакууме висят «листы» – электроды, а пучок частиц идет через центр «кочана» под углом 90° к «кочерыжке». Здесь электроды не разделены изоляторами, следовательно, их можно расположить ближе друг к другу, что обеспечивает больший темп ускорения частиц.
Основная идея состояла в том, чтобы максимально удалить изолятор от пучка частиц. Создатели нового ускорителя решили отказаться от стандартной ускорительной трубки, предположив, что нетрадиционная конструкция позволит получить больший ток. Образно новый ускоритель можно представить в виде кочана капусты, где на «кочерыжке» – изоляторе в вакууме висят «листы» – электроды, а пучок частиц идет через центр «кочана» под углом 90° к «кочерыжке». Здесь электроды не разделены изоляторами, следовательно, их можно расположить ближе друг к другу, что обеспечивает больший темп ускорения частиц.
Платой за новаторскую схему ускорителя стали электроды большого размера и, как следствие, большая запасенная энергия между ними, – а это означало, что неизбежные пробои могли невосполнимо портить поверхность электродов. Хотя в то время точных данных на этот счет не было, жизнеспособность схемы была под вопросом. К счастью, опасения оказались напрасными, и уже в первых экспериментах на реальном устройстве, сконструированном в лаборатории к 2007 г., удалось получить протонный пучок с рекордным током в 3 мА.
В том же году Министерство образования и науки признало новый ускоритель очередной (третьей) уникальной установкой ИЯФа. Возможно, присвоенное устройству название, – ускоритель-тандем с «вакуумной изоляцией» – оказалось и не совсем точным, но это сполна компенсировал рекламный потенциал его английской аббревиатуры VITA (Vacuum Insulation Tandem Accelerator).
Нестандартная мишень
Следующим неординарным решением явилось использование для производства мишени все того же «неподходящего» лития. Разработчикам нового ускорителя удалось успешно разрешить две главные проблемы, которые прежде делали этот элемент непригодным для изготовления мишени.
Одна из проблем связана с тем, что воздействие мощного протонного пучка приводит к разогреву облучаемого материала. Температура плавления металлического лития составляет всего 182 °С – а значит, чтобы его использовать, требуется очень эффективный теплосъем. Первоначально для охлаждения мишени использовали жидкий галлий, но впоследствии ограничились обычной водой. В результате удалось подобрать условия, позволявшие сохранять литий в твердом состоянии при нагреве мишени протонным пучком мощностью до 0,5 кВт/см2. Благодаря этому оказалось возможным существенно ограничить распространение радиоактивного изотопа бериллия-7, неизбежно образующегося вместе с нейтронами.
Еще одной ахиллесовой пятой литиевой мишени было сопутствующее паразитное гамма-излучение, возникавшее при торможении протонного пучка. Эффективная генерация эпитепловых нейтронов происходит в очень узком поверхностном слое лития (единицы микрон); как только энергия протонов становится ниже 1,882 МэВ, нейтроны перестают генерироваться, хотя гамма-кванты по-прежнему излучаются.
Однако безвыходных ситуаций не бывает. Оказалось, уровень гамма-радиации можно существенно уменьшить, если сделать так, чтобы дальнейшее торможение протонов происходило не в литии, а в более тяжелом металле. Для этого с помощью современных технологий тончайший (5—100 мкм) слой металлического лития наносят на подложку.
Впрочем, это решение породило новую проблему, связанную с радиационным повреждением подложки мишени. Протоны, «проскочившие» литиевый слой, при торможении почти не рассеиваются и поэтому застревают в подложке практически на одной глубине. С течением времени они накапливаются там в виде водорода. Давление газа растет, и вскоре поверхность мишени начинает вспучиваться. Хотя этот процесс неизбежен, в ходе экспериментов исследователям удалось подобрать максимально устойчивый материал подложки. Такая мишень уже вполне жизнеспособна – при клиническом использовании ее будет достаточно менять раз в неделю.

Но и это еще не все. Генерация нейтронов неизбежно сопровождается накоплением внутри литиевого слоя радиоактивного бериллия-7, период полураспада которого составляет 53 дня. Поэтому для временного хранения и дезактивации радиоактивной мишени пришлось сконструировать специальный защитный заглубленный контейнер. Это позволило беспрепятственно вести длительные эксперименты.
В итоге исследователи устранили все недостатки, присущие литиевой мишени, и осуществили в 2008 г. первую генерацию нейтронов.
На сегодня исследователям удалось решить все физические проблемы, мешавшие создать компактный ускорительный источник для нейтронозахватной терапии рака. Таким образом, менее чем за десять лет специалисты ИЯФ СО РАН разработали и создали действующий образец установки – компактный и относительно недорогой источник нейтронов, предназначенный специально для размещения в онкологических центрах.
Между тем сама методика БНЗТ еще не годится для широкого клинического использования – она требует дальнейших, теперь уже совместных исследований физиков и медиков, биологов и химиков. Сейчас на установке работает команда молодых ученых, аспирантов и студентов, которых поддерживают специалисты из ряда новосибирских научно-исследовательских и учебных учреждений. В прошлом году были проведены первые биологические эксперименты, при этом непрерывная генерация нейтронов поддерживалась в течение нескольких часов.
Пока новосибирская установка для БНЗТ остается самой совершенной в мире. Наши ученые находятся ближе всех к цели и по срокам: теоретически проект можно довести до завершения за 2—3 года. Много это или мало? Это как посмотреть: глазами ученого, ведущего исследования, чиновника, от которого зависит дальнейшая судьба проекта, или пациента, для которого новый метод лечения является, возможно, последней надеждой.
И все-таки быстрее завершить проект – внедрить ускоритель в клиническую практику – в интересах всех участвующих сторон, включая государство, которое перестанет терять ежегодно большое число граждан и получит шанс занять лидирующие позиции в этой жизненно важной области. Что можно сделать, чтобы ускорить процесс? Во всем мире, в частности в Японии, где также строится подобный центр, разработку и внедрение высокотехнологичных методов лечения финансирует государство. Для новой установки, созданной сибирскими учеными, государственная инвестиционная поддержка сейчас – это в буквальном смысле вопрос жизни. Как и для тысяч больных.
Литература
Locher G. Biological Effects and Therapeutic Possibilities of Neutrons // Am. J. Roentgenol. Radium Ther. 1936. V. 36. P. 1—13.