Волшебные картины микрокосма
Электронная микроскопия дает ученым возможность заглянуть внутрь клетки, которую можно представить в виде Вселенной в миниатюре. И наши познания о ней также не имеют конца, как и познания о Космосе. Тем сильнее наше стремление заглянуть глубже и познать больше. С помощью современных оптических микроскопов ученые могут видеть только такие крупные компоненты клетки, как митохондрии и ядро. Но когда на помощь приходит сканирующая электронная и атомно-силовая микроскопия, то пытливому глазу исследователя становятся доступны объекты размером в несколько нанометров...
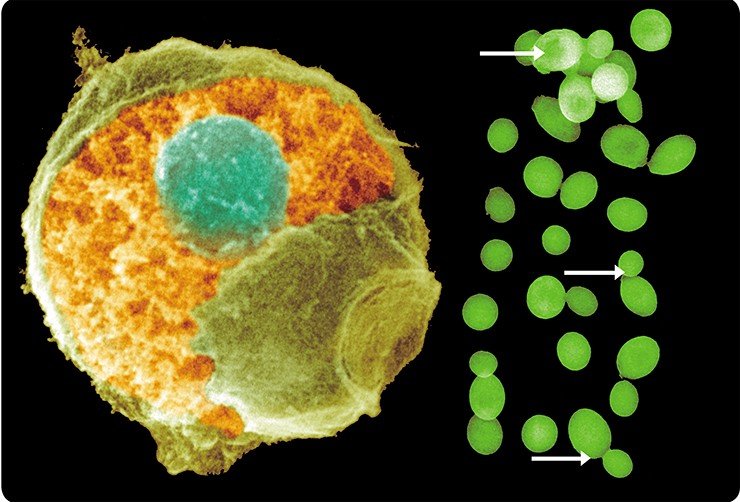
В настоящее время электронная микроскопия (ЭМ) нашла широкое применение в микробиологии, вирусологии, биохимии, онкологии, медицинской генетике и иммунологии. Благодаря ЭМ раскрыта субмикроскопическая структура клеток, открыт ряд неизвестных ранее клеточных органелл, таких как лизосомы, рибосомы, эндоплазматический ретикулум, микротрубочки, цитоскелет и прочие структуры, специфичные для разных видов клеток. Электронная микроскопия позволила понять многие тонкие механизмы развития болезней, в том числе на ранних этапах их возникновения, еще до появления четкой клинической симптоматики.

К сожалению, просвечивающая электронная микроскопия ограничена в своих возможностях по исследованию и диагностике поверхности клеточных структур, и лет пятнадцать назад вопрос о том, как заглянуть внутрь ядра и получить трехмерное изображение внутриядерных и околоядерных структур, был неразрешим. Дело в том, что тонкие срезы ткани, которые изучаются под микроскопами, являются двумерными срезами и не позволяют судить о трехмерной структуре клеточных компонентов. Трехмерное изображение можно получить после реконструкции сотен серийных срезов, но это длительный и трудоемкий процесс.
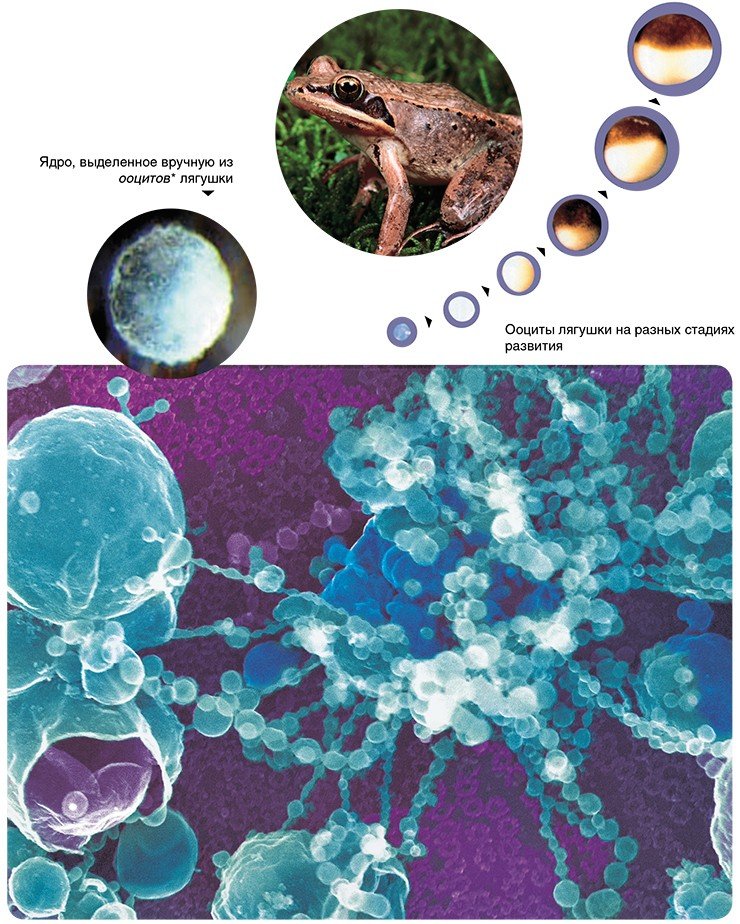
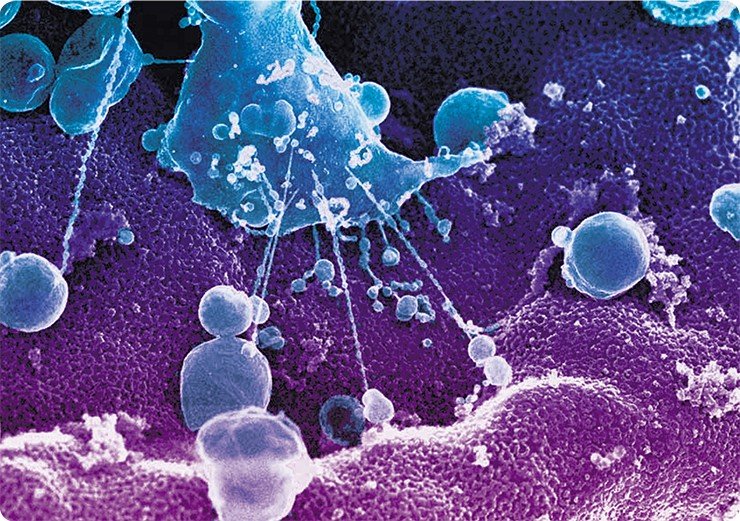
В настоящее время разработаны более прямые методы получения трехмерного изображения. Один из них состоит в изучении образца в сканирующем электронном микроскопе (СЭМ), который обычно меньше и проще, чем просвечивающий электронный микроскоп.
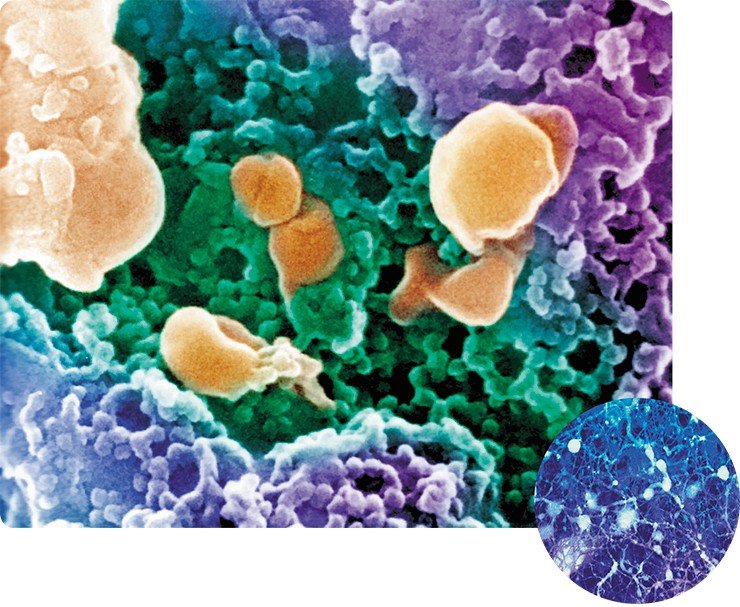
Для получения изображения в просвечивающем электронном микроскопе используют электроны, проходящие через образец, а в сканирующем электронном микроскопе регистрируются электроны, рассеиваемые или излучаемые поверхностью образца. Для изучения в СЭМ образец должен быть зафиксирован, высушен и покрыт тонкой пленкой тяжелого металла. Затем образец сканируется узким пучком электронов. Отраженные и рассеянные при облучении образца электроны попадают в детектор, анализирующий полученную информацию, которая затем преобразуется в увеличенное изображение на экране.
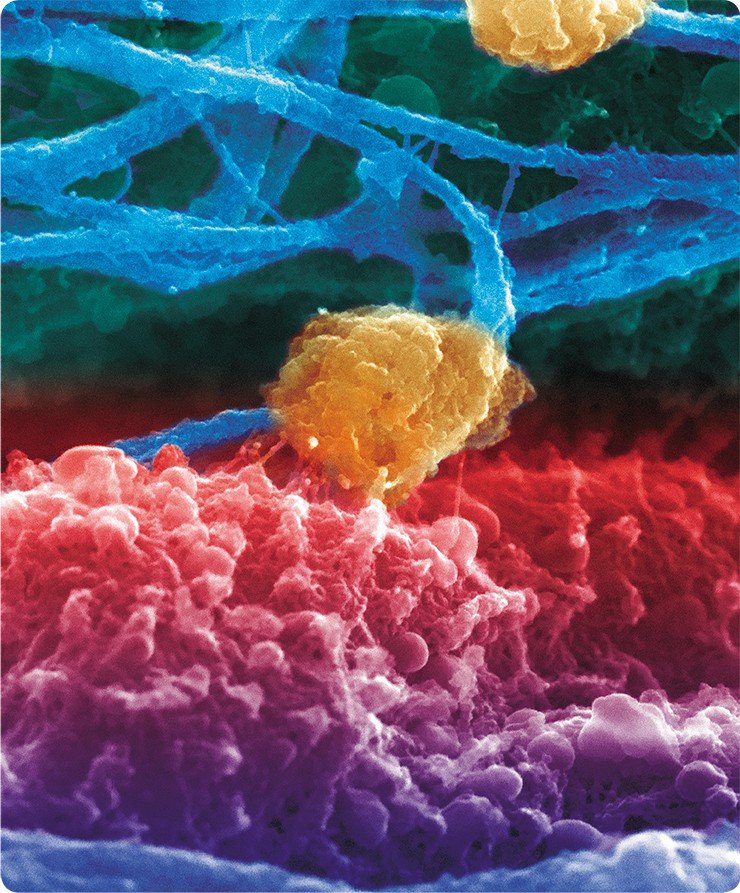
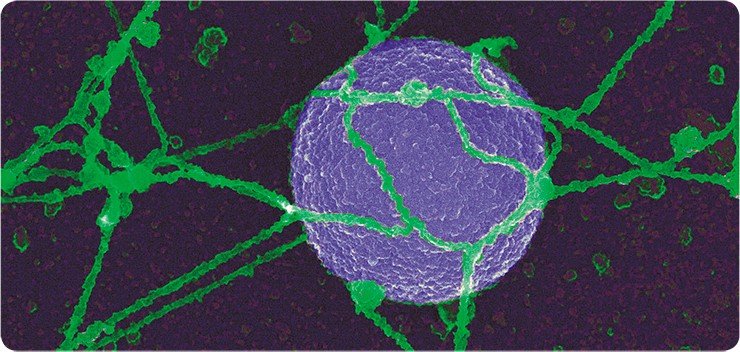
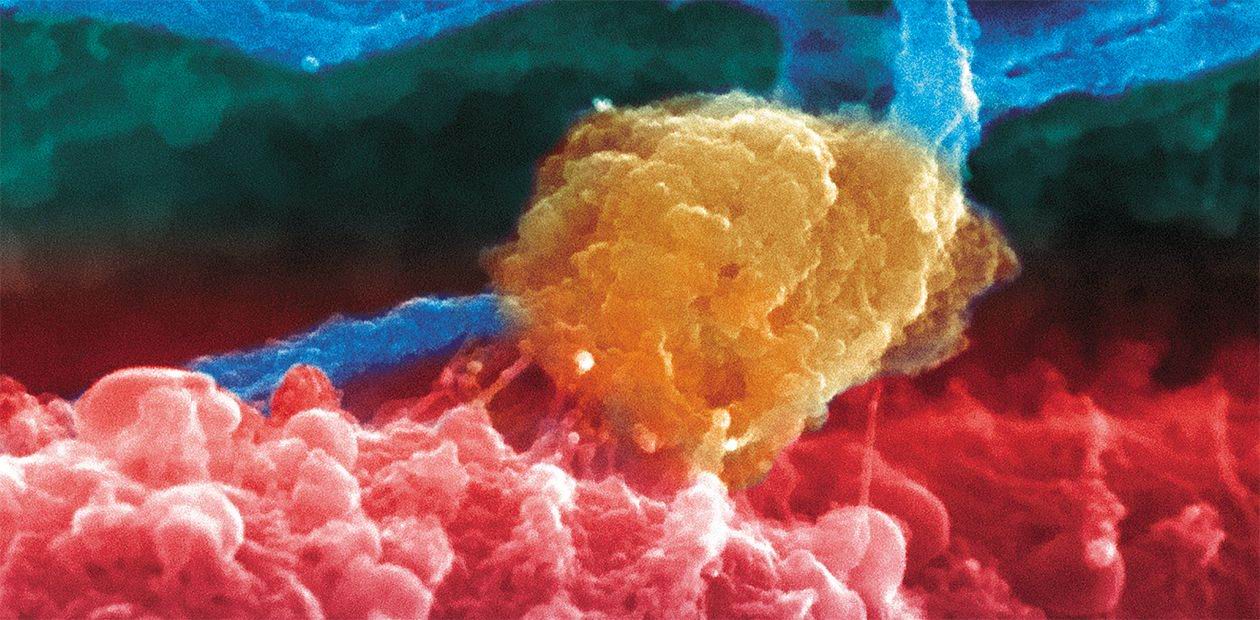
Метод сканирующей электронной микроскопии обеспечивает значительную глубину фокусировки. Более того, поскольку масштабы рассеивания электронов определяются углом поверхности по отношению к сканирующему лучу, то на изображении возникают чередующиеся светлые и темные участки, создающие впечатление трехмерности. А с появлением высокоразрешающего сканирующего автоэмиссионного электронного микроскопа (Field Emission in Lenz, фирмы Hitachi) ученым удалось получить уникальные трехмерные снимки цитоплазматической и внутриядерной поверхности ядерной оболочки, изучить тонкое строение ядерных поровых комплексов и заглянуть внутрь ядра.
В России первый подобный сканирующий микроскоп был приобретен в апреле 2008 г. Институтом биомедицинской химии РАН (Москва). К сожалению, институты Сибирского отделения РАН такого микроскопа для биологических исследований пока не имеют, несмотря на то что в группе Е. В. Киселевой разработаны методы для изучения биологических образцов в SEM, позволившие получить большое количество новых уникальных данных о строении и динамике структур наноразмеров, таких как ядерные поры (диаметр 100 нм), филаменты внутриядерного матрикса (диаметр 12 нм) и др.
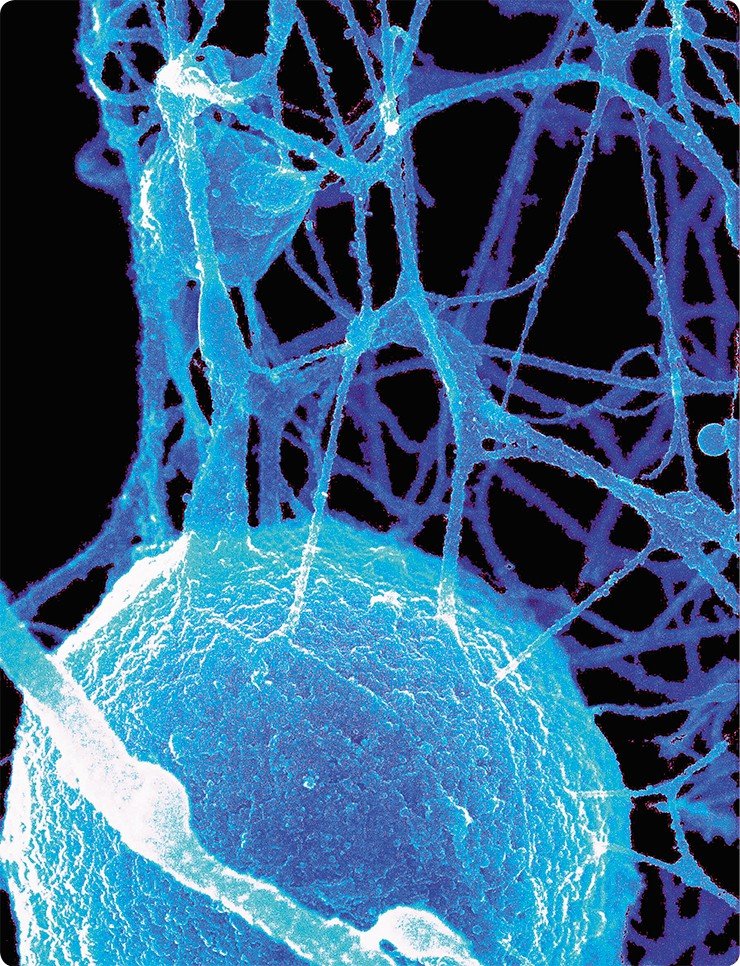
Можно надеяться, что подобный микроскоп появится вскоре и в центре коллективного пользования Института цитологии и генетики СО РАН, что обеспечит дальнейший прогресс в изучении организации различных компонентов клеточного микрокосмоса.
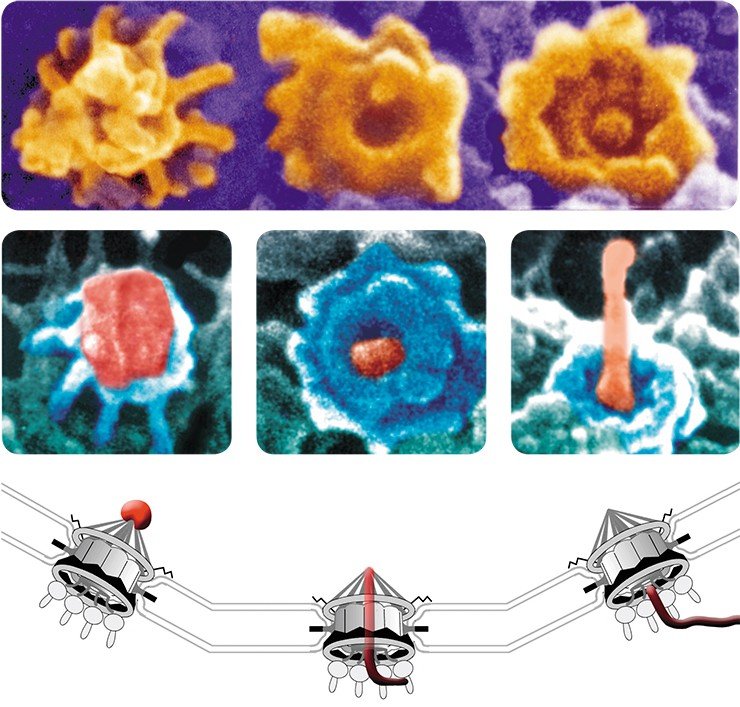
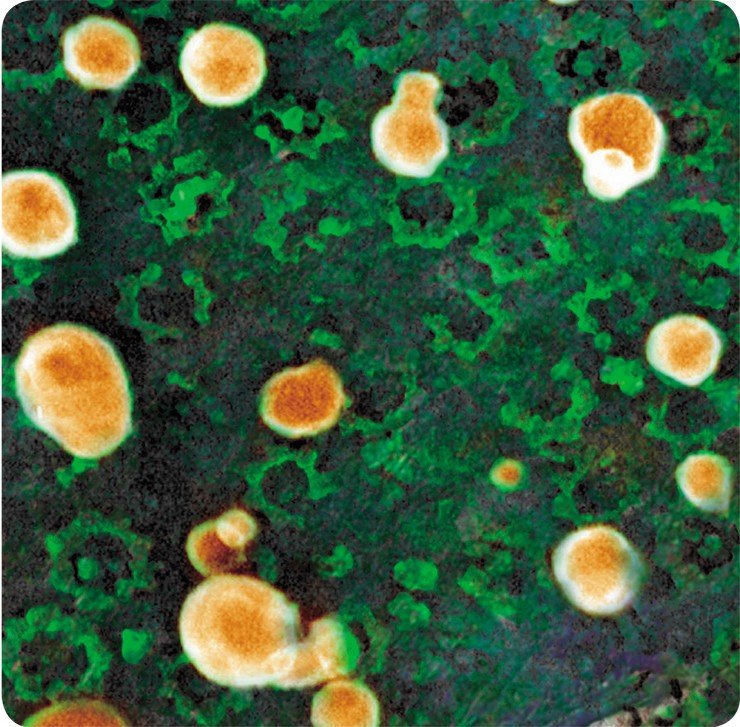
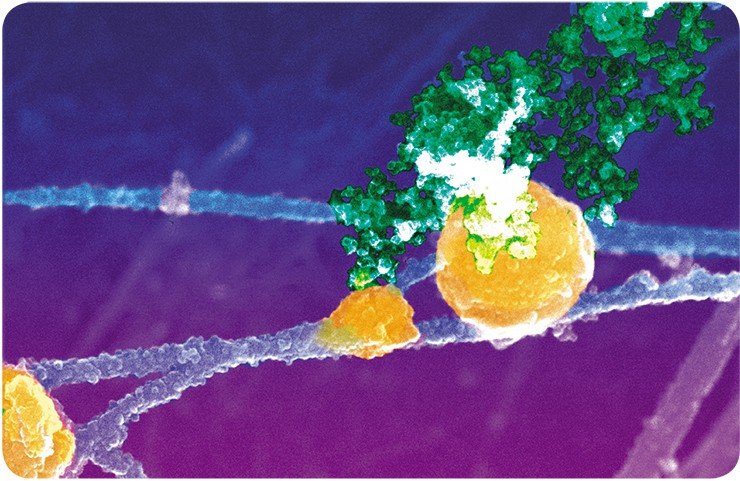
Все демонстрируемые снимки получены с использованием высокоразрешающего сканирующего электронного микроскопа, который использовался во время кратковременных командировок ведущего научного сотрудника Е. В. Киселевой в Институт раковых исследований им. Паттерсона, в г. Манчестер Англия. Полученные на этом микроскопе снимки внутриклеточных структур по темам совместных исследований с английскими учеными опубликованы на обложках и разворотах таких журналов, как Nature Cell Biol., Nature Review Mol. Cell Biol., J. Cell Sci., J. Mol. Biol.
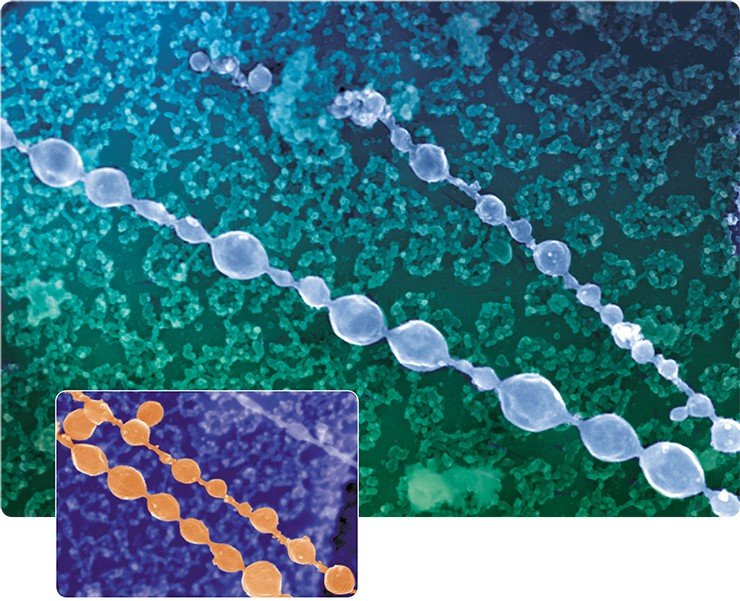
И у наших читателей сейчас появилась уникальная возможность заглянуть в волшебный мир клетки.
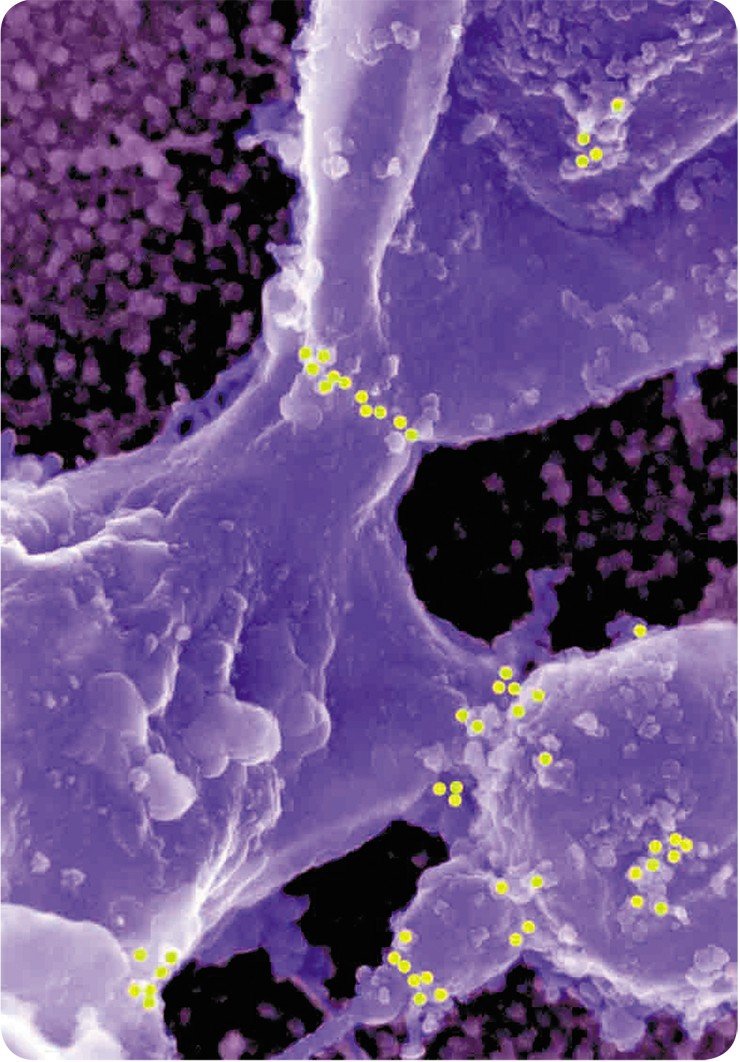
Все исследования, проведенные Е. В. Киселевой, выполнены при поддержке гранта РФФИ (07-04-00416) и Английского фонда Wellcome Trust