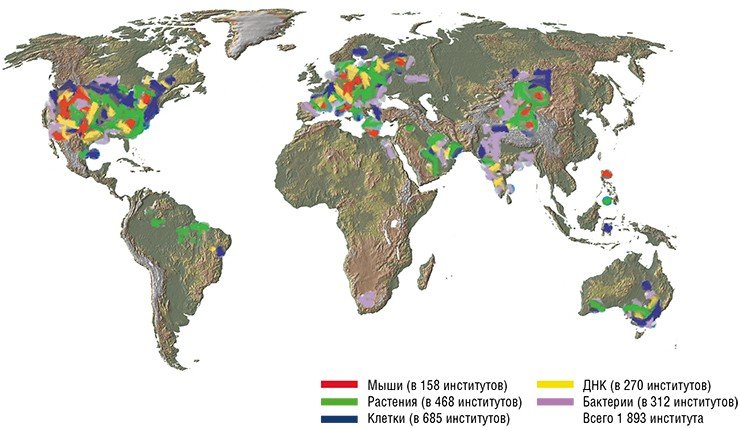
Постгеномная эра или Зачем нужны 300 тысяч линий мышей
Нет нужды доказывать, что вопрос о том, как работает живой организм, актуален для каждого из нас. Проблема заключается лишь в выборе адекватного «инструмента» познания. Как правило, процесс исследования любой биологической системы, будь то клетка, особь или биогеоценоз, начинается с «морфологического», структурного описания. Однако несмотря на необходимость этого этапа, его одного недостаточно, чтобы постичь механизмы функционирования изучаемой системы. Замечательной иллюстрацией того, насколько ошибочными могут быть умозрительные построения, опирающиеся исключительно на описание структур, являются представления античных ученых о функции головного мозга. Этому «материальному субстрату» высшей нервной деятельности Аристотель, как и его коллеги, отводили роль хранилища воды и слизи для охлаждения крови, а также спермы, поступающей из мозга по венам вокруг ушей. Современные методологические основы изучения функций были заложены еще в XVII в. английским врачом В. Гарвеем, который одним из первых начал сознательно манипулировать структурами организма с целью понять их предназначение. И сегодня, спустя столетия, этот подход не утратил своей актуальности: направленные воздействия на живые системы остаются основным подходом к экспериментальному изучению механизмов их функционирования. Изменился лишь масштаб: в наше время объектами манипуляций все чаще становятся как крупные экосистемные образования (например, элементы ландшафтов), так и мелкие структуры живых организмов (клетки, клеточные органеллы и органические молекулы)...
 Сравнительно недавно произошло поистине эпохальное событие, которое задало вектор научных исследований на многие десятилетия вперед: в 2001 г. две конкурирующие научные команды (Международная организация по изучению генома человека – HUGO и Celera Genomics) объявили о первых расшифровках генома человека. Составление полного списка нуклеотидных последовательностей ДНК человека (а заодно и некоторых наиболее изученных видов животных) можно смело отнести к одному из самых грандиозных описаний.
Сравнительно недавно произошло поистине эпохальное событие, которое задало вектор научных исследований на многие десятилетия вперед: в 2001 г. две конкурирующие научные команды (Международная организация по изучению генома человека – HUGO и Celera Genomics) объявили о первых расшифровках генома человека. Составление полного списка нуклеотидных последовательностей ДНК человека (а заодно и некоторых наиболее изученных видов животных) можно смело отнести к одному из самых грандиозных описаний.
Однако, сам факт расшифровки «генетического» текста (т. е. определение порядка расположения нуклеотидов в геноме) не предполагает его «понимания». На ум приходят такие классические книги, как Библия, которые читаются, перечитываются и переистолковываются многократно. В случае же «генетического» текста ситуация усложняется тем, что сам процесс «считывания» информации происходит в несколько этапов, на каждом из которых возможна корректировка и перекодирование. В итоге элементарное событие на уровне генотипа, начинающееся с транскрипции конкретного гена, на уровне фенотипа приобретает достаточную неопределенность.
1. Моделирование патологий (model of diseases).
2. Молекулярно-генетическая физиология (functional genomic).
3. Испытание средств профилактики и лечения (preclinical studies)
Чтобы разобраться во всех этих хитросплетениях, неизмеримо более сложных, чем даже взаимодействия между органами, тканями и клетками, ученые вновь вынуждены прибегать к манипуляциям структурами. Однако, в отличие от «постгарвеевского» времени, в «постгеномную» эру в распоряжении исследователей находятся уже не десятки видимых глазом структурных образований, но около 25 тысяч (!) микрообъектов – генов. Ведь именно таковы размеры геномов человека и многих видов млекопитающих, используемых современной наукой в качестве экспериментальных моделей.
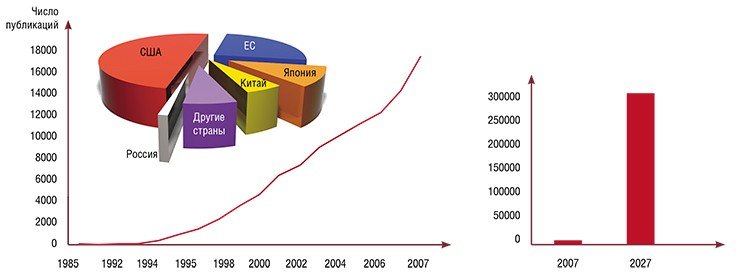
Возможность целенаправленного генно-инженерного манипулирования резко увеличила темпы накопления знаний о роли отдельных генов и их комбинаций в реализации программ индивидуального развития, в реакциях организма на различные факторы среды, а также в понимании патологических процессов, имеющих генетическую природу. Так, простой наукометрический анализ, заключающийся в запросе на сайте PubMed научных статей, в которых упомянуто словосочетание «трансгенные мыши», дает более 90 тыс. ссылок (и это при том, что впервые такие мыши были получены всего лишь 20 лет назад)! Сегодня рост числа статей в этой области биологии идет со скоростью, превышающей тысячу публикаций в месяц.
Мышиная троица
 Но почему, собственно, мы завели речь о … мышах? Не секрет, что львиная доля научных исследований ориентирована на обеспечение здоровой и продолжительной жизни людей. Но среди всего многообразия экспериментальных объектов, именно мыши попадают в точку оптимума при учете двух главных факторов – генетической близости к человеку и доступности для исследования. Бактерии, дрозофилы и другие беспозвоночные, безусловно, наиболее удобны для содержания в лабораторных условиях, но по многим характеристикам, в том числе генетическим, слишком далеки от человека. Обезьяны и свиньи, напротив, наиболее генетически близки к нам, однако содержание и изучение подобных много килограммовых объектов требует значительных материальных затрат. Кроме того, работа с крупными млекопитающими ограничена по этическим соображениям. Например, в Японии не хотят убивать обезьян, и хотя избыточная численность обезьян в некоторых районах приносит реальный экономический ущерб, японцы вкладывают немалые средства в разработку методов контрацепции диких животных.
Но почему, собственно, мы завели речь о … мышах? Не секрет, что львиная доля научных исследований ориентирована на обеспечение здоровой и продолжительной жизни людей. Но среди всего многообразия экспериментальных объектов, именно мыши попадают в точку оптимума при учете двух главных факторов – генетической близости к человеку и доступности для исследования. Бактерии, дрозофилы и другие беспозвоночные, безусловно, наиболее удобны для содержания в лабораторных условиях, но по многим характеристикам, в том числе генетическим, слишком далеки от человека. Обезьяны и свиньи, напротив, наиболее генетически близки к нам, однако содержание и изучение подобных много килограммовых объектов требует значительных материальных затрат. Кроме того, работа с крупными млекопитающими ограничена по этическим соображениям. Например, в Японии не хотят убивать обезьян, и хотя избыточная численность обезьян в некоторых районах приносит реальный экономический ущерб, японцы вкладывают немалые средства в разработку методов контрацепции диких животных.
Итак, в качестве наиболее приемлемого компромисса для исследователей остается мышь с заданными генетическими свойствами. Какие же возможности открываются при изучении подобных модельных объектов? Во-первых, мы можем приблизиться к пониманию роли и места генетических процессов в формировании фенотипа в широком смысле этого слова, т. е. в регуляции морфологического развития и в обеспечении физиологических и поведенческих функций. Одним из наиболее продуктивных подходов в этой области является строго адресованное «выключение» (нокаутирование) отдельных генов или, наоборот, усиление их функции.
Во-вторых, благодаря генно-инженерным методам, появилась возможность прямого наблюдения за морфофункциональными процессами, происходящими в организме. И, наконец, уже созданы трансгенные мыши, которые могут стать реальными звеньями в биотехнологических цепочках, связанных с производством лекарственных препаратов. Иными словами, трансгенная мышь сегодня выступает сразу в трех ипостасях: она может быть и объектом исследования, и его инструментом, и производственной мощностью в биотехнологическом цикле.
Ген в нокауте
Сегодня редкая зарубежная статья, посвященная механизмам функционирования организмов, обходится без использования нокаутных животных. Значимость этого подхода отмечена Нобелевской премией 2007 г. в области физиологии и медицины, которую разделили М. Капекки (США), О. Смитис и сэр М. Эванс (Великобритания). Премия была присуждена за «Открытие принципов введения специфических генных модификаций в организм мышей посредством эмбриональных стволовых клеток», т. е. за изобретение метода нокаута (gene knockout) отдельных генов.
 С помощью этого метода удалось показать, что выключение гена может отражаться не только на «целевых признаках», контролируемых этим геном, но и на многих других характеристиках организма. Это хорошо известное классическим генетикам так называемое плейотропное действие генов. Однако масштабы плейотропии, которые наблюдаются при изучении нокаутных генотипов, часто превосходят самые смелые ожидания. Нужно заметить, что при этом наши современники нередко попадают в ситуацию, подобную аристотелевской в отношении роли мозга. Однако в отличие от античных ученых они довольно быстро находят правильные решения, поскольку следуют экспериментальным принципам Гарвея, даже если и не отдают себе в этом отчета.
С помощью этого метода удалось показать, что выключение гена может отражаться не только на «целевых признаках», контролируемых этим геном, но и на многих других характеристиках организма. Это хорошо известное классическим генетикам так называемое плейотропное действие генов. Однако масштабы плейотропии, которые наблюдаются при изучении нокаутных генотипов, часто превосходят самые смелые ожидания. Нужно заметить, что при этом наши современники нередко попадают в ситуацию, подобную аристотелевской в отношении роли мозга. Однако в отличие от античных ученых они довольно быстро находят правильные решения, поскольку следуют экспериментальным принципам Гарвея, даже если и не отдают себе в этом отчета.
В качестве примера можно привести курьезный случай, произошедший в одной из лабораторий Женевского университета при изучении молекулярно-генетических механизмов работы биологических часов. Внимание профессора У. Шиблера и его коллег привлекло семейство белков PAR bZip, объединяющее три транскрипционных фактора, чья экспрессия меняется в строгом соответствии с суточным ритмом. Для выяснения их роли в работе биочасов исследователи использовали мышей с нокаутом соответствующих генов, по одному и в комбинации. И здесь они столкнулись с неожиданным явлением: суточный ритм не только не исчез, но дополнился отчетливым недельным циклом. В кулуарах уже стали обсуждать глубокий биологический смысл библейской недели, но все разрешилось самым прозаическим образом.
1) объект исследования;
2) инструмент исследования;
3) звено в биотехнологическом производстве
Появившийся у нокаутных мышей недельный ритм проявлялся главным образом в массовой гибели животных по понедельникам и четвергам. Выяснилось, что согласно графику уборки помещений в эти дни в виварии работали пылесосы, шум которых вызывал у животных эпилептические припадки. Специальное исследование показало, что выключение транскрипционных факторов попутно приводило к резкому росту возбудимости мышей, обусловленному дефицитом фермента, катализирующего превращение витамина В6 – кофактора ферментов, участвующих в поддержании баланса важнейших нейромедиаторов. Содержательная часть этой работы была опубликована в журнале Genes & Development (2004), а анекдотическая распространяется как устное предание.
Другая важная истина, открывшаяся при изучении нокаутных животных, заключается в том, что мы недооцениваем компенсаторные возможности организмов. Некоторые исследователи были разочарованы, не увидев ожидаемых фенотипических проявлений, которые, согласно начальным представлениям, были «обязаны» иметь место при выключении того или иного гена. Это явление обусловлено тем, что перманентный дефицит продуктов экспрессии конкретного гена может компенсироваться в ходе онтогенетического развития за счет других систем организма. Таким образом, на примере каждой нокаутной линии мы, по сути, исследуем не только роль определенного гена, но и работу компенсаторных механизмов, что само по себе интересно и важно.
Тетрациклиновый выключатель
Для решения ряда задач исследователям нужно не просто выключить тот или иной ген, но добиться изменения его экспрессии в строго определенное время. В этой публикации намеренно не приведены результаты замечательных работ по использованию технологий подавления экспрессии генов путем введения так называемых антисмысловых или малых интерфирирующих РНК (small interference RNA – siRNA) – это отдельная важная тема. Основное внимание будет уделено трансгенным животным, имеющих благодаря искусству генных инженеров наследственно закрепленные свойства, благодаря которым можно управлять активностью конкретных генов с помощью достаточно простых фармацевтических средств.
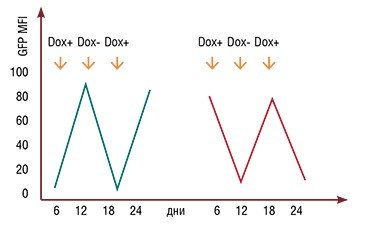 Один из подходов к управлению экспрессией генов основывается на создании так называемых генетических конструктов, в которых экспрессию гена контролирует промотор (участок ДНК перед самим геном), который запускается определенным лекарственным препаратом (drug-inducible systems (DIS) – генные системы, индуцируемые лекарством). Одна из первых систем такого рода основана на использовании тетрациклина (Tet) или его производного доксициклина. Генно-инженерные конструкции, регулируемые этими веществами, получили названия Tet-off или Tet-on, в зависимости от того, подавляется ли экспрессия гена удалением (off) или добавлением (on) антибиотика.
Один из подходов к управлению экспрессией генов основывается на создании так называемых генетических конструктов, в которых экспрессию гена контролирует промотор (участок ДНК перед самим геном), который запускается определенным лекарственным препаратом (drug-inducible systems (DIS) – генные системы, индуцируемые лекарством). Одна из первых систем такого рода основана на использовании тетрациклина (Tet) или его производного доксициклина. Генно-инженерные конструкции, регулируемые этими веществами, получили названия Tet-off или Tet-on, в зависимости от того, подавляется ли экспрессия гена удалением (off) или добавлением (on) антибиотика.
Работу подобных систем наглядно иллюстрирует генно-инженерная конструкция, в которой Tet-off или Tet-on системы регулируют экспрессию гена зеленого флюоресцирующего белка (green fluorescence protein – GFP), также внедренного в мышиный геном. В результате трансгенные зародыши, несущие подобные конструкции и пересаженные на ранней стадии развития самкам дикого типа, могут менять свою окраску в зависимости от поступления в их клетки доксоциклина, который добавляется в питьевую воду матерям, их вынашивающих (Szulc et al., 2006). Контролируемая экспрессия GFP сохраняется и во взрослом состоянии, о чем свидетельствует флюоресценция фибробластов, выделенных из ушных раковин взрослых трансгенных особей. Также экспериментально доказано, что подобные трансгенные конструкции, управляющие экспрессией GFP, передаются по наследству.
Но существуют еще более интересные приложения Tet-off/Tet-on систем. Оказывается, под управляемый доксициклином промотор можно поставить небольшой (40—50 оснований) палиндром, частично комплементарный к участку гена, интересующего исследователей. При экспрессии подобной конструкции будут нарабатываться так называемые шпилечные РНК (small hairpin RNA — shRNA), которые связываются с соответствующими комплементарными последовательностями синтезированной на гене матричной РНК, что приводит к разрушению последней и ингибированию синтеза белка (Szulc et al., 2006).
Таким образом, к настоящему времени созданы предпосылки для получения таких генно-инженерных систем, которые позволяют запускать или подавлять экспрессию нужного гена у лабораторной мыши в любой заданный момент времени простым введением антибиотика. К этому можно добавить, что имеются и другие трансгенные конструкции, обеспечивающие подавление экспрессии целевого гена или генов в нужном месте (тканеспецифическое управление работой генов).
Лучше один раз увидеть…
Упомянутый выше ген GFP используется не только для демонстрации работоспособности Tet-off/Tet-on-конструкций. Например, клетки, полученные от животных с постоянной экспрессией этого гена, можно наблюдать при их введении в организм, у которого этого гена нет.
 Ярким примером подобного использования служат работы, посвященные изучению миграции плодовых клеток в материнском организме. Дело в том, что клинические исследования показали, что в тканях женщин можно обнаружить «мужские» клетки, несущие Y-хромосому (Bianchi et al., 1996). Единственный, не мистический путь появления подобных клеток в женском организме – их миграция через плацентарный барьер при вынашивании мальчика. Такой микрохимеризм послужил основой для дискуссии о патогенетической роли плодовых клеток, поскольку последние с большей вероятностью обнаруживаются у женщин, страдающих аутоиммунными заболеваниями (Johnson, Bianchi, 2004). Но чтобы ответить на вопрос, являются ли иммунологически чужеродные клетки причиной болезни или они лишь накапливаются в поврежденных тканях, необходимы детальные исследования перемещения этих клеток в материнском организме как в норме, так и при экспериментальных повреждениях.
Ярким примером подобного использования служат работы, посвященные изучению миграции плодовых клеток в материнском организме. Дело в том, что клинические исследования показали, что в тканях женщин можно обнаружить «мужские» клетки, несущие Y-хромосому (Bianchi et al., 1996). Единственный, не мистический путь появления подобных клеток в женском организме – их миграция через плацентарный барьер при вынашивании мальчика. Такой микрохимеризм послужил основой для дискуссии о патогенетической роли плодовых клеток, поскольку последние с большей вероятностью обнаруживаются у женщин, страдающих аутоиммунными заболеваниями (Johnson, Bianchi, 2004). Но чтобы ответить на вопрос, являются ли иммунологически чужеродные клетки причиной болезни или они лишь накапливаются в поврежденных тканях, необходимы детальные исследования перемещения этих клеток в материнском организме как в норме, так и при экспериментальных повреждениях.
Сделать это непросто, поскольку таких клеток немного, а Y-хромосома является хотя и надежным, но не слишком заметным маркером. Существенно облегчить решение сложной задачи могут все те же «зеленые» трансгенные мыши, производящие GFP. Для этого нужно лишь скрестить «зеленых» самцов с обычными самками, а затем проследить пути миграций GFP-экспрессирующих клеток в материнском организме.
С использованием этого подхода было, в частности, обнаружено наличие некоторого числа мужских клеток в тканях мозга самок, причем чаще всего они встречались в отделах, подвергнутых экспериментальному повреждению (Xiao-Wei Tan et al., 2005). Клетки плода были обнаружены в материнском организме спустя месяц после родов, причем некоторые из них дифференцировались в нейроны. Это позволяет предположить участие эмбриональных стволовых клеток в восстановлении поврежденных отделов материнского мозга. (Подобные научные сведения могут быть с пользой применены нашими политиками, агитирующими российских женщин рожать больше и чаще).
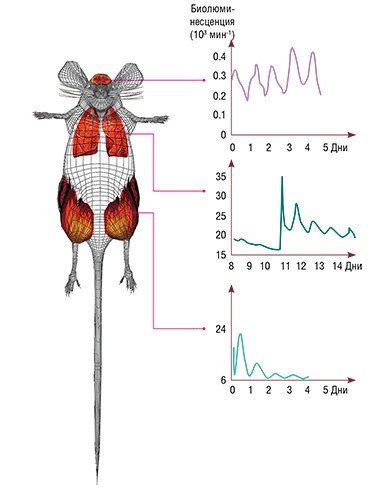
Применение трансгенных конструкций не ограничивается визуализацией движения клеток: оно также позволяет проводить прямую регистрацию экспрессии любых интересующих исследователя генов. В качестве примера можно привести работы из области регуляции циклических процессов, протекающих с суточным или околосуточным (циркадным) периодом в живых организмах. Еще в 1970-е гг. экспериментами на изолированных органах и тканях многоклеточных организмов доказано, что многие из последних обладают способностью к самостоятельной генерации суточных ритмов. Но как работают эти задающие ритм механизмы в рамках целого организма или, как это бывает в иерархически организованных колебательных системах, основную роль водителей ритма выполняет центральный механизм, а все периферические компоненты меняют свою функциональную активность под влиянием команд из центра?
Показателем самостоятельности периферических водителей ритма может быть цикличность экспрессии известных к настоящему времени часовых генов. Для наблюдения за уровнем генной экспрессия были созданы трансгенные мыши, у которых промотор одного из часовых генов (Per1) запускал также экспрессию гена люцеферазы (фермента, катализирующего образование люминесцирующего продукта). При введении в организм субстрата для этого фермента с помощью оптического зонда можно было наблюдать активацию гена люцеферазы. Оказалось, что интенсивность свечения при этом в разных органах варьировала с околосуточным периодом, что доказывает самостоятельность работы периферических компонентов часового механизма.
Мышь-биореактор
Выше упоминалось, что трансгенных мышей можно также использовать в биотехнологических циклах, хотя на первый взгляд этот грызун как продуцент чего-либо полезного выглядит достаточно сомнительно. Но неоспоримым достоинством мыши является то, что она относится к наиболее освоенным объектам генной инженерии среди млекопитающих. Поэтому когда возникла идея получать человеческие антитела не от вакцинированных людей, а от других животных, ученые обратились именно к мышам. Были получены трансгенные животные, у которых мышиные гены, кодирующие легкие и тяжелые цепи иммуноглобулинов, были заменены на соответствующие гены человека (Jakobovits et al., 2007).
 Создание таких животных шло в несколько этапов. Сначала были получены линии мышиных эмбриональных стволовых клеток, у которых путем нокаута инактивированы гены собственных иммуноглобулинов, а также линии, в которые были внедрены гены иммуноглобулинов человека. На основе этих линий получены трансгенные мыши. При их скрещивании выделена линия XenoMouse, у которой мышиные иммуноглобулиновые гены полностью замещены соответствующими генами человека.
Создание таких животных шло в несколько этапов. Сначала были получены линии мышиных эмбриональных стволовых клеток, у которых путем нокаута инактивированы гены собственных иммуноглобулинов, а также линии, в которые были внедрены гены иммуноглобулинов человека. На основе этих линий получены трансгенные мыши. При их скрещивании выделена линия XenoMouse, у которой мышиные иммуноглобулиновые гены полностью замещены соответствующими генами человека.
Таким образом, появилась возможность использовать мышиную систему иммунного распознавания чужеродных антигенов для получения клонов B-лимфоцитов, вырабатывающих специфические иммуноглобулины человека. На их основе можно создавать гибридомы – клеточные линии, полученные путем слияния иммунных клеток с опухолевыми, которые производят моноклональные антитела по уже известной технологии.
Первыми такими иммуноглобулинами, прошедшими клинические испытания, стали антитела против интерлейкина-8, которые использовали для подавления иммунных процессов при обострении псориаза. Принципиально важным можно считать тот факт, что ни у одного из пациентов не было выявлено аллергической реакции на эти иммуноглобулины (Davis et al., 1999).
В настоящее время стадию предклинических и клинических испытаний проходят более десяти вариантов моноклональных антител, полученных с использованием трансгенных мышей линии XenoMouse. В основном это антитела против различных факторов роста или их рецепторов, применение которых позволяет ограничить рост злокачественных опухолей, и даже более – вызывать их обратное развитие (Jakobovits et al., 2007).
В перспективе – мышиное наводнение
Итак, расшифровка геномов человека и многих лабораторных животных, вкупе с развитием генно-инженерных технологий, открыли практически неограниченные возможности для создания живых «экспериментальных моделей». Уже сегодня общее число генетических линий и стоков мышей, содержащихся в мировых центрах «мышеводства», перевалило за 20 тысяч.
И число их продолжает стремительно увеличиваться. Достаточно сказать, что один только проект KOMP (Knockout Mouse Project – Проект «нокаутные мыши»), организованный по инициативе Национального института здоровья США, нацелен на создание линий мышиных эмбриональных стволовых клеток с нокаутами по каждому гену. Таким образом, по завершению этого проекта будет получено около 25 тысяч новых клеточных линий (Austin, et al., 2004)! И произойдет это достаточно скоро: один из участников проекта (Wellcome Trust Sanger Institute) информировал, что его производственные мощности позволяют получать 5 тысяч клеточных линий в год.
В проекте также предусмотрено финансирование работ по оптимизации технологии получения нокаутных мышей на основе вновь созданных линий эмбриональных стволовых клеток; по информационному обеспечению; по развитию систем хранения и распределения мышей с различным генотипом. Всего в проекте участвует 19 институтов и научно-исследовательских центров, работающих в разных областях биологии и биомедицины.
К вышесказанному следует добавить, что работы по созданию коллекций эмбриональных стволовых клеток мышей с нокаутами по разным генам сегодня ведутся в Европе, Канаде и Японии. Иными словами, реальность получить в недалеком будущем настоящее мышиное «наводнение» уже не вызывает сомнений.
Помимо трансгенной технологии, важным источником генетического разнообразия модельных животных являются точечные мутации. Их получают при введении животным N-этилнитрозомочевины (N-ethylnitrosourea – ENU): этот химический мутаген вызывает единичные замены нуклеотидных оснований, что может оказать значимое влияние на функцию конкретного гена.
Достоинством данного метода является его простота: для получения точечной мутации достаточно однократной инъекции ENU. Однако в отличие от генотипов, полученных с использованием генно-инженерных технологий, местоположение мутации, вызванной химическим мутагеном носит случайный характер. Поэтому требуется проведение значительной работы по ее идентификации, которая начинается с отбора мышей, чей фенотип представляет интерес для дальнейших исследований.
Наиболее масштабные работы по созданию таких генетических моделей мышей выполнены в рамках Мюнхенского ENU проекта. Особо стоит отметить экспресс-методы фенотипического описания мышей, которые были разработаны при его реализации (стандартный протокол фенотипирования включал в себя 135 морфологических, поведенческих и физиолого-биохимических параметров).
Один из наиболее удачных стандартизированных протоколов первичного описания животных, который сейчас используется в разных странах мира, предложен британскими учеными. Он известен по аббревиатуре SHIRPA, в которой последние две буквы (phenotype assessment) относятся к содержанию методического подхода, а остальные ведут происхождение от названий университетов и колледжей, в которых протокол разработан.
SHIRPA позволяет в течение 15 минут описать мышь по 58 параметрам, отражающим основные экстерьерные характеристики, показатели двигательной активности и некоторые рефлекторные реакции. Отклонение по этим параметрам является индикатором фенотипически значимых мутаций в генах, контролирующих рост и развитие животных, работу нервной и нервно-мышечной систем. Этот первичный анализ затем дополняется гематологическими, иммунологическими, биохимическими и эндокринными данными. На следующем этапе животные, отобранные на основе фенотипического скрининга, подвергаются генетическому анализу, который позволяет установить точную локализацию нуклеотидной замены и, соответственно, определить ген, в котором произошла мутация.
Всего с момента основания Мюнхенского проекта (1997) и до настоящего времени проведен скрининг более чем 30 тысяч мышей и получено более 750 линий, на которых проводятся исследования генетических основ отклонений в строении тела, предрасположенности к аллергиям, нарушениям нервной деятельности и обмена веществ.
Помимо полученных в последние годы трансгенных и мутантных мышей и крыс никто не сбрасывает со счетов другие генетические линии животных, полученные в результате направленной селекции, которые традиционно поддерживаются в вивариях. Некоторые из них являются уникальными объектами для изучения генетических механизмов таких социально значимых болезней, как артериальная гипертензия, преждевременная старость, психические расстройства и др. Кроме того, эти линии неоценимы для испытаний новых лекарственных препаратов и при разработке немедикаментозных средств профилактики и лечения болезней.
К имеющемуся списку животных-моделей следует добавить панели рекомбинантных линий, которые широко используются в генетике количественных признаков.
Таким образом, с помощью разных методов уже сегодня получены тысячи генетических линий лабораторных мышей. А согласно прогнозу, опубликованному четыре года назад в Nature, к 2025 г. их число достигнет 300 тысяч и, как пишет автор статьи, генетики уже сегодня готовятся к «мышиному потопу» (Abbot, 2004).
Строим криодамбы
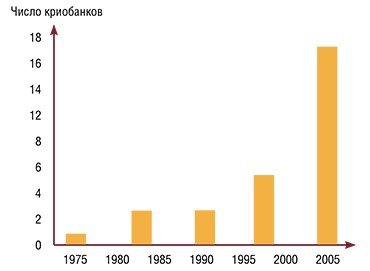
В соответствии с общепринятыми нормами для поддержания одной линии мышей «в живом разведении» требуется 10—12 пар племенных животных и, как минимум, 50 голов ремонтного молодняка. Все это количество можно разместить примерно в 3 м3 виварного помещения. Пока речь идет о десятках генотипов, такой подход кажется вполне приемлемым, но если речь идет о тысячах и сотнях тысяч линий, то поддержание мышиных ресурсов в форме племенных ядер становится невозможным. Выход из тупикового положения – это создание криоархивов.
Сегодня коллекции генетических линий животных могут сохраняться в виде замороженных эмбрионов, сперматозоидов, яйцеклеток и даже яичниковой ткани. Однако ведущие архивы генотипов делают ставку прежде всего на эмбрионы. Эмбрион – диплоидный организм, тогда как сперматозоиды и яйцеклетки гаплоидны, поэтому для полноценного архивирования генетической линии можно консервировать либо эмбрионы, либо гаметы обоего пола. Первый путь экономически более оправдан, поскольку второй предполагает еще один технологический этап: размороженные сперматозоиды и яйцеклетки должны соединиться, чтобы образовать эмбрион.

Эмбрион – это уже особь. И хотя эта особь состоит всего лишь из нескольких клеток, у него уже есть программа развития, закодированная в геноме. Поэтому для восстановления линии достаточно трансплантировать размороженные эмбрионы самкам-реципиентам, где они продолжат свое развитие. Большинство экспертов сходятся на том, что для надежной консервации требуется 200—500 эмбрионов. Однако как свидетельствует мировой опыт, генетическую линию удается иногда восстановить всего лишь из 20 эмбрионов.
Полтысячи эмбрионов легко упаковываются в объем около 0.3 л, что на четыре порядка меньше, чем объем, необходимый для поддержания линии живых мышей. Кроме того затраты на корм, подстилку и обслуживание существенно дороже, чем затраты на консервацию (жидкий азот и его регулярную доливку в сосуд Дьюара).
Но как долго можно сохранять эмбрионы в замороженном состоянии? На основе накопленного в мире опыта можно уверенно утверждать, что если консервация произведена правильно, то не важно, сколько времени эмбрионы хранились в жидком азоте – несколько секунд или десятки лет. Так, британский ученый Д. Уиттингем с коллегами (в 1972 г. именно они открыли способ заморозки эмбрионов мышей) продолжают и сегодня получать мышей с использованием эмбрионов, замороженных «впрок» более 30 лет назад: эмбрионы, хранящиеся в криобанке, нисколько не потеряли своей способности «оживать».
Поучительна и история, связанная с созданием первого в мире (и пока самого крупного) криобанка мышиных генотипов Джексоновской лаборатории (США). Поводом к его строительству стал пожар, случившийся в 1947 г., который уничтожил значительную часть коллекции традиционно разводимых там линейных животных. Поэтому как только технологии криохранения эмбрионов мышей были разработаны, их тотчас же реализовали в этом мировом генетическом центре. И когда в 1989 г. в лаборатории случился еще более разрушительный пожар (он бушевал более пяти часов и унес жизни около полумиллиона мышей), криобанк стал настоящей «палочкой-выручалочкой». Ведь некоторые линии мышей существовали лишь в коллекции лаборатории так что восстановить их можно было лишь из собственного криобанка.
Пример Джексоновской лаборатории оказался заразителен, и криоархивы стали создаваться в других генетических центрах. Сегодня их число приближается к двадцати. В японских центрах предусмотрен даже резервный банк на случай повреждения основного криохранилища при землетрясении. Например, Центр биоресурсов общества РИКЕН (BRC RIKEN) имеет основной криобанк в г. Тсукубе, а также резервный в 400 км к юго-западу (для последнего выделено место в одном из помещений синхрофазотрона, смонтированного на мощном фундаменте).
Однако криоархивы не только помогают при стихийных бедствиях. Ведь при размножении традиционным способом в генетической линии неизбежно накапливаются мутации. Кроме того, как и все живые существа, мыши подвержены инфекциям. Поэтому криобанк эмбрионов необходим не только для восстановления линии, погибшей от инфекции или несчастного случая, но и для поддержания ее чистоты.
Свободные от патогенов
Расширение возможностей создания живых генетических «моделей» идет бок о бок с ужесточением требований к организации работы с экспериментальными животными. Наиболее дорогим и трудновыполнимым требованием является обеспечение условий для содержания животных, свободных от основных видоспецифических возбудителей болезней (specified pathogen free – SPF).
 Для чего нужны такие животные?. Благодаря избавлению от инфекций устраняется практически не поддающийся контролю источник вариации экспериментальных данных, в результате надежность получаемых результатов значительно повышается. Поэтому согласно международным правилам (GMP и GLP стандарты) именно SPF-животные должны использоваться при проведении доклинических испытаний лекарственных препаратов и оценки биобезопасности новых материалов, включая продукты питания.
Для чего нужны такие животные?. Благодаря избавлению от инфекций устраняется практически не поддающийся контролю источник вариации экспериментальных данных, в результате надежность получаемых результатов значительно повышается. Поэтому согласно международным правилам (GMP и GLP стандарты) именно SPF-животные должны использоваться при проведении доклинических испытаний лекарственных препаратов и оценки биобезопасности новых материалов, включая продукты питания.
Стандартизация как условий содержания, так и самих лабораторных животных позволяет существенно сократить размеры экспериментальных групп. Неслучайно в нашей стране SPF-животных впервые стали использовать при изучении воздействия на организм космического полета (императивом к уменьшению числа экспериментальных животных в этом случае служили ограничения, накладываемые размерами космических аппаратов).
Помимо всего прочего, снижение количества объектов исследования без ущерба для качества экспериментов и улучшение условий содержания животных отвечает этическим требованиям.
Еще одной причиной, заставляющей прикладывать значительные усилия для избавления от патогенов, заключается в том, что некоторым генетическим линиям животных свойственна повышенная восприимчивость к болезням. В частности, для решения многих задач иммунологии требуется выключить отдельные звенья иммунной системы, что делает животных беззащитными по отношению к неизбежным в естественных условиях возбудителям болезней. Иллюстрацией к этому служит приведенная выше работа по мышам, производящим человеческие антитела. Промежуточным этапом при получении таких животных были мыши с нокаутированными собственными генами иммуноглобулинов, т. е. мыши, способные погибнуть от любой, даже неопасной, инфекции.
Для обеспечения SPF-стандарта лабораторных животных содержат в чистых помещениях, в которые под избыточным давлением подается стерильный воздух. Корм, вода, подстилка и клетки поступают в чистую зону вивария после предварительной стерилизации. В той же Японии корма обеззараживают гамма-облучением, а все остальное пропускается через автоклавы. И поскольку мышь не является нано-объектом, несмотря на небольшие размеры, объем клетки для содержания 5—6 мышей составляет около 5 л. И регулярное автоклавирование 1—2 тыс. клеток требует оборудования соответствующих габаритов.

Все вышеперечисленное привело к тому, что в развитых странах работу вивариев обеспечивает индустрия, производящая стеллажи, клетки, поилки, корма, подстилку и даже специальные «игрушки» для развлечения мышей. Последнее, несмотря на кажущуюся комичность – обязательное требование к содержанию животных в Англии и Скандинавских странах.
Международная кооперация
Стремительно увеличивающееся многообразие мышиных генотипов привело к созданию международной организации, призванной координировать работу национальных центров генетических ресурсов. Сегодня Федерация международных мышиных ресурсов (Federation of International Mouse Resources — FIMRe) объединяет 16 центров, расположенных в Северной Америке, Европе, Азии и Австралии. Центры формируют коллекции генотипов согласно договоренности, стараясь не дублировать друг друга. Эти коллекции пополняются благодаря собственной генетико-селекционной и генно-инженерной работе центров, однако основной вклад вносят научно-исследовательские лаборатории различной ведомственной принадлежности.
 Отношения с вкладчиками в криоархивы FIMRe и пользователями регулируются на основе соглашений о передаче материалов. При этом вкладчики получают следующие преимущества:
Отношения с вкладчиками в криоархивы FIMRe и пользователями регулируются на основе соглашений о передаче материалов. При этом вкладчики получают следующие преимущества:
• гарантии авторских прав;
• освобождение от затрат на сохранение и распространение генетической модели;
• надежное хранение;
• и, наконец, как подсчитали в японском центре BRC RIKEN, у вкладчиков повышается индекс цитирования более, чем на 88 %.
При передаче созданных «генетических моделей» пользователям учитывается ведомственная принадлежность последних. Например, в Японии университетские и академические лаборатории оплачивают только себестоимость разведения и содержания животных; для коммерческих же организаций плата выше на 30 %. Но в обоих случаях поступления от продажи животных не покрывают расходы на поддержание самих генетических центров. Поэтому большинство из них финансируется из федеральных бюджетов государств, проявляющих реальную заботу о развитии высоких технологий в области здравоохранения.
Создание сети международных центров, объединяемых FIMRe дало весомый вклад в изучение генетических основ функционирования организмов в норме и при патологии, а также в поиск оптимальных средств профилактики и лечения болезней. Сегодня исследователям предлагается следующий алгоритм взаимодействия с мировыми генетическими архивами: формулирование потребности в экспериментальных животных с заданными свойствами, поиск нужного генотипа в базе данных FIMRe, заказ животных через ближайший Центр, ассоциированный FIMRe, получение Центром заказанной линии, разведение и передача животных заказчику.
При этом в настоящее время уже намечается отчетливая тенденция сокращения обмена племенными животными в пользу обмена криопродуктами. Можно предсказать, что реализация проектов, подобных KOMP, приведет к включению в мировой оборот модельных организмов линий эмбриональных стволовых клеток с заданными изменениями генотипа, а затем и генно-инженерных конструктов, которые можно будет заказать по каталогам, как любой химиреактив. Это особенно эффективно с точки зрения биобезопасности, поскольку риск трансграничного обмена нежелательными микроорганизмами невозможно исключить при самом тщательном контроле за перевозкой живых организмов.
Но все эти блага прогресса будут доступны только тем странам, в которых будут существовать Центры, обеспечивающие полный цикл работы с генетическими ресурсами, т. е. имеющие в своем составе криобанк, лаборатории репродуктивных технологий и трансгенеза, и в которых племенное разведение и содержание животных будут проводиться в соответствии с SPF- стандартом.
А что в России?
Единственный на сегодня в России питомник SPF-животных, сертифицированный в соответствии с международными стандартами, расположен в Пущинском научном центре неподалеку от Москвы. В Питомнике лабораторных животных Филиала Института биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова РАН поддерживается около дюжины наиболее «ходовых» линий мышей, несколько линий крыс и одна линия сирийских хомячков. Помимо воспроизводства экспериментальных объектов в питомнике налажена работа по освобождению животных от патогенов, криоконсервирование половых продуктов и эмбрионов, хирургическая подготовка животных для хронических и острых экспериментов.
В непосредственной близости от питомника находится один из основных потребителей SPF-животных – лаборатория биологических испытаний Филиала ИБХ РАН. Возможность использования подобных животных позволяет проводить здесь доклиническую оценку лекарственных препаратов в соответствии с международным стандартом GMP (Good Manufacturing Practice) – ISO 9000, и, соответственно, получать заказы на такие испытания от зарубежных университетов и фармацевтических компаний.

А какова ситуация за Уралом? Если двигаться на восток от Пущино-на-Оке, то обнаружится, что следующий центр разведения SPF-животных находится … в Японии. Все остальное пространство между этими географическими точками абсолютно свободно от животных, свободных от патогенов. И это удручает, потому что и в Сибирском, и Уральском, и Дальневосточномх отделениях РАН (а также и РАМН) активно ведутся работы с использованием лабораторных мышей и крыс. Если же добавить к ним институты других ведомств, а также классические и медицинские университеты, то окажется, что число потенциальных пользователей животных-моделей переваливает за сотню.
Сегодня все эти исследовательские учреждения обходятся тем ограниченным набором генотипов, которые могут им предоставить существующие виварии. Однако уже сейчас это серьезно тормозит фундаментальные исследования, а на работы прикладного характера накладывает гриф – «Только для внутреннего пользования», поскольку качество подопытных животных и условия их содержания не отвечают мировым стандартам.
Рассматривая скорбное текущее состояние дел и наши светлые перспективы, нельзя не отметить важную историческую роль академика В. К. Шумного, который 5 лет назад, будучи директором Института цитологии и генетики СО РАН и председателем Объединенного ученого совета по наукам о жизни, сумел добиться от российского правительства финансирования работ по строительству современного вивария с повышенными требованиями к содержанию животных
Точно неизвестно, какие соображения лежали в основе решения о строительстве SPF-вивария, но то, что это было попадание в «яблочко» – несомненно. Причем, пользуясь артиллерийской терминологией, можно сказать, что «выстрел» накрыл не только цели и задачи, очевидные в момент принятия решения, но и те, актуальность которых стала осознаваться лишь в самое последнее время. В ходе недавнего визита в Германию президент РФ Д. Медведев очередной раз подтвердил, что «Вступление во Всемирную торговую организацию – это тот рубеж, который Россия должна преодолеть». В контексте настоящей статьи это означает обязательное введение международных стандартов на все виды работ с экспериментальными животными, что не представляется возможным без создания адекватной экспериментальной базы.

Но все же главным стимулом к созданию современного центра живых генетических моделей служит внутреннее стремление ученых повысить надежность собственных научных результатов. Ведь возможность проводить исследования на тщательно стандартизированных экспериментальных объектах, содержащихся в строго контролируемой среде, в сочетании с неограниченным доступом к мировым «генетическим ресурсам» является залогом успешного развития современных биологических исследований.
Еще в большей мере это утверждение относится к междисциплинарным исследованиям, призванным решить фундаментальные проблемы функционирования живых организмов на разных уровнях организации. Решение этих проблем может дать ответы на животрепещущие вопросы о причинах болезней и старости, путях достижения успеха в разных формах конкурентной деятельности, биологических основах социальной привязанности и отторжения и многих других – здесь найдется место и физику, и лирику. Создание современной инфраструктуры, помимо прочего, будет иметь немаловажное значение и для подготовки молодых ученых: возможность работать на уровне мировых стандартов (что подразумевает доступность экспериментальных объектов и необходимого инструментария) выступает для них в роли важнейшего стимула при выборе жизненных ориентиров.
И, наконец, еще одним стимулом к созданию современного генетического центра стала региональная программа развития фармакологической промышленности в Новосибирской области, в частности – создание фармакологического «кластера» с участием Сибирского центра фармакологии и биотехнологии (СЦФБ), институтов СО РАН и СО РАМН, а также венчурных компаний. Все это является существенной составляющей общего инновационного комплекса Новосибирского научного центра и НСО. Нужно отметить, что в области исследований, относящейся к созданию новых средств диагностики, профилактики и лечения болезней, пересекаются интересы не только медиков, биологов и химиков, но и физиков разного профиля, от ядерщиков до аэродинамиков.
Конечно, такое явление, как биомедицинская интеграция естественных наук – тема для специального разговора. Здесь же хотелось бы отметить, что любые работы в этом направлении замыкаются на стадию доклинических испытаний, объектами которых как раз и служат экспериментальные животные с заданными генетическими свойствами, качество которых, как и качество их содержания в виварии, должны отвечать строгим международным стандартам.
Многофункциональный и коллективный
Итак, что же мы имеем на сегодня? В соответствии с решением Правительства РФ в Новосибирском научном центре на базе ИЦиГ СО РАН строится современный виварий для мелких животных с повышенными требованиями к содержанию. Благодаря оригинальной архитектуре (главный инженер проекта – Б. В. Нестеров, ГИПРОНИИ СО РАН), строящееся здание привлекает всеобщее внимание.
Общая площадь вивария составляет около 5 тыс. м2, из них почти 1000 м2 составляют помещения, оборудованные по стандарту «чистых комнат» (класс С). Эту работу выполняет известный российский лидер в данной области – Миасский завод медицинского оборудования. На 2-м и 3-м этажах оборудуются два полностью оснащенных автономных блока для содержания лабораторных животных, свободных от специфических патогенов. Еще четыре лабораторных помещения общей площадью около 140 м2 расположены на первом этаже; остальное пространство занято различными технологическими и вспомогательными помещениями.
Подобная структура вивария предоставляет хорошие возможности для многоцелевого использования этого инфраструктурного объекта, и это единственное разумное решение при нынешнем положении дел. Так, в организации исследований на лабораторных животных в развитых странах хорошо просматривается исторически сложившееся разделение функций. В этом смысле показателен пример Японии, имеющей близкую к российской численность населения и высочайшую репутацию как в сфере высоких технологий в целом, так и в «здоровьесберегающих» технологиях в частности. Исследования на лабораторных животных проводятся во многих японских университетах и в коммерческих лабораториях. Все крупные университеты имеют в своем составе виварии, в которых животные содержатся в соответствии с SPF-стандартом, а также лаборатории, производящие трансгенных мышей. Помимо самостоятельного разведения животных университетские виварии также закупают наиболее ходовые линии мышей и крыс из специализированных питомников.

Для интеграции и сохранения стремительно растущего разнообразия лабораторных животных в Японии созданы специальные ресурсные центры. Например, Центр биоресурсов в Тсукубе (BRC Riken) специализируется на мышах и хранит в своем быстро пополняемом криоархиве около 3 тысяч генетических линий. Крысы находятся в ведении «Национального биоресурсного проекта для крыс» с головным учреждением — Институтом лабораторных животных Университета Киото. Сейчас под контролем этого проекта находится 458 линий крыс.
Следует подчеркнуть, что для эффективной работы подобных инфраструктурных комплексов, обеспечивающих фундаментальные и прикладные исследования на лабораторных животных, необходимо наличие всех вышеперечисленных структурных компонентов, плюс ряд вспомогательных коммерческих организаций, по-ставляющих корм, подстилочный материал, дезсредства и другие жизненно-необходимые «мелочи». Мы же сегодня заканчиваем строительство нашего вивария практически посреди инфраструктурной «полупустыни». «Полу» – потому что у нас все же есть:
• виварии, расположенные по соседству, в которых однако отсутствуют условия для SPF-содержания животных;
• корма для животных, но стерилизация их гамма-облучением не отлажена;
• деревья, что неудивительно для Сибири, но при этом отсутствует стружка нужного качества для подстилочного материала.
К сожалению, список, чего у нас пока вообще нет, может занять гораздо больше места…
Однако несмотря на многие, как мы надеемся, временные недостатки, оснований для пессимизма у нас нет. Сама концепция создания мультифункционального комплекса адекватно воспринята руководством ИЦиГ СО РАН, академиками В. К. Шумным и Н. А. Колчановым и далее развивалась как результат коллективного творчества, найдя поддержку у научного сообщества СО РАН. Об этом свидетельствуют постановления Общего собрания ННЦ СО РАН (№ 1 от 15.11.07) и Президиума СО РАН (№ 26 от 24.01.08) об организации на базе строящегося SPF-вивария ИЦиГ СО РАН Центра коллективного пользования, обеспечивающего исследования в области генетики, молекулярной биологии, физиологии, биомедицины, нанобиобезопасности и фармакологии. Положительные оценки получены и при апробации проекта на заседании Президиума СО РАМН (20.02.08).
Столько, сколько нужно!
В соответствии с концепцией мультифункционального комплекса вновь создаваемый Центр будет включать в себя:
• Криобанк и лабораторию репродуктивных технологий, предназначенные для создания архива генетических линий мышей и крыс на основе криоконсервирования половых клеток, эмбрионов на ранней стадии развития и эмбриональных стволовых клеток; перевода в SPF-стандарт уникальных линий животных, полученных в России; для обмена с криоархивами России и других стран, прежде всего, с генетическими центрами объединяемыми FIMRe; для разработки новых технологий криоконсервации на различных видах животных; для создания криоархивов уникальных пород сельскохозяйственных животных.
• Сектор племенного разведения, обеспечивающий поддержание и разведение племенных ядер разных линий мышей и крыс.
• Сектор трансгенных животных, предназначенный для создания методами генной инженерии новых линий животных с заданными генетическими свойствами.
• Лаборатории физиологического и этологического фенотипирования для прижизненных исследований поведения и морфофизиологических процессов у животных в пределах SPF-зоны.
• Лаборатории пробоподготовки для первичной обработки материалов, взятых от экспериментальных животных.
• Сектор информационной поддержки, обеспечивающий автоматизированный контроль всех видов работ с животными, а также связь с базами данных мировых центров биоресурсов лабораторных животных.
Реализация этого плана позволит поднять на качественно новый уровень (в частности, на уровень международных GMP и GLP стандартов) весь комплекс исследований, проводимых на лабораторных животных в СО РАН и в целом в Сибири. Мы сможем, наконец, отказаться от «сиротской идеологии», которая в этой области научно-организационной деятельности выражается у нас стандартным вопросом: «А сколько линий мышей будет содержаться в новом виварии?» Сегодня единственно правильный ответ на этот вопрос должен звучать так: «Да ровно столько, сколько нужно, и именно тех генотипов, которые требуются для решения конкретных задач, стоящих перед каждым из вас».
Создание Центра позволит существенно поднять материальную базу прижизненных морфо-функциональных исследований, ведь за последнее время техническое обеспечение этих работ значительно продвинулось благодаря таким методам, как fMRI-томография, тепловидение, телеметрия, прижизненное ИК-сканирование и многое другое. Эти подходы чрезвычайно важны для изучения изменений, протекающих в ходе онтогенеза и при различных экспериментальных воздействиях на организм, например, доклинических испытаниях новых средств профилактики и лечения болезней, оценке безопасности новых наноматериалов и т. д.
Конечно, скептики имеют право усомниться в реалистичности этих планов. Однако опыт успешно развивающихся стран, таких как Южная Корея, Китай, Индия и др., говорит о том, что в сферу новых технологий нужно входить либо стремительно, либо вообще даже не пробовать, а продолжать бурить скважины…
Оптимизм внушает и то обстоятельство, что помимо материальных ресурсов, выделенных на строительство здания нового Центра, мы имеем достойное интеллектуальное и профессиональное обеспечение его будущей деятельности. Пусть у нас еще нет криобанка, но есть С. Я. Амстиславский, который за неимением собственной лабораторной базы работает в Финляндии над проблемой расширения списка видов, пригодных для криоконсервации (в том числе и европейской норки, сохранение которой лежит в сфере национальной ответственности РФ). Большой опыт селекции экспериментальных животных с генетической предрасположенностью к некоторым болезням накоплен в ИЦиГ СО РАН
Судя по работам в области генной инженерии, выполняемым (часто совместно) в этом институте и в Институте химической биологии и фундаментальной медицины СО РАН, будущая генетическая коллекция нового Центра будет успешно пополняться собственными трасгенными животными, созданными под конкретные задачи сибирской науки. Эта работа будет осуществляться на основе межинститутской кооперации в области трансгенеза, причем в части работ на животных будет задействован SPF-виварий.
Сегодня в институтах СО РАН успешно используются самые современные методы исследования молекулярно-генетических, физиологических, морфологических и поведенческих процессов в живых организмах. Например, разработанные в Томографическом центре СО РАН подходы к прижизненному изучению тонких процессов, протекающих в живых организмах, уже применяются в совместных работах ИЦиГ и других биологических институтов СО РАН. А в Новосибирском институте органической химии СО РАН работает одна из наиболее успешных лабораторий фармакологических исследований, обеспечивающая связь химической науки с медицинской практикой (подробнее об этих работах читайте в одном из следующих номеров журнала).
Масштабные и разнообразные по тематике исследования живых организмов с помощью лучевых технологий биологи проводят совместно с физиками из Института ядерной физики и Института химической кинетики и горения СО РАН. Мы очень надеемся, что, наряду с решением фундаментальных задач, эти специалисты помогут разрешить и проблему практического применения технологий лучевой стерилизации, необходимых для выращивания SPF-животных.
От структуры – к функции
В одном из автобиографических воспоминаний нобелевский лауреат Д. Уотсон пишет, что он начинал научную карьеру как орнитолог, и с тех пор ему крайне хотелось узнать, каким образом в череде поколений обеспечивается устойчивое повторение сложнейших орнаментов, украшающих самцов многих видов птиц. Вместе с Ф. Криком он внес весомый вклад в решение этой проблемы, расшифровав структуру ДНК. Сегодня, после полной расшифровки геномов человека и многих других видов организмов, мы имеем все теоретические и технологические предпосылки для следующего шага в нашем стремлении – понять, каким образом генетическая информация трансформируется в «истории жизни» отдельных особей.
У этой фундаментальной задачи, скорее всего, нет простого решения. Более вероятно, что оно будет формироваться как интегрированный результат огромного числа частных знаний о «траекториях», ведущих от гена к признаку, или от генных сетей – к фенотипу. И в этом «технологическом» цикле познания живых систем (от морфологического описания – к физиологическому объяснению) облигатным элементом являются исследования на животных с заданными генетическими свойствами. Ведь только на уровне целого организма можно окончательно проверить справедливость тех построений, которые складываются из анализа последовательностей нуклеотидов, изучения структур и функций биомолекул, детализации клеточного строения, математического моделирования генных сетей и т. д. Вспомним знаменитый фильм «Место встречи изменить нельзя»: пианиста можно оценить по форме рук или музыкальному слуху, но гораздо надежнее просто попросить его сыграть «Мурку»…
Необходимость в накоплении конкретных знаний диктуется не только невообразимой сложностью живых организмов, но и отсутствием «типовых конструкций» в рамках каждого биологического вида, включая человека. Поэтому в биомедицинские исследования, ориентированные на поиск методов лечение «больных, а не болезней», привлекается все больше число разнообразных живых генетических «моделей».
Одним из стимулов для создания подобных моделей служит стремительное накопление информации о генах, ассоциированных с той или иной патологией. В крайне редких случаях ученым удается реализовать полный цикл исследований, который включает в себя идентификацию генотипов, связанных с болезнью; получение соответствующих модельных животных; анализ механизмов генетически детерминированного патогенеза; поиск адекватных средств коррекции.
Следует отметить, что частоты генов, ассоциированных с болезнью, и сам характер этих ассоциаций имеют этнические особенности. И в этой связи создание условий для реализации всего вышеперечисленного комплекса исследований входит в разряд национальных приоритетов, поскольку «спасение утопающих – дело рук самих утопающих». Этот тезис находит отражение в стремительно растущем числе подобных генетических центров, создаваемых во всех развитых странах. Расширение спектра модельных млекопитающих с заданными генетическими свойствами лежит в русле общих тенденций развития современной биологии и медицины.
Нужно заметить, что создание Центра, обеспечивающего доступ к мировым архивам лабораторных животных, имеет и далеко идущие последствия, поскольку создание современной инфраструктуры само по себе оказывает колоссальное влияние на воспитание конкурентоспособной молодежи. Это в равной степени относится к любым формам конкурентной деятельности: так, увлечение первого президента России теннисом обеспечило хорошие условия для тренировок молодежи, и сегодня наши теннисисты занимают ведущие позиции в мировом рейтинге.
В науке даже в большей степени, чем в спорте важно, чтобы талантливая молодежь работала у себя на родине. И удерживать ее должны не административные ограничения на выезд, а такие условия жизни и работы, которые не уступают европейским стандартам. Расположенный на территории новосибирского Академгородка новый Центр, несомненно, будет широко использован при подготовке высокопрофессиональных специалистов в разных областях биологии и биотехнологии, которая проводится в Новосибирском государственном университете и в академических институтах СО РАН и СО РАМН.

Итак, строящийся ныне SPF-виварий ИЦиГ СО РАН, счастливо получивший стартовый капитал от Правительства РФ, призван стать центром интеграции исследовательской активности ученых, для которой необходимы экспериментальные животные-модели. Он должен стать Центром коллективного пользования, в чем заинтересованы многие институты РАН и РАМН в разных регионах Урала, Сибири и Дальнего Востока, а также классические, медицинские и сельскохозяйственные университеты. Уже сегодня эта заинтересованность реализуется в виде весомой научно-методической и финансовой поддержки, которая оказывается в рамках программы СО РАН «Геномика, протеомика, биоинформатика», осуществляемой под руководством академиков Р. З. Сагдеева, В. Н. Власова, Н. А. Колчанова.
В развитых странах подобные центры входят в список национальных приоритетов, поэтому их можно рассматривать как один из символов государственности наряду с гимном, гербом и флагом. И такое положение вполне заслуженно, поскольку эти учреждения являются неотъемлемым элементом научно-технологического комплекса, призванного решить одну из главных задач государства: обеспечить здоровье нации через здоровье отдельных граждан.
Литература
Abbott А., Harbor В. Genetists prepare for deluge of mutant mice // Nature. 2004.N. 432. 541 р.
Collins F. S. et al. The International knockout mouse consortium // Cell. 2007. N. 128. Р. 9—13.
Davisson M. FIMRe: Federation of International Mouse Resources: global networking of resource centers // Mamm. Genome. 2006. N. 17 (5). 363 р.
Gachon F. et al. The loss of circadian PAR bZip transcription factors results in epilepsy // Genes. & Dev. 2004. N. 18. Р. 1397—1412.
Sprengel R., Hasa M. T. Tetracycline-controlled genetic switches // HEP. 2007. № 178. Р. 49—72.
Xiao-Wei Tan et al. Fetal microchemerism in the maternal mouse brain: a novel population of fetal progenitor or stem cells able to cross blood-brain barrier? // Stem. Cells. 2005. N. 23. Р. 1443—1452.