Социальная жизнь атомов и молекул
Что такое научная популяризация? Умение говорить просто о сложном. Оно сродни искусству и, как всякий дар, не зависит от степеней, званий и даже научного стажа пишущего. Совет научной молодежи СО РАН с 2010 г. проводит ежегодный конкурс научно-популярных статей, чтобы побудить аспирантов, студентов и молодых специалистов интересно, доступно и корректно излагать широкой публике специализированные научные результаты.
В 2011 г., объявленном Международным годом химии, диплом второй степени был присужден статье, в которой просто – буквально «на пальцах» – рассказывается об основных идеях и принципах химического катализа
Уважаемый читатель! Эта статья преследует цель кратко и доходчиво объяснить современные научные термины, понятия и достижения в одной из передовых областей научных исследований человеку, непосредственно с наукой не связанному.
Конкретно речь пойдет о такой научной области, как гетерогенный катализ, а точнее, о современных способах узнать, «что делают молекулы» на поверхности твердого катализатора в процессе химической реакции.
Путь химической реакции
Всем нам из школьного курса химии хорошо известно, из чего состоят молекулы – из атомов. Также известно, что атомы содержат электроны, вращающиеся вокруг ядра. И то, как эти электроны ведут себя при сближении атомов и образовании химической связи, определяет свойства молекулы, а вместе с тем и вещества, из этих молекул состоящего.
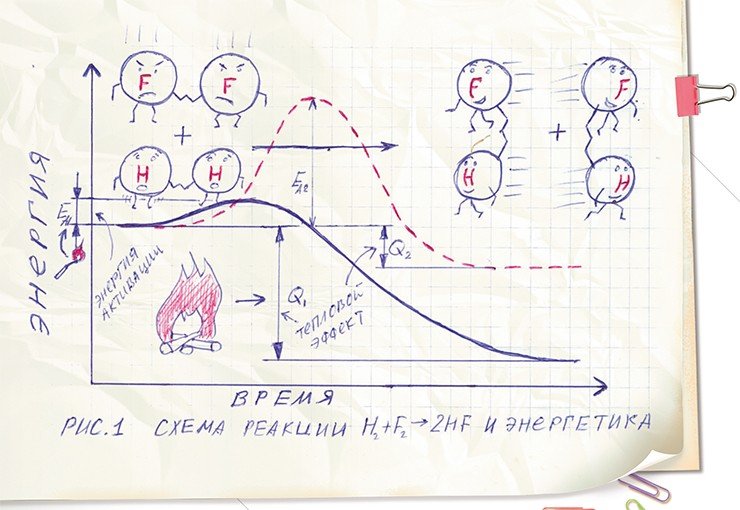
Любая химическая реакция (за исключением соединения и разложения) суть обмен атомами между «старыми» молекулами с образованием «новых» молекул. Вот, например, очень простая реакция образования фтороводорода из водорода (H2) и фтора (F2). В ней нет ничего сложного: молекулы обменялись атомами и в результате образовались новые молекулы HF. Эта химическая реакция в силу своей простоты и по причине очень высокой активности фтора (к последнему можно даже применить термин – «агрессивный», и это не будет научным моветоном) протекает со взрывом даже при температуре жидкого азота!
Однако разных типов молекул в мире существует бессчетное множество, и различаются они набором и числом атомов, в них входящих, а также тем, как эти атомы связаны между собой через свои электроны. Поэтому далеко не все (а точнее сказать, очень немногие) химические реакции протекают настолько охотно, как вышеупомянутая. И слава Богу! Иначе не только на Земле не было бы жизни, наш мир вообще был бы абсолютно не похож на ныне существующий.
Все дело в том, что для начала химической реакции почти всегда необходимо сообщить молекулам какое-то количество энергии, например нагреть реакционную смесь, осветить и т.д. Молекулы переходят в активированное состояние и только тогда могут вступить в реакцию, в результате которой энергия выделяется.
Наиболее наглядный пример подобной реакции – горение. Сама по себе древесина не загорается, но если ее сильно нагреть или поджечь, она начинает реагировать с кислородом воздуха, при этом происходит выделение энергии (тепла) в виде пламени и жара. Это тепло частично тратится на «нагрев» новой порции древесины, и таким образом процесс горения самоподдерживается.
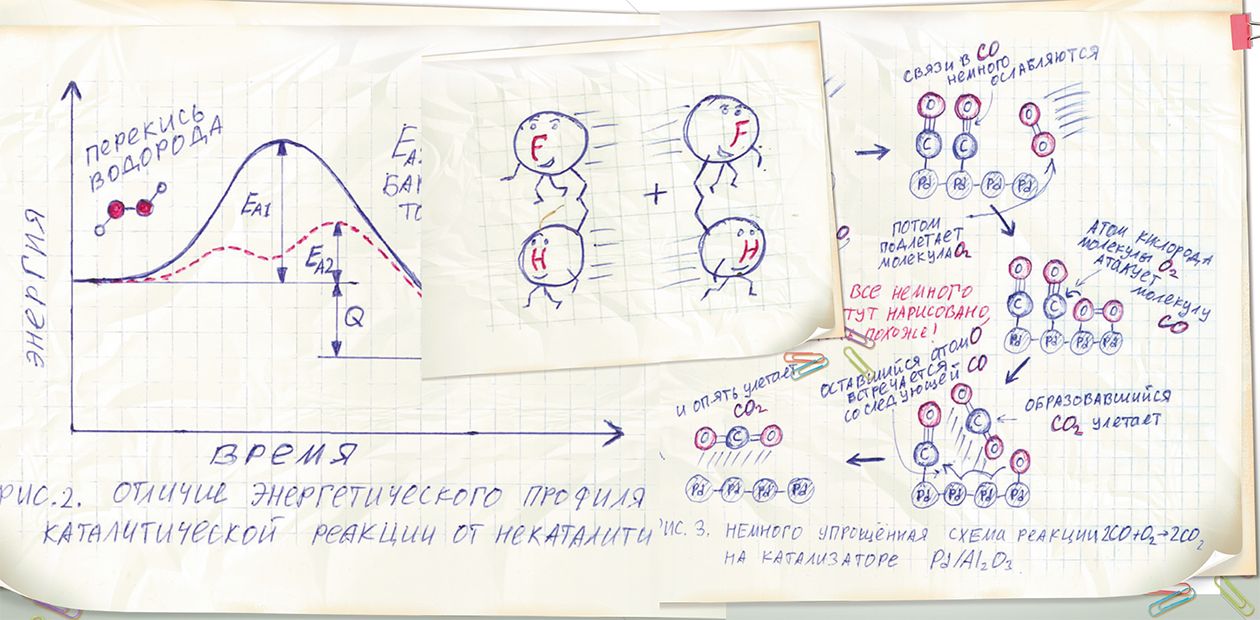
Энергетику химических реакций можно очень просто и наглядно изобразить схематически в виде всего одного графика, представляющего собой зависимость полной энергии системы от времени. (Полная энергия – это энергия, запасенная в виде химических связей в самих молекулах, плюс та энергия, которую мы им хотим сообщить, чтобы они вступили в химическую реакцию .
В случае упомянутой выше реакции фтора с водородом кривая вначале незначительно ползет вверх, а потом резко спадает. Изначальный подъем связан с тем, что для начала даже такой активной химической реакции требуется какое-то, пусть и небольшое, количество дополнительной энергии. А последующий резкий спад означает, что в ходе самой реакции энергия выделяется. Количество выделяемой энергии, которое равно разности между начальным и конечным энергетическими уровнями, называется тепловым эффектом химической реакции (Q). Величина этого эффекта, т. е. количество тепла, зависит от свойств химических связей в молекулах веществ, вступающих в реакцию (реагентах) и веществ, образующихся в результате реакции (продуктах).
Для реакции водорода со фтором величина теплового эффекта воистину впечатляет! Что же касается большинства других химических реакций, то, судя по графику, практически во всех случаях требуется подвести большее количество энергии, тепла же выделится значительно меньше.
Легко заметить, что подъем и спад кривой образуют нечто наподобие барьера, который необходимо преодолеть, чтобы химическая реакция началась. Он так и называется – барьер химической реакции. А его высота, т.е. то количество энергии, которое необходимо передать молекулам для начала реакции, называется энергией активации (EA).
Подводя промежуточный итог, можно сказать, что у любой химической реакции есть два очень важных -параметра – энергия активации EA и тепловой эффект Q.
Природа берет барьер
Существование активационных барьеров – великое благо! Без них все принципиально возможные в мире химические реакции взяли, да и осуществились бы мгновенно, оставив после себя раскаленный светящийся газ, который бы постепенно остыл и частично выпал в виде жидких и твердых частиц на земную поверхность. Думается, после этого наша планета представляла бы собой достаточно удручающее для живого существа зрелище.
С другой стороны, часто требуется получить какое-нибудь нужное, ценное вещество, а химическая реакция, которая приводит к образованию этого вещества, никак не желает идти. Говоря научным языком, реакция обладает высоким активационным барьером. Казалось бы, ничто не мешает взять нужные реагенты и хорошенько нагреть, чтобы преодолеть этот барьер. К сожалению, количество требуемой энергии часто настолько велико, что при этом начинают разрушаться сами молекулы реагента или образующиеся молекулы нужного нам продукта. И проводить таким способом химическую реакцию становится просто нецелесообразно.
Однако не все так плохо! Природа придумала для «взятия барьеров» один очень интересный класс химических явлений, объединяемых общим термином катализ. Природные катализаторы – белки-ферменты – справляются со своей задачей великолепно! А задача эта состоит в том, чтобы провести нужную химическую реакцию со стопроцентным превращением в определенное вещество, и все это при температуре человеческого тела и обычном атмосферном давлении.
Сам катализатор (фермент) в химической реакции не расходуется, а вступает во временное взаимодействие с реагентами. И именно в этой, связанной с ферментом, форме реагенты и превращаются в нужные продукты. Сам же фермент отсоединяется и может участвовать в следующем реакционном цикле.
Получается, что интересующая нас химическая реакция, которая сама по себе не идет, прекрасно проходит в присутствии катализатора, который при этом практически не расходуется. Чтобы понять, как такое возможно, рассмотрим энергетические кривые для реакции превращения перекиси водорода (H2O2) в воду и свободный кислород, которая может идти как с участием фермента пероксидазы, так и без него.
В случае отсутствия фермента высота активационного барьера (EA1) велика. Однако при добавлении фермента все меняется радикальным образом. Фермент, соединяясь с молекулами реагента (перекиси), влияет на электроны в составе этих молекул так, что в несколько измененном состоянии молекулы H2O2 уже легко отсоединяют атомы кислорода, образуя воду и молекулярный кислород.
Для образования комплекса из фермента и молекулы перекиси требуется совсем незначительная энергия (первый подъем на графике) и чуть большая – для перехода этого комплекса в нужный продукт (второй максимум на кривой). В любом случае величина энергии активации ЕA2 в случае с катализатором намного меньше, чем без его участия. Таким образом, катализатор снижает высоту активационного барьера химической реакции настолько, что она становится возможной.
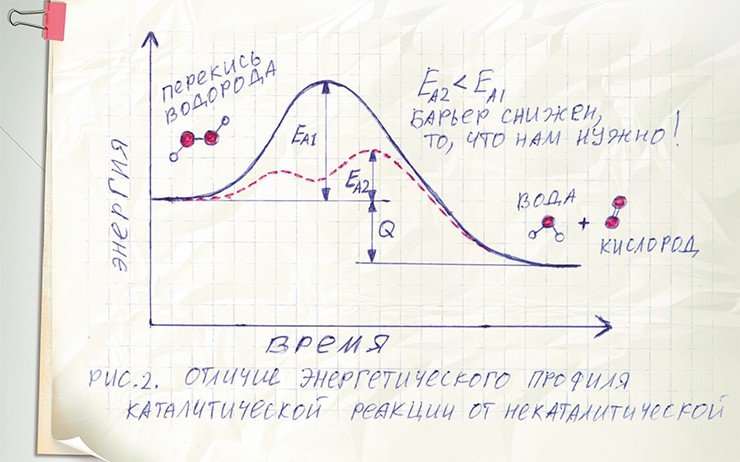
Важно отметить, что количество тепла, выделяемого в процессе протекания данной реакции, от катализатора не зависит. Он может только «облегчить» протекание химической реакции, понизив величину барьера. Однако запустить протекание реакции, термодинамически запрещенной (т.е. когда энергия в процессе реакции не выделяется, а поглощается), он не в состоянии.
Несмотря на все преимущества ферментов как катализаторов, их достаточно редко используют в промышленности. Во-первых, ферментативный катализ является гомогенным, т. е. протекает в одной фазе (как правило, в жидкой), а это затрудняет последующее отделение продукта от катализатора. Во-вторых, наиболее важные промышленные реакции являются очень простыми, тогда как большинство ферментативных реакций, напротив, очень сложны и сопряжены с другими реакциями. В-третьих, сами ферменты являются сложноустроенными большими органическими молекулами, содержащими сотни, тысячи, а иногда и десятки тысяч атомов. Поэтому использование таких макромолекул в промышленном масштабе во многих случаях будет экономически нецелесообразно.
Катализатор, который придумали химики
Нужно сказать, что каталитическая активность свойственна не только ферментам, да и само это явление было открыто совсем в другой области. Еще в 1835 г. знаменитый шведский химик Йёнс Якоб Берцелиус ввел в обращение термин «каталитическая сила», основываясь на открытом к тому времени явлении ускорения химических реакций при участии «третьей силы», которая сама не расходуется в реакционном процессе. Такие свойства были обнаружены у глин, благородных металлов и многих других веществ. На сегодняшний день практически нет ни одного химического элемента, который в том или ином виде не использовался бы в катализе.
Наиболее разнообразным каталитическим действием обладают металлы платиновой группа – сама платина, а также иридий, осмий, палладий, рутений и родий, которые ускоряют практически все известные простые реакции. Например, если бумажку, смоченную платиновой чернью, поместить в воздушную атмосферу, содержащую водород, последний тут же воспламенится и сгорит с образованием воды.
Каталитическую активность можно измерить. Часто ее оценивают по тому, как при введении катализатора изменяется один из существенных параметров реакции (скорость, начальная температура реакции и т. д.). -Например, реакция сгорания окиси углерода или угарного газа (СО) до углекислого газа (СО2) без катализатора начинается приблизительно при 700 °C – именно такой должна быть минимальная температура пламени при поджигании струи этого газа в воздухе. В присутствии же некоторых оксидов (глин, керамик и других подобных материалов) угарный газ начинает гореть уже при температуре 400°С. Таким образом, этот катализатор понижает начальную температуру реакции на 300 °С, что, согласитесь, немало. Если мы добавим платину или палладий в виде порошка, угарный газ начнет гореть уже при температуре 200 °С!
Но в таком виде (точнее, в виде сеток из тонких проволок) платиновые металлы в катализе применялись прежде: сейчас металлы платиновой группы используют лишь как один из компонентов катализатора, который так и называется – активный компонент.
Такой компонент в виде очень мелких частиц наносится на носитель. Частицы настолько маленькие, что если мы выложим 10 тыс. штук таких частиц в ряд, то длина его будет не больше диаметра человеческого волоса. Предоставленные сами себе, частицы моментально сольются вместе в один «комок» или, по-научному, агрегат; но они могут «жить» и самостоятельно, если будут на чем-то зафиксированы. Именно для этой цели и служит носитель.
Частицы мелкого размера используются по двум основным причинам. Во-первых, частички катализатора должны обладать как можно большей свободной поверхностью, а это как раз и достигается при измельчении, поскольку при уменьшении линейного размера тела его объем уменьшается намного быстрее, чем площадь поверхности. Во-вторых, при уменьшении размера частицы катализатора и достижении ее определенного диаметра (примерно 0,000005 мм!) начинают меняться и свойства самого металла, что приводит к резкому увеличению каталитической активности.
В качестве носителя, как правило, используют оксиды алюминия и кремния, потому что они выдерживают нагревание до 1000 °С и выше, обладают достаточной прочностью, легкостью, дешевизной и, что самое главное, развитой удельной поверхностью. Последнее означает, что эти материалы содержат огромное количество пор размером от микрона до нанометров, на внутренней поверхности которых как раз и крепятся частицы активного компонента. Соответственно, чем больше пор, тем больше активных частиц можно «посадить» на этот носитель.
Возвращаясь к реакции окисления угарного газа до углекислого, отметим, что если в качестве катализатора использовать палладий, нанесенный на окись алюминия (Pd/Al2O3; в случае катализатора активный металл обычно пишется в начале, а через косую черту – используемый носитель), то реакция начнется уже при 150 °С.
Как он работает?
Снижение энергетического барьера реакции при использовании катализатора приводит к увеличению скорости реакции и резкому падению минимальной начальной температуры. Интуитивно понятно, что в этом случае катализатор действует аналогично ферментам, связываясь каким-то образом с молекулами-реагентами и меняя их структуру так, что реакция становится возможной при гораздо меньшей температуре. Но как этот процесс происходит в деталях?
Вернемся снова к каталитическому процессу горения угарного газа. т. е. окислению молекул СО на поверхности металлического палладия, находящегося в виде наночастиц в катализаторе Pd/Al2O3.
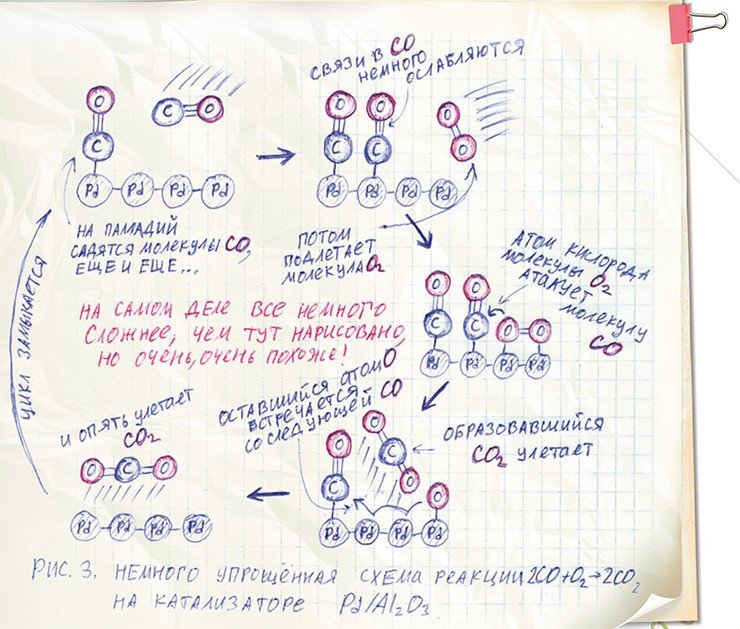
Нужно отметить, что молекула СО имеет очень большую «склонность» к благородным металлам. Она в прямом смысле «подлетает» к поверхностным атомам палладия и цепляется за них атомом углерода. Этот процесс повторяется до тех пор, пока каждый атом палладия на поверхности не будет «оккупирован» молекулой СО. И «любовь» молекулы СО не остается безответной: палладий «дарит» ей свои электроны, от чего та просто «тает» – прочность связи между атомами углерода и кислорода в молекуле существенно снижается!
Заметим, что в свободном виде молекула СО является очень устойчивой, недаром кислород в ней связан с углеродом аж тройной связью. А после того, как молекула «растаяла», ослабила свою «множественную» связь под влиянием палладия, она становится намного уязвимей. В свою очередь, молекула кислорода воздуха О2 также садится на поверхность палладия, «подходит» к ослабленной молекуле СО и – готово! Происходит реакция с образованием молекулы СО2, которая уже особой «любви» к палладию не проявляет и тут же улетает прочь. «Осиротевший» атом кислорода ищет вторую молекулу СО, и акт окисления повторяется.
Как мы видим, работа катализатора заключается в том, что он меняет свойства связей в молекулах-реагентах, понижая их прочность. По современным научным представлениям, схожим образом работает и катализатор Pd/Al2O3. Именно «схожим», потому что изложенное выше схематическое описание процессов, отражающее общий принцип работы катализатора, представляет собой сильно упрощенную картину Боресков, 1988). Подробные, «мелкие» детали процесса окисления СО кислородом на поверхности палладия изучаются и уточняются до сих пор.
Как мы это узнали?
Не так давно узнать что-то об исследуемом объекте с точки зрения химии можно было почти единственным способом – с помощью химического же воздействия. Множество наглядных примеров такого рода имеется в школьном курсе химии.
Суть этого способа проста. Например, к исследуемому раствору приливаем некий реагент. Если в результате выпадет приметный белый осадок (или, допустим, выделится газ со специфическим запахом), то на основании этого наблюдения можно сделать вполне определенный вывод о том, какое вещество находилось в растворе. Это и есть химический анализ. Подобные методы применяются и сейчас, но чтобы «копнуть глубже», обычного химического анализа становится недостаточно.
Любое исследование материального объекта строится сходным образом: мы начинаем наблюдать за изменением интересующих нас параметров объекта. Если объект не меняется или делает это медленно, можно воздействовать на него каким-либо образом и посмотреть отклик. Однако воздействовать на объект можно ведь не только химическими, но и физическими способами! Например, нагреть, осветить, облучить электронами... А потом посмотреть, что произойдет: как, к примеру, отразится излучение, какая его часть пройдет сквозь объект, какая часть поглотится и т.д. Полученная информация позволит сделать вполне определенные выводы относительно объекта изучения.
Физические методы исследования очень удобны потому, что они, в отличие от химических, не являются деструктивными, т.е. они не разрушают сам объект изучения. Например, чтобы узнать, сколько палладия содержится в нашем катализаторе Pd/Al2O3, требуется полностью растворить его в кислоте, а потом добавить специальный реагент, который свяжет палладий. Далее, взвесив осадок, можно рассчитать изначальное количество палладия. Однако в результате этих действий мы, естественно, «потеряем» наш образец.
Но вместо этого мы ведь можем взять тот же образец, облучить рентгеновскими лучами и изучить вылетевшие из образца электроны. В этом случае будут и «волки сыты, и овцы целы» – и содержание палладия узнаем, и образец сохраним. Очень удобно, информативно и быстро! Но это далеко не все, на что способны физические методы исследования.
Как уже говорилось, каждый конкретный тип атома имеет свой набор электронов. Причем электроны в атоме расположены не как попало, а на различных, строго определенных орбитах вокруг ядра, подобно планетам вокруг Солнца (конечно, это очень приближенная аналогия). Соответственно, каждый электрон притягивается к положительно заряженному атомному ядру со строго определенной силой.
Но самое замечательное заключается в следующем: во-первых, сила притяжения электронов к ядру зависит не только от типа самого атома (т. е. химического элемента), но и от того, с какими соседними атомами он связан. Проще сказать – в составе какого вещества он находится. Во-вторых, эту силу можно измерить! И узнать, какой химический элемент и в составе какого вещества в исследуемом объекте находится.
Например, в случае металлического палладия мы имеем дело только с атомами одного типа. А если атомы палладия связаны с атомами кислорода, то значит, перед нами оксид палладия – PdO. Сила притяжения электронов к ядру в атоме палладия в случае чистого металла будет иметь одну строго определенную величину, а в случае оксида палладия – другую, не менее строго определенную. Измерить эту силу на практике несложно. Нужно просто воздействовать на интересующие нас атомы, а потом оценить изменения, произошедшие с электронами в этих атомах. Но вот как это сделать?
Рентгеновское «око»
Рентгеновское излучение, как известно, хорошо проходит через вещество, но оно еще к тому же способно в буквальном смысле слова «выбивать» электроны из атомов. И этот процесс (по-научному – фотоэмиссия) происходит по очень простому закону сохранения энергии.
Энергия, которая содержится в рентгеновском излучении, частично тратится на преодоление той самой силы притяжения или связи, а остаток ее передается электрону в виде кинетической энергии (энергии движения). Так как мы обычно точно знаем энергию используемого рентгеновского излучения, то измерив скорости выбитых электронов (что сделать несложно), можем легко, простым вычитанием, определить величины энергии притяжения электронов к ядрам в атомах объекта исследования. На этом принципе и работает один современный физический метод исследования с непростым названием: рентгеновская фотоэлектронная спектроскопия (РФЭС).
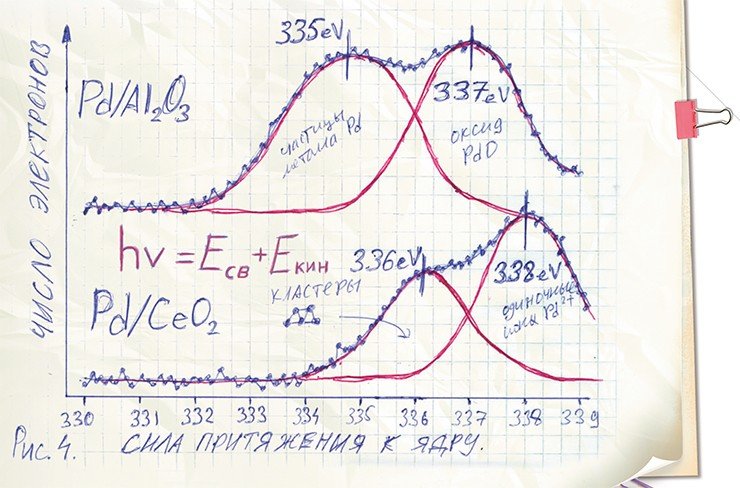
Возьмем, к примеру, уже полюбившийся нам катализатор Pd/Al2O3 и поместим его в прибор, где он будет облучаться рентгеновским излучением. Измерим скорость вылетевших из него электронов и рассчитаем величины сил притяжения электронов к ядрам в атомах, из которых состоит катализатор.
А теперь рассмотрим зависимость числа выбитых электронов от их энергии для выбранной орбиты электронов в атомах палладия, находящихся в нашем катализаторе Pd/Al2O3. (Подобная зависимость обычно называется энергетическим спектром.) Если перемещаться по шкале, на которой отмечена сила притяжения электронов к ядру, слева направо, то видно, что вначале наш график находится на нуле – это свидетельствует об отсутствии электронов с такой энергией притяжения (связи). Далее имеется подъем кривой, включающей два максимума, а затем спад.
Интерпретируя эти данные, мы можем говорить, что в катализаторе присутствуют электроны двух типов с различной энергией связи – 335 эВ и 337 эВ. Первая величина соответствует электронам металлического палладия, вторая – оксида палладия. Собственно говоря, абсолютные значения показателей нам здесь не важны – главное заключается в том, что эти величины отличаются. И это свидетельствует о том, что палладий в нашем катализаторе находится одновременно в двух состояниях – металлическом и оксидном (Ivanova et al., 2010; Slavinskaya et al., 2011).
Есть ли лучше?
Нужно признаться, что наш платиновый катализатор Pd/Al2O3 далеко не идеал. Если в качестве носителя использовать не оксид алюминия, а оксид церия CeO2, то можно добиться существенно большего каталитического эффекта в реакции окисления угарного газа.
Дело в том, что оксид церия обладает одним очень интересным свойством. Тогда как оксид алюминия имеет точно определенный состав – на два атома алюминия приходится три атома кислорода, оксид церия может менять количество кислорода в своей структуре. Он способен отдавать кислород при недостатке последнего в окружающей среде и, наоборот, присоединять, когда кислорода в избытке. Таким образом, этот оксид служит своего рода кислородным аккумулятором или буфером.
Если на такой носитель нанести палладий, то мы получаем катализатор Pd/CeO2, который способен настолько ускорить реакцию окисления СО, что она идет уже при комнатной температуре! Механизм работы этого суперкатализатора удалось выяснить совсем недавно, и сейчас мы попробуем в нем разобраться.
На энергетическом спектре этого катализатора так же, как у катализатора на оксиде алюминия, имеется два максимума, однако с несколько другими значениями энергии связи: 336 и 338 эВ. Было установлено, что первое значение соответствует самым крошечным частицам палладия, насчитывающим буквально несколько атомов (их называют кластерами). Эти кластеры на порядок мельче, чем частицы металлического палладия в Pd/Al2O3. Это уже даже и не совсем металл, но еще и не оксид – нечто промежуточное.
Второй максимум отвечает одиночным атомам палладия, которые как бы растворены в оксиде церия, впаяны в его структуру. Можно считать, что это тоже окисленный палладий, но он совершенно отличается от обычного оксида PdO.
Причина высокой активности платинового катализатора на оксид церия кроется в том, что молекулы угарного газа СО садятся на кластеры палладия, а молекулы кислорода – на вышеупомянутые одиночные атомы палладия. Таким образом, молекулы кислорода и угарного газа не мешают друг другу, как в случае предыдущего катализатора, где они «пользуются» одними и теми же атомами металла. Отсутствие такой конкуренции, по-видимому, настолько облегчает протекание реакции, что она начинается при комнатной температуре (Boronin et al., 2009).
Пример, приведенный в этой статье, касается лишь очень малой части всего многообразия научных изысканий в огромной области катализа. Тем не менее он наглядно демонстрирует, что в основе даже самых современных научных методов лежат достаточно простые принципы, логичные и понятные.
И чтобы понять, что происходит с отдельными атомами и молекулами в процессе протекания химической реакции, зачастую вполне достаточно базовых знаний по химии и физике. Надо только не пугаться сложных научных терминов, и тогда вы можете узнать много о скрытой от глаз, но такой увлекательной «социальной жизни» окружающего нас вещества.
Литература
Боресков Г. К. Гетерогенный катализ. М.: Наука, 1988. С. 189.
Boronin A. I., Slavinskaya E. M., Danilova I. et al. Investigation of palladium interaction with cerium oxide and its state in catalysts for low-temperature CO oxidation// Catalysis today. 2009. Vol. 144, Iss. 3—4. P. 201—211.
Ivanova A. S., Slavinskaya E. M., Gulyaev R. V. et al. Metal-support interactions in Pt/Al2O3 and Pd/Al2O3 catalysts for CO oxidation // Applied catalysis b-environmental. 2010.
V. 97, Iss. 1—2. P. 57—71.
Slavinskaya E. M., Stonkus O. A., Gulyaev R. V. et al. Structural and chemical states of palladium in Pd/Al(2)O(3) catalysts under self-sustained oscillations in reaction of CO oxidation // Applied catalysis a-general. 2011. Vol. 401, Iss. 1—2. P. 83—97.
В статье использованы иллюстрации автора