ПЦР-диагностика для персика и сливы
Под сухим агрономическим термином «косточковые и семечковые плодовые культуры» скрывается огромное вкусное разноцветье наших любимых фруктов. Но склонность к этим земным плодам питает и множество крупных и мелких вредителей, включая микроскопические грибки, чьи аппетиты приводят к большим потерям урожая. В 2018 г. в сектор «Агропромышленные и биотехнологии» научно-технологической программы «Большие вызовы» образовательного центра «Сириус» поступил запрос от сочинского Всероссийского научно-исследовательского института цветоводства и субтропических культур, в котором ученые поставили перед школьниками практическую задачу – провести видовую идентификацию фитопатогенных грибов, вызывающих бурую гниль плодов, и оценить их встречаемость в хозяйствах Краснодарского края и сопредельной территории
Все мы недаром любим фрукты и ягоды: это не просто вкусные, но и очень полезные продукты питания, содержащие большое количество сахаров, жиров, органических кислот, витаминов и других биологически активных соединений, а также макро- и микроэлементов, необходимых для нормального обмена веществ. Систематическое употребление в пищу этих плодов помогает предупредить авитаминозы, сердечно-сосудистые и желудочно-кишечные заболевания, а также способствует поддержанию иммунитета при инфекциях. Российский Минздрав рекомендует каждому из нас употреблять не менее 100 кг фруктов в год, что в пересчете на день равно примерно двум средним яблокам или почти трем персикам. Нужно ли говорить, что большинство россиян эту норму не выполняют…
ПЦР: КАК ЭТО РАБОТАЕТ ПЦР (полимеразная цепная реакция) – это метод, позволяющий неограниченно «размножать» фрагменты ДНК. По сути, он повторяет процесс репликации (удвоения ДНК), который идет при обычном размножении клетки. При проведении ПЦР двухцепочечная спираль ДНК разделяется, и к полученным цепочкам в определенных местах прикрепляются затравки-«праймеры». Праймеры служат «точкой отсчета», с которой фермент ДНК-полимераза начинает синтезировать комплементарную цепочку на одноцепочечном фрагменте.Обычно при проведении ПЦР выполняется несколько десятков циклов, и в каждом из них фрагмент ДНК удваивается, в результате чего в пробирке накапливается несколько миллионов копий. Какой именно фрагмент ДНК будет синтезироваться в ПЦР, зависит от праймеров. Их подбирают таким образом, чтобы последовательность была уникальна для исследуемого объекта. Если целевой ДНК в пробирке нет, то и реакция ПЦР не пойдет. Таким образом с помощью ПЦР можно определить в образце присутствие ДНК конкретного патогена
Кажется, что фрукты, в отличие от овощей и зелени, растут на дереве сами по себе. Но это, конечно, не так. Одна из проблем производителей – болезни, которые снижают продуктивность растений, ухудшают качество плодов, а иногда приводят к гибели целых массивов плодоносящих деревьев. Многие из наиболее опасных и трудно поддающихся лечению болезней плодовых культур вызываются микроскопическими фитопатогенными грибками-микомицетами.
Одной из самых распространенных и серьезных болезней косточковых и семечковых плодовых культур в мире является бурая гниль, или монилиоз, возбудителями которой служат грибки рода Monilia (Monilinia). Болезнь первоначально проявляется на бутонах, а затем распространяется на побеги и листья, которые поникают и засыхают, как будто обожженные, недаром эту болезнь называют еще «монилиальный ожог» (Holb et al., 2013). Инфицируются и плоды на всех стадиях развития, в большей степени – во время созревания. Мякоть плодов буреет и размягчается, становясь губчатой, многие из них опадают. Потери урожая могут достигать 80 %, и это касается урожая не только «на дереве», но и в хранилищах.
 К основным плодовым культурам, наиболее часто поражаемых монилиозами, относятся яблони, груши, персики и алыча, а также такие субтропические культуры, как фейхоа и цитрусовые (черноморское побережье Северного Кавказа является единственным в России регионом, где эти теплолюбивые растения произрастают в открытом грунте). Спектр возбудителей бурой гнили также широк. Считается, что наиболее часто деревья поражаются представителями трех видов монилий: M. fructigena, M. Laxa и M. fructicola. Последний характеризуется быстрым ростом и большим числом спор, к тому же этот вид наиболее изменчив и устойчив к фунгицидам (Papavasileiou et al., 2016).
К основным плодовым культурам, наиболее часто поражаемых монилиозами, относятся яблони, груши, персики и алыча, а также такие субтропические культуры, как фейхоа и цитрусовые (черноморское побережье Северного Кавказа является единственным в России регионом, где эти теплолюбивые растения произрастают в открытом грунте). Спектр возбудителей бурой гнили также широк. Считается, что наиболее часто деревья поражаются представителями трех видов монилий: M. fructigena, M. Laxa и M. fructicola. Последний характеризуется быстрым ростом и большим числом спор, к тому же этот вид наиболее изменчив и устойчив к фунгицидам (Papavasileiou et al., 2016).
Виды этого рода традиционно определяются на основе морфологических признаков самих грибов и их колоний, для чего образцы нужно культивировать в течение 10 дней (Leeuwen van et al., 2002). Но из-за сходства морфотипов различить таким способом разные виды не всегда удается. Трудоемкость, длительность и ненадежность – основные недостатки классических методов диагностики монилий.
Для контроля за изменчивостью популяционного состава этих фитопатогенных грибков и оценки риска их распространения требуется надежный, быстрый и не очень дорогостоящий метод диагностики. На сегодняшний день этим требованиям отвечают тест-системы на основе полимеразной цепной реакции (ПЦР), широко использующиеся для диагностики различных патогенов.
«Ловим» ДНК
 Участникам июльской проектной смены программы «Большие вызовы» в образовательном центре «Сириус» сотрудниками Института химической биологии СО РАН и ГНЦ ВБ «Вектор» был предложен проект по разработке ПЦР-тест-системы для определения грибов рода Monilia и выявления их встречаемости в плодово-овощных хозяйствах Краснодарского края. Подобного рода исследования в этом регионе ранее не проводились.
Участникам июльской проектной смены программы «Большие вызовы» в образовательном центре «Сириус» сотрудниками Института химической биологии СО РАН и ГНЦ ВБ «Вектор» был предложен проект по разработке ПЦР-тест-системы для определения грибов рода Monilia и выявления их встречаемости в плодово-овощных хозяйствах Краснодарского края. Подобного рода исследования в этом регионе ранее не проводились.
Школьники с помощью к. б.н. Л. С. Самариной и Е. В. Михайловой из ВНИИ Цветоводства и субтропических культур собрали образцы различных частей плодовых деревьев с видимыми признаками поражения грибками. Для анализа также использовались плоды, собранные сотрудниками института на территории Сочинского, Туапсинского, Апшеронского и Крымского районов Краснодарского края и черноморского побережья Абхазии. Объектами исследования стали косточковые (персики, сливы, алыча, абрикосы, черешни) и семечковые (яблони, груши, фейхоа, мандарины, мушмула) плодовые культуры.
Для определения грибов с помощью ПЦР-тест-системы была выбрана нуклеотидная последовательность митохондриального гена CytB, кодирующего цитохром В – один из железосодержащих мембранных белков, компонент дыхательной цепи. Тест-система была сконструирована таким образом, чтобы использовать для идентификации грибной ДНК как классический гель-электрофорез, так и «ПЦР в реальном времени» с использованием ДНК-зондов (короткоцепочечной ДНК).
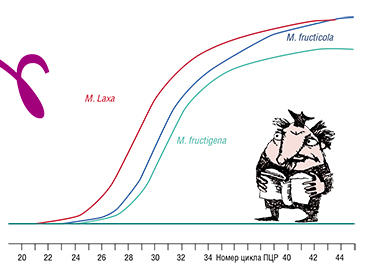
В нашем случае зонды должны специфично выявлять грибы рода Monilia, не давая положительного результата в случае схожих фитопатогенов. Поэтому путем сравнения всех известных вариантов гена CytB для Monilia и нескольких близкородственных грибов были выбраны участки ДНК, которые у разных родов наиболее сильно различаются. «Нацеленные» на эти фрагменты зонды «вылавливают» в пробирке только ДНК монилий. Различить же отдельные виды рода можно с помощью электрофореза по длине полученных ПЦР-продуктов.
Праймеры и ДНК-зонды были предварительно разработаны и синтезированы в ИХБФМ СО РАН методистом направления Е. Н. Ворониной. Под руководством М. Ю. Карташова ребята познакомились с такими важными понятиями, как специфичность и чувствительность тест-системы, узнали, какие факторы влияют на эффективность этой методики. Они научились выделять ДНК, проводить электрофорез и ПЦР и самостоятельно провели тестирование всех собранных образцов.
На основе результатов «ПЦР в режиме реального времени» в 25 из 106 образцов обнаружилась ДНК грибов рода Monilia. Все образцы с положительным результатом были подвергнуты электрофоретическому анализу для определения конкретных видов. Правильность видовой идентификации была позднее подтверждена путем секвенирования фрагментов ДНК грибов в ЦКП «Геномика» СО РАН (Новосибирск).

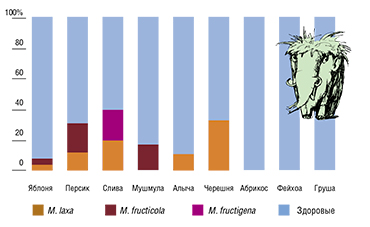
При реализации проекта были получены оригинальные данные по встречаемости фитопатогенных грибов рода Monilia в российских субтропиках. Оказалось, что на черноморском побережье Краснодарского края и сопредельной Абхазии бурая гниль наиболее часто поражает сливы, персики и черешни; этой болезнью страдают также алыча, яблони и мушмула.
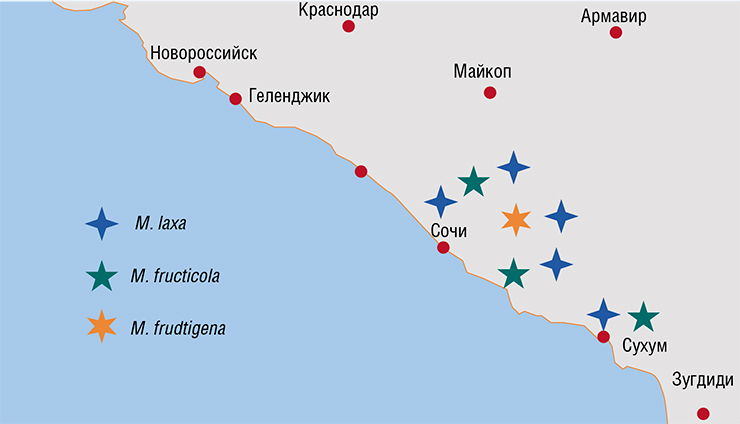
Здесь встречаются все три исследованных вида, но наиболее широко распространена M. laxa, что хорошо согласуется с данными литературы. На сливе, собранной на опытном поле ВНИИ цветоводства и субтропических культур вблизи г. Сочи, обнаружена ДНК M. fructigena.
Самым неожиданным результатом стал факт широкого распространения вида M. fructicola, обнаруженного на яблоках, персиках и мушмуле. Ранее этот фитопатогенный вид не был зарегистрирован в европейской части России, к тому же для нашей страны и Европейского Союза он является карантинным. Все эти новые данные делают мониторинг грибов рода Monilia очень актуальной задачей, а также требуют корректировки профилактических мер и принятия программ по фунгицидной обработке пораженных садов.

Таким образом, при участии в первом серьезном исследовании одного из важнейших патогенов сельскохозяйственных культур Черноморского побережья школьникам не только удалось поработать в настоящей лаборатории и освоить под руководством опытных наставников современную технологию ПЦР-диагностики, но и почувствовать вкус нового открытия.
Литература
Глик Б., Пастернак Д. Молекулярная биотехнология. Принципы и применение: Пер. с англ. М.: Мир, 2002. 589 с.
Котина Е. ПЦР в реальном времени, или Кое-что из жизни цианобактерии // Химия и жизнь – XXI век. 2009. № 3. С. 10–13.
Патрушев Л. И. Полимеразная цепная реакция и другие способы амплификации ДНК и сигналов // Искусственные генетические системы. Т. 1: Генная и белковая инженерия. М.: Наука, 2004. С. 192–223.
Ребриков Д. В., Саматов Г. А., Трофимов Д. Ю. ПЦР в реальном времени. 4-е изд. М.: БИОМ. Лаборатория знаний, 2013. 223 с.
Смольякова В. М. Болезни плодовых пород юга России. Краснодар: Весть, 2000. 192 с.
В публикации использованы фото В. В. Власова










