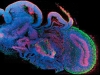
Органы «из пробирки»
В мире неуклонно возрастает число исследований в области клеточных технологий, направленных на создание тканей и органов для использования в регенеративной медицине.
В десятку выдающихся открытий прошлого года, по версии журнала «Science», попали результаты трех работ по формированию «в пробирке» трехмерных органоподобных структур почки, печени и головного мозга человека. Эти достижения стали закономерным итогом быстрого развития раздела клеточной биологии, занимающегося управляемой дифференцировкой плюрипотентных стволовых клеток человека, которые потенциально способны давать все типы клеток взрослого организма
Плюрипотентными называют стволовые клетки, способные дифференцироваться (превращаться) в разные типы специализированных клеток: клетки кожи, мышц, нервной ткани и т. п. Именно из таких эмбриональных стволовых клеток и формируются органы будущего организма во время беременности. Чтобы решить труднейшую задачу по искусственному выращиванию из стволовых клеток полноценных органов, нужно разработать и осуществить сложнейший алгоритм действий, начиная от создания необходимых физических условий и заканчивая введением в нужной концентрации и в нужное время комплексов ростовых факторов. Эта глобальная задача еще окончательно не решена.
До недавнего времени исследователи умели только дифференцировать стволовые клетки человека в определенные клеточные типы: например, в нейральные (клетки нервной ткани), кардиальные (клетки тканей сердца), васкулярные (клетки сосудов) и многие другие. С появлением подобных методов стало возможным решать ряд медицинских задач. Например, американская биотехнологическая компания ACT («Advanced Cell Technology») проводит клинические испытания дифференцированных производных плюрипотентных стволовых клеток человека, предназначенных для лечения возрастных изменений сетчатки глаза – макулярной дегенерации и дистрофии Штаргардта.
Следующий шаг – получение не просто клеток, а органоподобных трехмерных структур. Первой «мишенью» исследователей стала почка. Попытки получить предшественники почечных клеток делались и ранее, однако сформировать зрелые клетки почки из них не удавалось. Успех сопутствовал группе ученых из Испании и США (Xia et al., 2013).
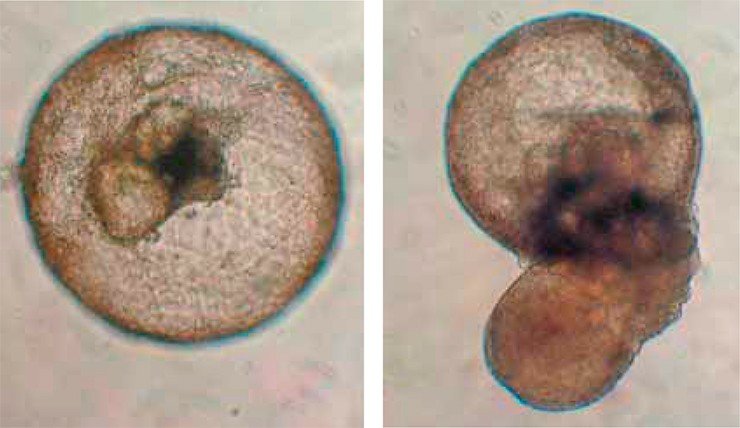
Сначала исследователи получили почечные клетки-предшественники. Для этого эмбриональные стволовые клетки человека дифференцировали в клетки мезодермы (среднего зародышевого листка), из которого развивается скелет, мышцы, кровеносные сосуды и почка. Затем, добавляя в культуральную среду ростовые факторы, необходимые для естественного развития почки, получили клетки-предшественники почечной ткани с соответствующим набором клеточных маркеров. Эти клетки, в свою очередь, культивировали в смеси с эмбриональными почечными клетками мыши, в результате чего сформировались зрелые клетки человеческой почки. Совместно с мышиными клетками они сформировали трехмерную «химерную» структуру, напоминающую мочеточник.
Несмотря на то что полученные почечные структуры нельзя назвать настоящей человеческой почкой, результаты этого эксперимента значительно расширили потенциальные возможности регенеративной медицины. У ученых появилась возможность моделировать заболевания почек и тестировать медицинские препараты. В качестве первого шага новым методом были получены трехмерные почечные структуры из стволовых клеток пациентов с поликистозом почек.
Группе японских исследователей впервые удалось получить не просто функциональные дифференцированные клетки, а органоид человеческой печени, снабженный кровеносными сосудами (Takebe et al., 2013). Для этого использовались так называемые индуцированные плюрипотентные стволовые клетки (ИПСК), которые получают из обычных соматических клеток путем их «репрограммирования» в недифференцированное состояние.
Сначала были получены предшественники гепатоцитов (клеток печени человека), которые далее культивировали совместно с эндотелиальными клетками, выделенными из пупочной вены, и мезенхимальными стволовыми клетками. Эндотелиальные клетки образуют сеть кровеносных сосудов, а мезенхимальные – выделяют гормоноподобные вещества, влияющие на клетки-предшественники гепатоцитов. В итоге сформировалась трехмерная васкуляризированная структура, близкая к эмбриональной ткани человеческой печени.
В качестве теста эту структуру поместили под кожу лабораторным мышам с подавленным иммунитетом, у которых не развивается реакция отторжения на чужеродный трансплантат. Внедренный органоид нормально интегрировался в окружающую ткань, и уже через двое суток его кровеносные сосуды соединились с сосудами подопытного животного. Проведенный спустя два месяца молекулярно-генетический анализ показал, что печеночные клетки стали более зрелыми и даже оказались способны метаболизировать ряд соединений, подобно зрелым клеткам человеческой печени.
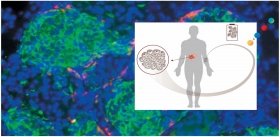
Исследователи показали, что трансплантация почечного органоида в область брыжейки иммунодефицитным мышам с нарушением функции печени повышает их выживаемость. Таким образом, эта технология очень перспективна не только для исследовательских целей и тестирования фармакологических препаратов, но и в заместительной клеточной терапии.
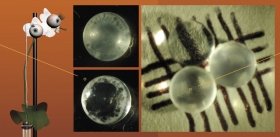
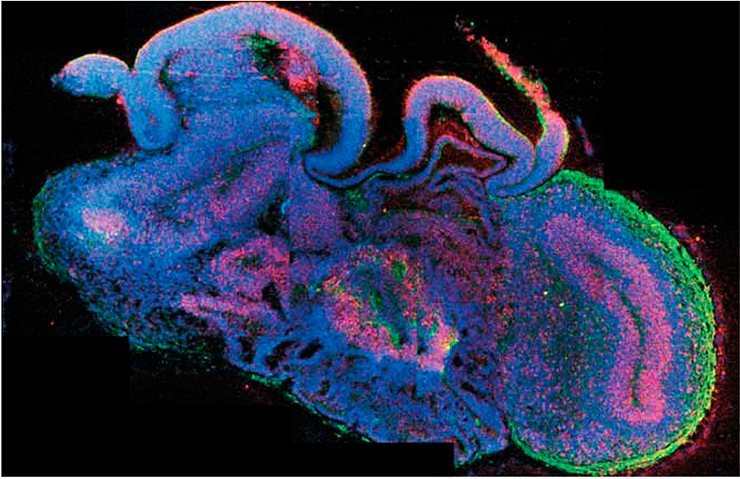
Коллективу австрийских и британских ученых удалось получить из индуцированных плюрипотентных стволовых клеток трехмерные структуры, названные церебральными (мозговыми) органоидами (Lancaster et al., 2013). Плюрипотентные стволовые клетки сначала дифференцировали в клетки-предшественники нервной ткани, а затем их культивировали в специальном гелеобразном матриксе, помещенном во вращающийся биореактор с ростовой средой.
Сформированные церебральные органоиды представляли собой нейроэпителиальную ткань, которая окружала заполненную жидкостью полость, напоминающую желудочек мозга. Своего максимального размера – до 4 мм в диаметре – эти структуры достигали через два месяца культивирования. К этому времени они состояли из различного типа тканей, таких как кора головного мозга, сосудистое сплетение, сетчатка и мозговые оболочки. Однако у них не было кровеносных сосудов, поэтому они имели ограниченный размер и могли поддерживаться в условиях биореактора лишь в течение десяти месяцев.
Иследователи применили свой метод для изучения микроцефалии – заболевания, при котором у человека редуцирован размер мозга, что сопровождается умственной отсталостью. При создании церебральных органоидов из плюрипотентных стволовых клеток таких пациентов было обнаружено, что в процессе клеточной дифференцировки образуется значительно меньшее количество клеток-предшественников нервной ткани. Соответственно, и сформированные церебральные органоиды оказались меньшего размера. По-видимому, аналогичное явление служит причиной недоразвития мозговых структур у пациентов. Добавим, что метод церебральных органоидов позволит исследовать и ряд других нейродегенеративных заболеваний.
Несмотря на то что все полученные трехмерные структуры нельзя назвать полноценными органами, результаты экспериментов значительно расширили потенциальные возможности регенеративной медицины. Подобные органоиды можно использовать для тестирования медицинских препаратов, а также для моделирования заболеваний, связанных с нарушением эмбрионального развития, поскольку они, как правило, трудно воспроизводятся на животных.
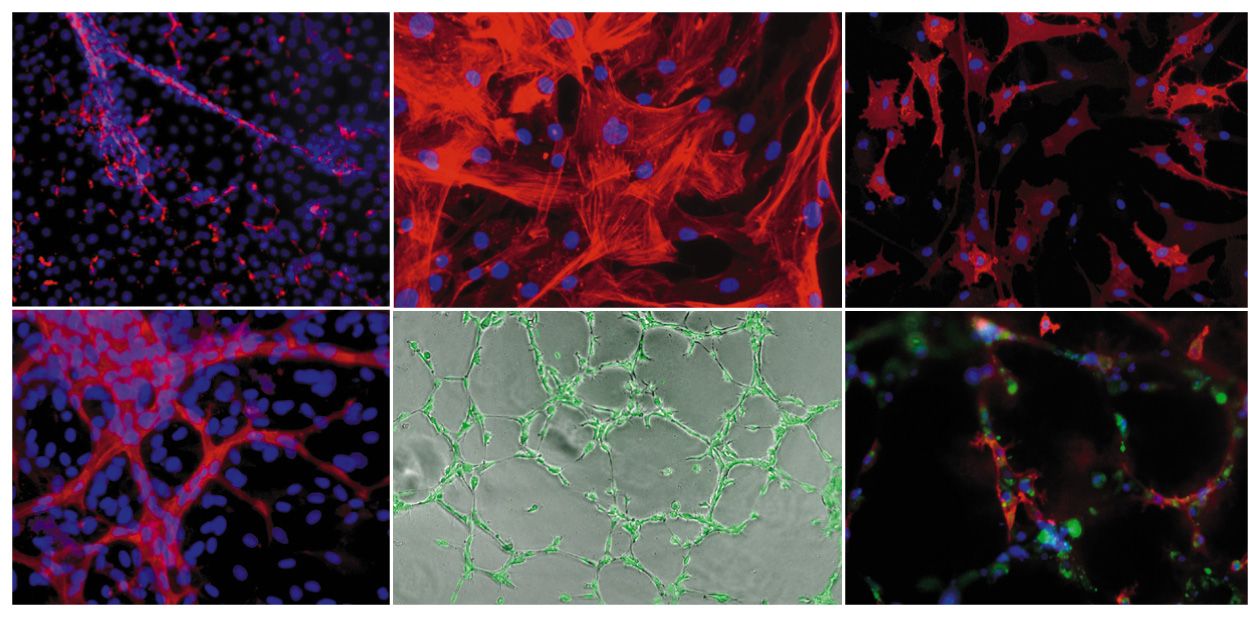
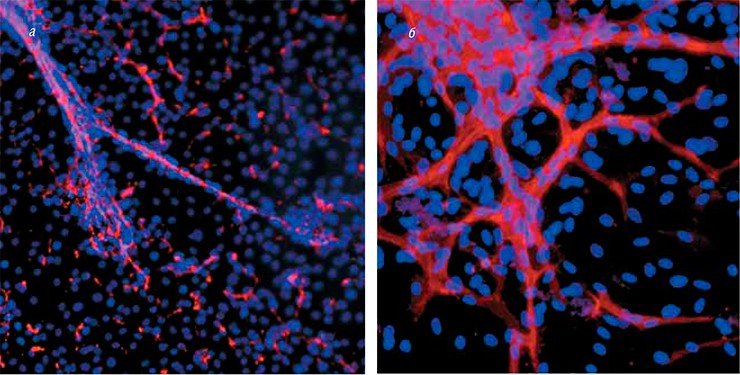
Работы в этом направлении ведутся и в России. Например, разработкой тканеинженерных подходов для регенеративной медицины сосудов занимается группа новосибирских исследователей из Института цитологии и генетики и Института химической биологии и фундаментальной медицины СО РАН, Новосибирского научно-исследовательского института патологии кровообращения им. академика Е. Н. Мешалкина.
Актуальность этой темы связана с тем, что в наши дни быстро растет число больных с патологией кровеносных сосудов, причем лечение подобных заболеваний зачастую предусматривает замену сосудов на аутологичные (донорские) либо синтетические. Оба эти варианта имеют свои ограничения, альтернативой является использование тканеинженерных протезов сосудов.
В Новосибирске был разработан протокол получения специфических васкулярных клеток, которые способны формировать кровеносные сосуды из биопсийного материала, а также из плюрипотентных стволовых клеток человека, подвергнутых направленной дифференцировке. Полученные сосудистые клетки детально исследуются с помощью различных функциональных и молекулярно-генетических тестов. Такими охарактеризованными клетками заселяются синтетические поверхности. Особое внимание при этом уделяется подбору компонентов сосудистого внеклеточного матрикса и ростовых факторов, влияющих на скорость клеточного деления, миграцию и дифференцировку различных типов васкулярных клеток.
Полученный в результате сосудистый протез по своим свойствам близок к натуральному кровеносному сосуду. Функционирование подобных трансплантатов в живом организме планируется оценивать на модельных животных.
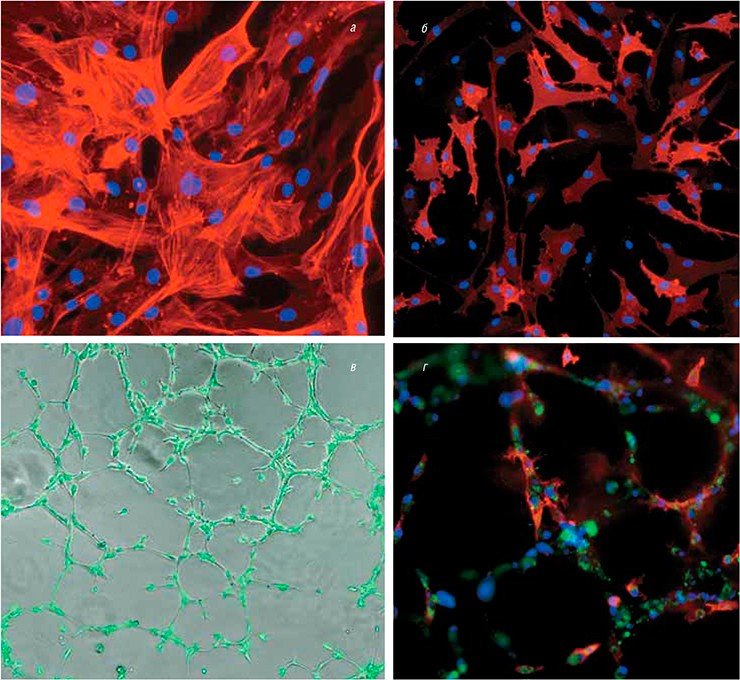
Еще одно направление работ связано с исследованием статуса Х-хромосом в линиях ИПСК человека, полученных из обычных соматических клеток, и их дифференцированных производных. Эпигенетический феномен инактивации одной из двух Х-хромосом у женщин является важным фактором, который необходимо учитывать при планировании клеточной терапии с ИПСК. Поэтому в ходе работы исследователи разрабатывают способы управления статусом Х-хромосом при репрограммировании соматических клеток в стволовые, а также при их последующей дифференцировке. Полученные результаты будут использованы для характеристики свойств полученных линий индуцированных плюрипотентных стволовых клеток и подбора спектра надежных методов, позволяющих проводить отбор этих линий для биомедицинских исследований.