Клеточная терапия сахарного диабета:
новый прорыв – новые надежды
Сахарный диабет – самое распространенное эндокринное заболевание в мире: по данным Международной федерации диабета сегодня им страдает более 300 млн человек. Болезнь не обошла и семью Дугласа Мелтона, руководителя одной из исследовательских групп, занимающихся разработкой клеточной терапии диабета. Их работы вошли в список наиболее выдающихся научных достижений 2014 г. по версии журнала Science.
Сахарный диабет – болезнь, характеризующаяся стойким увеличением в крови концентрации глюкозы, – сегодня входит в тройку самых распространенных видов заболеваний. При диабете 2-го типа бета-клетки островков Лангерганса в поджелудочной железе вырабатывают пептидный гормон инсулин, который регулирует уровень глюкозы в крови, но ткани организма теряют чувствительность к нему. Этот наиболее распространенный (до 80—90 % случаев) тип сахарного диабета, который называют еще инсулинонезависимым, развивается преимущественно в пожилом возрасте и характеризуется относительно легким течением.
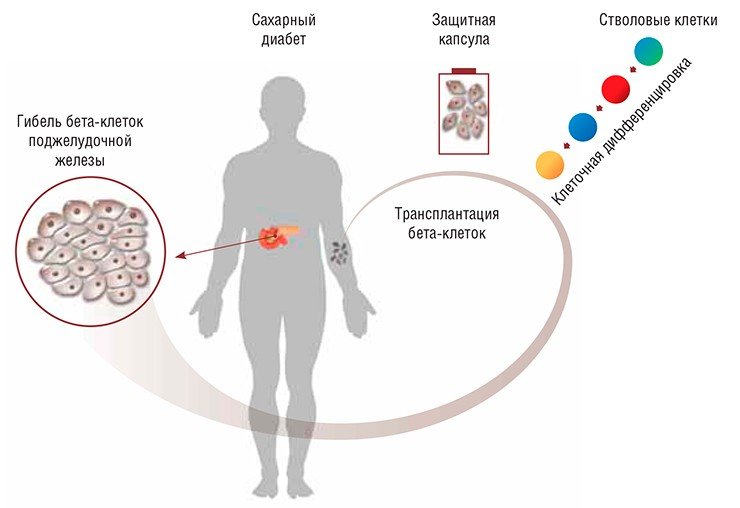 При диабете 1-го типа наблюдается аутоиммунное поражение бета-клеток поджелудочной железы, вырабатывающих гормон инсулин. Такой тип диабета приводит к полной пожизненной зависимости от инъекций инсулина – на данный момент это практически единственный способ терапии этого тяжелого заболевания. Больной должен постоянно следить за уровнем глюкозы в крови и в зависимости от «скачков» уровня глюкозы самостоятельно корректировать дозы инсулина. При этом в любом случае у больного развиваются осложнения: дисфункция почек и сердечно-сосудистой системы, поражение глаз (диабетическая ретинопатия), некротическое поражение тканей. Результатом является существенное снижение качества жизни больных, а зачастую инвалидность и ранняя смерть.
При диабете 1-го типа наблюдается аутоиммунное поражение бета-клеток поджелудочной железы, вырабатывающих гормон инсулин. Такой тип диабета приводит к полной пожизненной зависимости от инъекций инсулина – на данный момент это практически единственный способ терапии этого тяжелого заболевания. Больной должен постоянно следить за уровнем глюкозы в крови и в зависимости от «скачков» уровня глюкозы самостоятельно корректировать дозы инсулина. При этом в любом случае у больного развиваются осложнения: дисфункция почек и сердечно-сосудистой системы, поражение глаз (диабетическая ретинопатия), некротическое поражение тканей. Результатом является существенное снижение качества жизни больных, а зачастую инвалидность и ранняя смерть.
Говоря об альтернативной возможности терапии сахарного диабета, надо упомянуть о существовании достаточно успешной практики пересадки донорских бета-клеток. Их получают из тканей эмбрионального происхождения или берут у доноров посмертно. После такой трансплантации больной на несколько лет становится независимым от инъекций инсулина. Проблемы такого вида терапии связаны с качеством и количеством донорского материала, не говоря уже о тканевой несовместимости реципиента и донора. Ведь после пересадки больные вынуждены принимать препараты, подавляющие активность иммунной системы, к тому же через какое-то время все равно происходит отторжение трансплантата. Еще одно препятствие – проблемы этического характера, связанные с использованием тканей эмбрионов.
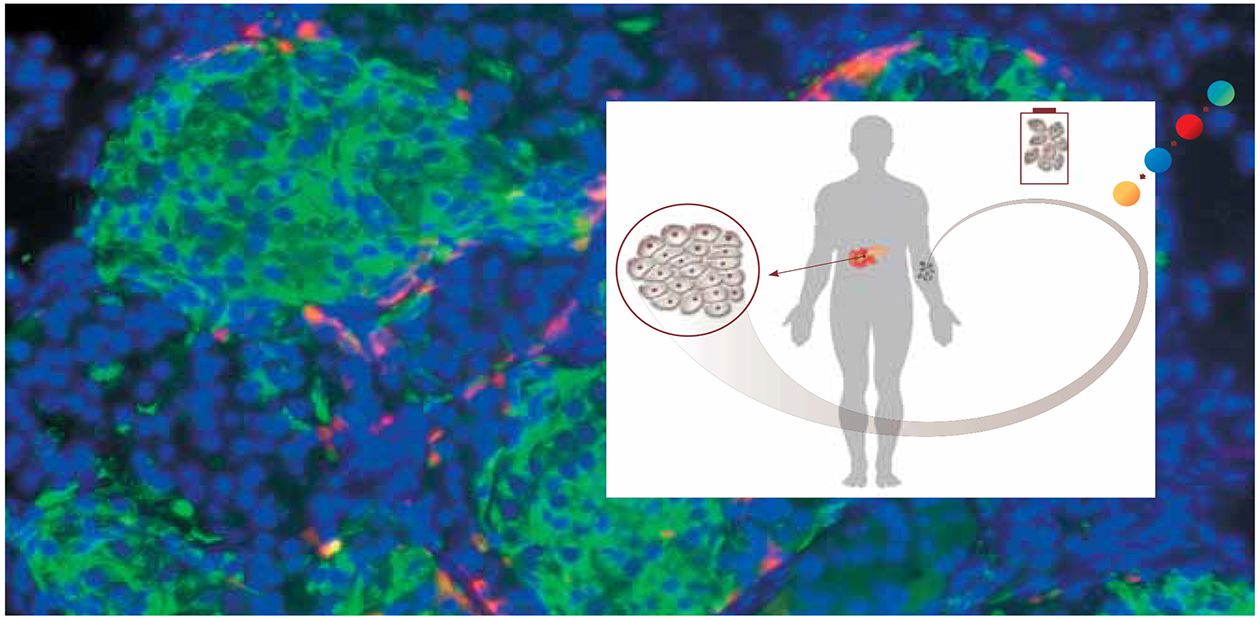
Выход из ситуации в принципе есть: бета-клетки поджелудочной железы можно получать in vitro (в лабораторных условиях) из клеточных культур. Их источником могут быть плюрипотентные стволовые клетки человека, т. е. «первичные» недифференцированные клетки, из которых происходят все клетки наших органов и тканей. Для получения бета-клеток можно использовать как стволовые клетки эмбрионов, так и индуцированные плюрипотентные стволовые клетки, которые получают из обычных соматических клеток взрослого человека путем их «перепрограммирования».
Технологии получения индуцированных плюрипотентных стволовых клеток известны и достаточно хорошо разработаны. Но вот получить из них зрелые бета-клетки гораздо сложнее, так как для этого необходимо буквально в чашке Петри воспроизвести сложнейшие процессы, происходящие во время эмбрионального развития человека, используя сигнальные молекулы и химические соединения, направляющие развитие клеток в нужную сторону.
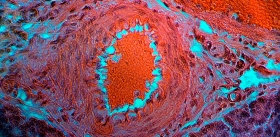
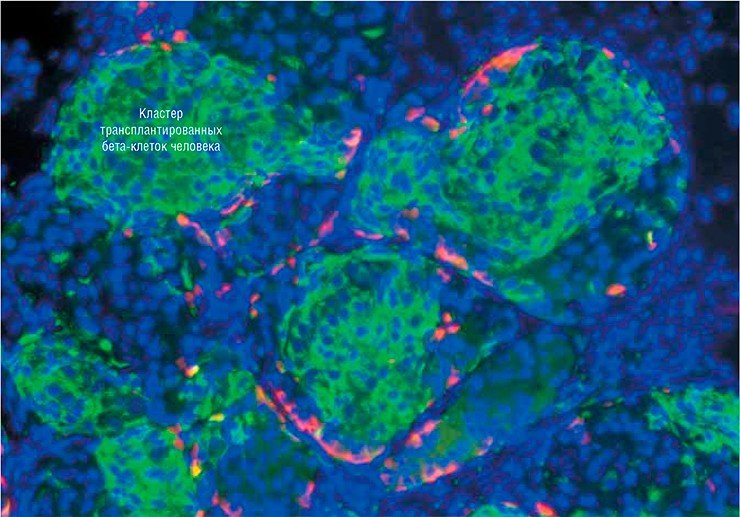 В список выдающихся научных исследований прошлого года, опубликованный журналом Science, как раз и вошли работы двух исследовательских групп: из Гарвардского института стволовых клеток (США) и Медицинской школы Массачусетского университета в Вустере (США) под руководством Д. Мелтона и из Университета провинции Британская Колумбия (Канада) и компании BetaLogics (США) под руководством Т. Кифера, посвященные технологиям получения in vitro бета-клеток поджелудочной железы (Pagliuca et al., 2014; Rezania et al., 2014). Взяв в качестве исходного материала стволовые клетки человеческого эмбриона, в итоге ученые получили клетки, проявляющие все основные качества бета-клеток. То есть в них «работали» определенные гены и присутствовали специфические белки, так что эти клетки были способны продуцировать инсулин в ответ на присутствие глюкозы. Пересаженные лабораторным мышам из чистой линии, служащей экспериментальной моделью сахарного диабета, эти клетки нормально функционировали и компенсировали первоначальное отсутствие инсулина!
В список выдающихся научных исследований прошлого года, опубликованный журналом Science, как раз и вошли работы двух исследовательских групп: из Гарвардского института стволовых клеток (США) и Медицинской школы Массачусетского университета в Вустере (США) под руководством Д. Мелтона и из Университета провинции Британская Колумбия (Канада) и компании BetaLogics (США) под руководством Т. Кифера, посвященные технологиям получения in vitro бета-клеток поджелудочной железы (Pagliuca et al., 2014; Rezania et al., 2014). Взяв в качестве исходного материала стволовые клетки человеческого эмбриона, в итоге ученые получили клетки, проявляющие все основные качества бета-клеток. То есть в них «работали» определенные гены и присутствовали специфические белки, так что эти клетки были способны продуцировать инсулин в ответ на присутствие глюкозы. Пересаженные лабораторным мышам из чистой линии, служащей экспериментальной моделью сахарного диабета, эти клетки нормально функционировали и компенсировали первоначальное отсутствие инсулина!
Огромное преимущество этого метода в том, что с его помощью можно получать функционирующие бета-клетки в довольно большом количестве. В финале процесса из одного флакона для культивирования объемом 0,5 л можно получить до 300 млн клеток – этого числа вполне достаточно, чтобы компенсировать недостающий инсулин у одного человека весом около 70 кг. Или для проведения скрининга среди 30 тыс. отдельных химических соединений – потенциальных лекарственных веществ, если использовать клетки не по «прямому назначению», а для фармакологических исследований.
Безусловно, описанные технологии нуждаются в совершенствовании. В частности, необходима разработка детальных протоколов получения бета-клеток из индуцированных плюрипотентных стволовых клеток. Это позволит не только в любой период жизни пациента и практически из любых клеток его собственного организма при необходимости получить необходимое количество бета-клеток, но и разрешит проблему иммунологической несовместимости донора и реципиента.
Однако остается другая проблема: поскольку диабет 1-го типа – это аутоиммунное заболевание, то новые бета-клетки будут опять атакованы иммунной системой, как когда-то свои «родные» клетки пациента. Поэтому пересаженные клетки надо научиться защищать! Только в этом случае подобное лечение может стать доступным и широко применимым, ведь использование иммунодепрессантов оправдано только в самых тяжелых случаях.
Сейчас разрабатываются разные варианты подобной защиты. Например, можно покрыть клетки специальным гидрогелем, однако в этом случае их будет гораздо труднее удалить из организма при необходимости. К тому же пока не существует способа воспрепятствовать их инкапсуляции (заключению в соединительнотканную оболочку) подобно другим чужеродным телам в организме, что перекроет пересаженным клеткам приток питательных веществ. Сейчас идет поиск химических веществ, пригодных для изготовления гидрогеля, который не будет вызывать такого эффекта.
Другое решение предложили конкуренты команды Мелтона – американская компания ViaCyte. Суть его в том, чтобы поместить пул незрелых бета-клеток внутрь тела в биологически совместимой оболочке: предполагается, что предшественники бета-клеток будут там постепенно созревать и успешно функционировать. Такое устройство уже создано; более того, в компании уже запустили первый этап клинических испытаний. Но хотя результаты аналогичных исследований на животных выглядят многообещающе, есть опасения относительно эффективности этого способа.
В любом случае, уже сейчас имеющиеся технологии внушают надежду, что проблема лечения сахарного диабета будет в скором времени решена. Использование бета-клеток, произведенных из стволовых клеток пациентов, даже при условии постоянного приема иммунодепрессантов может стать огромным облегчением для больных тяжелыми формами диабета, которые постоянно сталкиваются с опасными для жизни изменениями уровня сахара в крови.
Литература
Pagliuca F. W., Melton D. A. How to make a functional β cell. //Development. 2013. V. 140. N. 12. P. 2472—83. DOI: 10.1242/dev.093187.
Pagliuca F. W., Millman J. R., Gürtler M., et al. Generation of functional human pancreatic β cells in vitro. //Cell. 2014. V. 159. N. 2. P. 428—39. DOI: 10.1016/j.cell.2014.09.040.
Rezania A., Bruin J. E., Arora P., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. //Nat. Biotechnol. 2014. V. 32. N. 11. P. 1121—33. DOI: 10.1038/nbt.3033.
Ledford H. Stem-cell success poses immunity challenge for diabetes. //Nature. 2014. V. 514. N. 7522. P. 281. DOI: 10.1038/514281a.