Литий в лидерах: химические источники тока
Современная жизнь немыслима без разнообразных портативных электронных устройств и электротранспорта. Для них необходимы особые источники электропитания – высокоэнергоемкие, легкие, долговечные, безопасные, дешевые и надежные. В настоящее время этим требованиям лучше всего удовлетворяют литий-ионные аккумуляторы, причем благодаря интенсивным исследованиям их электрохимические характеристики постоянно улучшаются
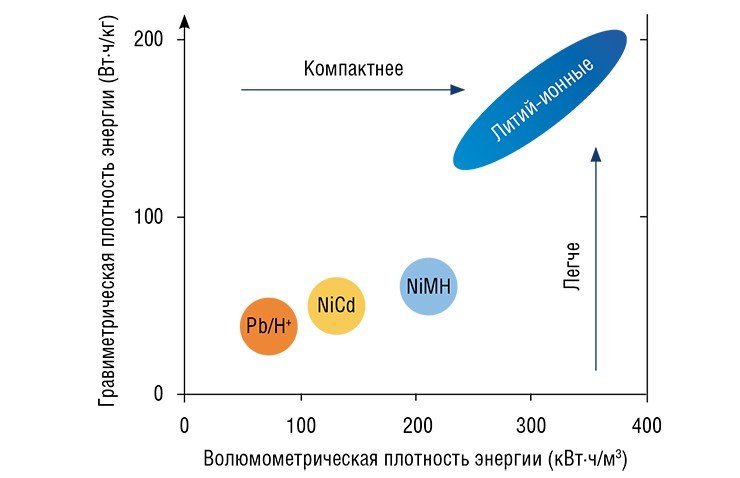
В наше время стремительного технического прогресса не должен удивлять тот факт, что буквально на протяжении одной человеческой жизни произошла быстрая «эволюция» источников тока и химических аккумуляторов. Громоздкие свинцовые батареи сменились на более компактные и энергоемкие никель-кадмиевые, а затем – никель-металло-гидридные. Наконец, в начале 1970-х гг. была реализована давняя инженерная мечта: созданы химические источники тока на основе самого электрохимически активного восстановителя – металлического лития. Использование этого металла позволило значительно увеличить рабочее напряжение и удельную мощность источника тока.
Однако работа первых аккумуляторов с анодом из этого металла была сопряжена с опасностью взрыва и возгорания в результате разгерметизации и могла приводить к короткому замыканию вследствие образования дендритов лития и их прорастания до катода. Многочисленные попытки модифицировать материал анода не увенчались успехом, и лишь в начале 1990-х гг. была разработана принципиально новая и более безопасная разновидность литиевых батарей – литий-ионные аккумуляторы (ЛИА) – с графитовым анодом.
Литий «с плюсом»
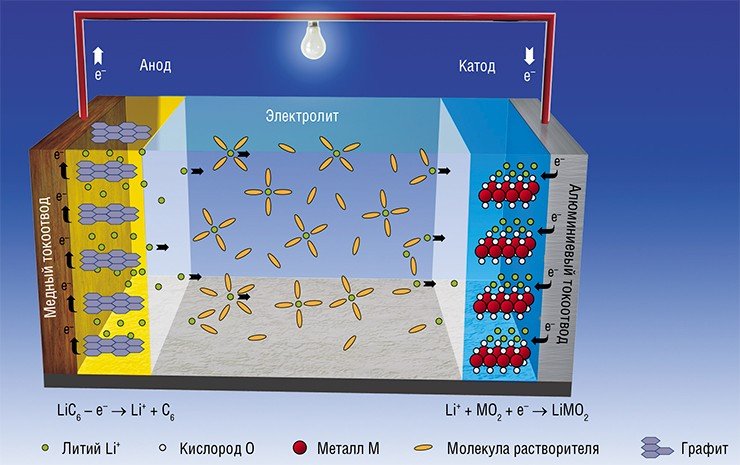
Функционирование литий-ионных аккумуляторов основано на способности материалов, обладающих определенной структурой (так называемой «матрицей»), к обратимому внедрению ионов лития. Такие матрицы выступают в качестве «хозяина», который предоставляет свободные пространства своей структуры «гостю» – иону лития Li+. В процессе заряда (разряда) аккумулятора эти ионы уходят из одной матрицы и внедряются в другую. Выходное электрическое напряжение таких систем чуть меньше, чем металлических литиевых, зато уровень безопасности существенно выше.
По основным техническим характеристикам ЛИА существенно превосходят «конкурентов». Так, по сравнению с никель-металло-гидридными аналогами у ЛИА вдвое больше электрохимическая емкость и почти втрое выше плотность аккумулируемой энергии и удельная мощность. ЛИА выдерживает очень высокие токи разряда, что важно для использования в мощных переносных электроинструментах. Саморазряд составляет всего 2—5 %, а количество циклов «заряда – разряда» без потери емкости у них в 4—6 раз выше, чем у предшественников. ЛИА в меньшей степени подвержены и так называемому эффекту памяти – их можно начать перезаряжать в любой момент, не дожидаясь полной разрядки.
В последующие два десятилетия было осуществлено электролитическое разложение воды на водород и кислород, а также электроосаждение металлов из растворов. Путем электролиза расплавленных солей выдающийся английский ученый Х. Дэви выделил в чистом виде щелочные металлы, в том числе и литий.
С помощью химических источников тока был сделан ряд важнейших физических открытий, включая явление магнитного действия электрического тока (Ампер, 1820), закон пропорциональности тока и напряжения (Ом,1827), тепловыделение при прохождении тока (Джоуль, 1843), электромагнитную индукцию (Фарадей, 1931). А русский ученый Б. Якоби, еще в 1834 г. сконструировавший первый электродвигатель, спустя четыре года создал важнейшее практическое приложение электрохимии – гальванопластику
Но у ЛИА есть и недостатки, прежде всего – высокий риск взрывного разрушения при перезаряде или перегреве. Поэтому во все бытовые аккумуляторы встраивают электронную схему, которая ограничивает напряжение заряда. Кроме того, ЛИА полностью выводятся из строя в результате глубокой разрядки, да и вообще эти аккумуляторы пока еще довольно дороги.
Однако следует заметить, что литий-ионные технологии находятся только в начале пути, в то время как их «конкуренты» вплотную приблизились к своему теоретическому пределу. Будучи уже внедренными в промышленное производство, ЛИА до сих пор являются предметом интенсивного изучения, направленного на улучшение их электрохимических характеристик. Совершенствованию подвергаются все три компонента системы: электролит, катод и анод.
От анода до катода
Основными требованиями к электродным материалам, от которых зависит энергоемкость системы, в случае ЛИА являются способность к обратимой интеркаляции* ионов лития; смешанная электронно-ионная проводимость, обеспечивающая достаточную скорость интеркаляции; химическая устойчивость при циклировании.
Аноды современных ЛИА в основном изготавливают из графита, а катоды – из литированных оксидов переходных металлов. В 1979 г. Джон Гуденаф (University of Texas, Austin, США) впервые продемонстрировал электрохимическую ячейку с напряжением 4 В, в которой в качестве катода был использован кобальтат лития (LiCoO2), а в качестве анода – металлический литий. Это было наиболее значимым событием и сделало создание ЛИА реальностью. Прототип электрохимической ячейки с углеродным анодом и катодом из кобальтата лития был создан в 1985 г. японцем А. Йошино (Ashi Kasei Corp.), а через шесть лет японская компания Sony выпустила первые коммерческие ЛИА с углеродным анодом.
В наши дни для анодов в исследовательской практике применяют разнообразные углеродные материалы, а в промышленности – только некоторые специальные, такие как «мезоуглеродные мезобусы» (MCMB) – продукт карбонизации пековых смол, выпускаемый японской компанией Osaka gas Co.
В конце прошлого века внимание исследователей привлекли также материалы на основе оксида олова. При использовании их в качестве анода литий внедряется не собственно в оксид, а в металлическое олово, образующееся при первоначальной катодной поляризации электрода. Теоретическая емкость аккумулятора с таким анодом почти втрое выше, чем с углеродным, однако недостатком всех металлических анодов является заметное изменение их объема при внедрении лития. Проблему удалось решить благодаря применению кремния, из которого стали изготавливать аноды в виде тонких аморфных пленок или наноструктурированных композитов с углеродом.
Сегодня емкость ЛИА лимитируется в основном свойствами катодных материалов. В качестве последних используют различные по структуре соединения. Наиболее широкое распространение получил упомянутый выше кобальтат лития LiCoO2: его слоистая структура обеспечивает двумерную диффузию ионов лития. Преимуществами этой системы являются высокое рабочее напряжение (4 В), относительная простота синтеза, высокая электронно-ионная проводимость, что способствует циклированию при больших плотностях тока, и т. д.
Однако у LiCoO2 имеется и немало недостатков: токсичность, невысокая практическая удельная емкость (около половины от теоретической), недостаточная термическая и структурная устойчивость и др. К тому же кобальтовое сырье довольно дорого.
В последние годы стали использоваться и другие соединения со слоистой структурой, содержащие ионы нескольких переходных металлов (кобальта, никеля, марганца), практическая емкость которых в полтора раза превосходит емкость кобальтата лития.
Следующий класс катодных материалов для ЛИА составляют оксиды со шпинельной структурой **, основным представителем которых является литий-марганцевая шпинель LiMn2O4. В отличие от слоистой, шпинельная структура обеспечивает трехмерную диффузию ионов лития. Однако свободный объем, доступный для ионов лития, невелик, что ограничивает скорость диффузии и снижает мощность электрохимической ячейки в целом. Недостатками LiMn2O4 являются также заметная растворимость марганца в электролите и структурная неустойчивость при напряжениях ниже 3 В.
В последние годы большое внимание уделяется исследованиям катодных материалов с каркасной структурой на основе соединений лития и переходных металлов (Fe, Mn, Co, Ni) с полианионами, такими как (PO4)3–, (AsO4)3– и др. Фаворит в данной группе – железо-фосфат лития LiFePO4, характеризующийся высоким разрядным напряжением (3,4 В по отношению к Li/Li+), наличием плато на зарядно-разрядных кривых и высокой теоретической разрядной емкостью ~ 170 мА•ч•г–1. LiFePO4 отличается высокой структурной и химической устойчивостью при циклировании, а также нетоксичностью и доступностью. Однако у него очень низкая электронная и литий-ионная проводимость и, как следствие, неудовлетворительная циклируемость при больших токах.
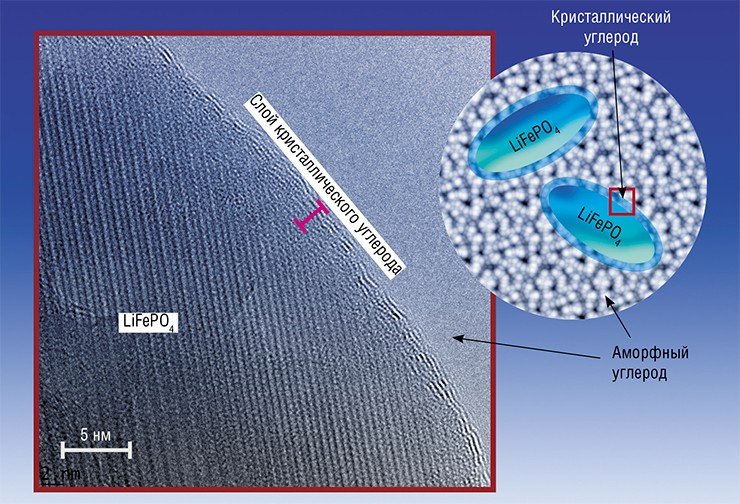
Однако в ходе многочисленных исследований были разработаны разнообразные методы для улучшения свойств LiFePO4. Например, нанести на поверхность частиц слой высокопроводящего углеродного покрытия, в результате чего электронная проводимость материала может возрасти многократно (Ravet, Armand, 1999). Этому же способствует, например, и допирование материала катода алюминием, цирконием и другими металлами (Chiang, 2002).
Время российского «нано»?
В 2000 г. японский исследователь А. Ямато (Sony) первым показал, что в наноразмерном состоянии железофосфат лития способен работать даже при высоких скоростях заряда-разряда.На сегодняшний день наноразмерные композиты железо-фосфата лития и углерода практически не уступают по электрохимическим показателям другим известным катодным материалам. Поэтому они являются перспективными для использования в гибридных энергетических системах и крупногабаритных аккумуляторах для электромобилей, где большое значение имеют цена и безопасность.
С чем же связано улучшение мощностных характеристик электродных материалов, особенно с низкой электронно-ионной проводимостью, при повышении их дисперсности?
Уменьшение размеров частиц до наноуровня увеличивает поверхность контакта электрод/электролит и способствует уменьшению диффузионных расстояний для ионов лития в твердой фазе. Это приводит к ускорению ионного транспорта и, соответственно, процессов заряда-разряда в аккумуляторах. Меньшие по размеру частицы также лучше адаптируются к объемным изменениям в ходе внедрения и экстракции ионов лития, что способствует повышению структурной стабильности материалов. С увеличением дисперсности наблюдается и повышение электрохимической емкости.
Одним из перспективных методов получения наноматериалов является так называемая механическая активация ***. Именно такой простой, быстрый, энергосберегающий и экологически чистый твердофазный метод разработали в Институте химии твердого тела и механохимии СО РАН (Новосибирск) для получения наноразмерного (< 50 нм) катодного материала на основе композита железо-фосфата лития LiFePO4 с углеродом. Особенность этого способа в том, что синтез наночастиц LiFePO4 из исходных реагентов идет параллельно с модифицированием поверхности этих частиц углеродом. В результате образовавшийся композит приобретает высокую проводимость и удельную разрядную емкость (~160 мА • ч • г–1).
Этот метод лег в основу проекта ОАО «Роснано» по созданию первого в России производства катодного материала на базе ОАО «Новосибирский завод химконцентратов». Этот материал будет поставляться по программе импортзамещения в компанию «Лиотех» – совместное предприятие «Роснано» и китайской компании Thunder SkyGroup, одного из мировых лидеров в серийном производстве аккумуляторов для электротранспорта. В 2011 г. компания «Лиотех» запустила в Новосибирске первый в России и крупнейший в мире завод по производству литий-ионных аккумуляторов.
В сфере литий-ионных аккумуляторов все происходит на удивление быстро. Так, кобальтат лития был предложен в качестве катодного материала в 1986 г., а уже в начале 1990-х гг. на его основе стали производить первые ЛИА.
Синтезировать железо-фосфат лития сложнее, к тому же он выходил на уже имеющийся рынок, однако в данном случае от идеи до внедрения прошло не более десятка лет. И сразу же после этого многие автомобилестроительные компании, такие как Toyota, Renault, General Motors, Nissan и др., объявили о запуске проектов по производству электромобилей.
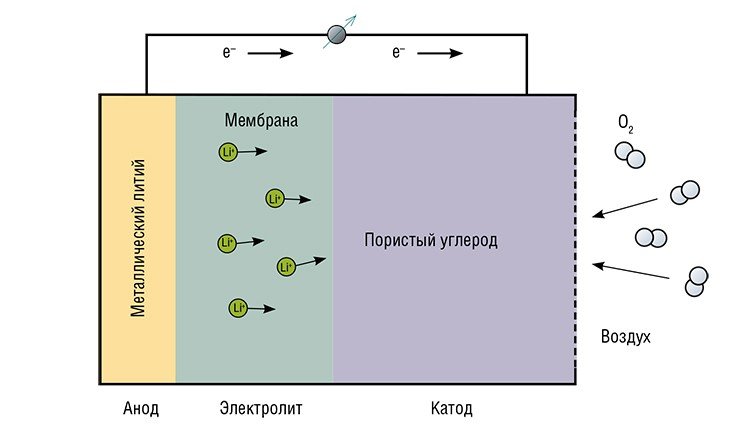
Сейчас разрабатываются новые виды литиевых аккумуляторов – литий-серные и литий-воздушные. При использовании кислорода воздуха в качестве катода плотность аккумулирования энергии может увеличиться в 5—10 раз! Рекордные значения удельной энергии и емкости, характерные для литий-воздушных аккумуляторов, а также низкая стоимость реагентов объясняют большой практический и экономический интерес к этой теме. В последние годы в США на эти исследования тратятся миллиарды долларов, в России же это направление только начинает развиваться.
Но самый удивительный вклад в разработку ЛИА собираются внести... биологи. Ученые из Массачусетского технологического института показали, что с помощью генетически модифицированных бактериофагов – вирусов, инфицирующих бактерии и безвредных для человека, – можно наладить процесс самосборки рабочих электродов литиевого аккумулятора. Сначала бактериофаги покрывают свою оболочку аморфным фосфатом железа, способным обратимо принимать и отдавать ионы лития, а затем селективно присоединяются к углеродным нанотрубкам, обладающим высокой электропроводностью (Belcher, 2010).
Аккумулятор, собранный на основе таких «вирусных» электродов с разветвленной структурой, продемонстрировал мощность и емкость на уровне самых современных аккумуляторов, а также стабильную работу как минимум при 100 циклах перезарядки. Производство такого литиевого аккумулятора обходится значительно дешевле, чем обычного аккумулятора, к тому же оно не требует использования токсичных химических веществ – все процессы идут в водной среде при комнатной температуре. Благодаря процессу самосборки электродам можно придать самую разнообразную форму еще на стадии синтеза, что позволит в будущем встраивать их в различные портативные электронные устройства. И, судя по всему вышеизложенному, это будущее должно наступить очень скоро!
Литература
Avvakumov E., Senna M., Kosova N. Soft Mechanochemical Synthesis: A Basis for New Chemical Technologies//Kluwer Acad. Publ. 2001.
Kosova N. V., Devyatkina E. T., Petrov S. A. Fast and low cost synthesis of LiFePO4 using Fe3+ precursor// J. Electrochem. Soc. 2010. Vol. 157, No. 11. P. 1247—1252.
* Электрохимическая интеркаляция – обратимое внедрение ионов или молекул в вещества со слоистой, туннельной или канальной структурой, происходящее под действием электрического тока
** Плотно упакованная кубическая структура, элементарная ячейка которой содержит восемь «молекул» типа AB2O4. В ней имеется два вида пустот, окружение которых состоит из четырех или шести ионов кислорода
*** Механическая обработка твердых тел, в результате которой происходит измельчение и пластическая деформация веществ. При этом ускоряются процессы массопереноса и происходит эффективное смешение компонентов на атомном уровне, что обеспечивает ускорение химического взаимодействия









