Мозговой кровоток как гидродинамическая модель
Каждый шестой человек с геморрагическим инсультом – кровоизлиянием в мозг, вызванным разрывом сосудов, – умирает в машине скорой помощи. Риск кровоизлияния, приводящего к летальному исходу или тяжелым неврологическим последствиям, остается высоким даже после успешной операции на сосудах. Приблизиться к пониманию законов движения крови в сосудах головного мозга и методов управления кровотоком удалось благодаря тесному сотрудничеству практикующих нейрохирургов с «фундаментальными» механиками и математиками. Результаты гидродинамического моделирования позволили полностью контролировать ход оперативного вмешательства на сосудах головного мозга, что радикально изменило сам принцип проведения нейрохирургических операций и привело к значительному снижению риска возникновения послеоперационных осложнений
Сосудистые заболевания центральной нервной системы являются одной из основных причин смертности во всем мире, включая Россию.
Нейрохирурги давно имеют дело с артериальной аневризмой (выпячиванием стенки артериальных сосудов) и артериовенозной мальформацией (спутанным сосудистым клубком). Традиционное лечение таких патологий состоит в их полном «выключении» из кровотока путем открытой либо эндоваскулярной (внутрисосудистой) операции на мозге. Но даже после успешного хирургического вмешательства у пациента иногда случается кровоизлияние, что значительно увеличивает риск летального исхода.
Ежегодно в России примерно у 15 человек из каждых 100 тысяч происходит разрыв аневризмы (выпячивания стенки сосудов мозга), и около 15 % таких больных погибает, не успевая доехать до больницы. У половины пациентов кровоизлияние повторяется в течение последующих шести месяцев – в этом случае смертность достигает 70 %Почему же две совершенно одинаковые операции заканчиваются для пациентов по-разному? Можно ли прогнозировать правильный ход и последствия оперативного вмешательства, чтобы минимизировать его риски? За ответами на эти вопросы нейрохирурги Сибирского федерального биомедицинского исследовательского центра им. акад. Е. Н. Мешалкина обратились к специалистам новосибирского Института гидродинамики им. акад. М. А. Лаврентьева СО РАН. Так начались мультидисциплинарные исследования механизма гемодинамики головного мозга, результаты которых легли в основу новых методов лечения сосудистых аномалий.
«Выключаем» из кровотока
Эра сосудистой нейрохирургии началась около ста лет назад, когда американский нейрохирург Уолтер Э. Денди провел первую операцию по «выключению» аневризмы с помощью специальной клипсы. В 1980-х гг. на смену открытым операциям на мозге пришла эндоваскулярная нейрохирургия. Начало ей положил советский профессор Ф. А. Сербиненко, придумавший специальные баллоны-катетеры – «воздушные шарики», которые через прокол в шее «добирались» до аневризмы. В 1970 г. профессор Сербиненко с помощью этой методики успешно провел операцию на внутренней сонной артерии. Позже «баллоны Сербиненко» стали применяться и для лечения аневризм и артериовенозных мальформаций (АВМ).
Сегодня для лечения аневризм используются совершенно другие методы: в аневризматическую полость внедряют конструкции (спирали, стенты) из различных металлов, позволяющие достигать хорошего результата с минимальным числом осложнений. И хотя частота таких аномалий достаточно высока – из 100 тыс. человек примерно у 15 есть артериальная аневризма головного мозга, – их можно диагностировать с помощью МРТ, а благодаря современным технологиям пациент возвращается домой уже через пару дней после операции.
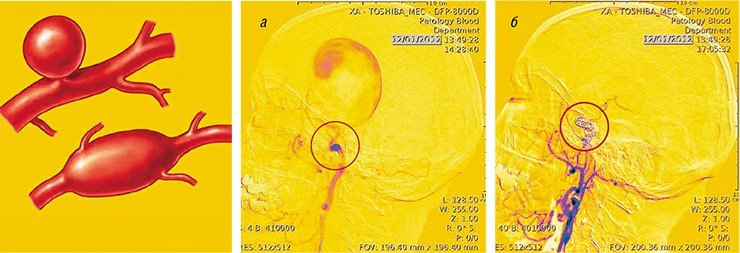
Сложнее обстоит дело с артериовенозной мальформацией, которая образуется во время эмбрионального развития из-за ошибки в формировании сосудов. Диагностировать ее на раннем этапе сложно, так как до определенного возраста (обычно до 30 лет) эта аномалия никак себя не проявляет. Суть современного лечения АВМ заключается в эмболизации (закупорке) патологических сосудов, для чего в них вводят специальные вещества, «заклеивающие» аномалию. Раньше фрагменты АВМ «отключали» по очереди, но недавно появился препарат оникс (ONYX), который позволяет полностью выключать аномалию при его введении в один из сосудов. К сожалению, частота кровоизлияний во время и после такой операции оказалась высокой (до 16,7 %).
Сотрудничество нейрохирургов с гидродинамиками началось с поиска ответов на вопросы, касающиеся лечения именно этой патологии. Дело в том, что через АВМ проходит очень большой объем крови, но до мозга он не доходит, сбрасываясь в вены, – так аномалия «обкрадывает» головной мозг. Чтобы восполнить потери, рядом с аномалией формируются новые сосуды, которые и питают мозг. И когда врач полностью выключает АВМ, весь этот кровеносный поток устремляется по этим сосудам, которые оказываются не готовыми к такому напору и поэтому рвутся. Так возникают послеоперационные кровоизлияния. Поэтому первая задача, которую надо было решить, это определить объем аномалии, который допустимо «выключить» за одну операцию – 10, 15 или 30 %.
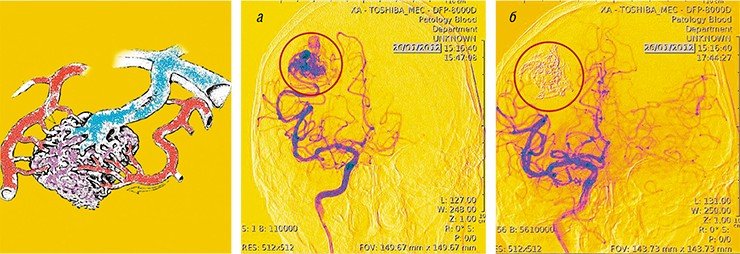
Следующая задача – определить, с каких сосудов начинать эмболизацию. Клубок АВМ состоит из сосудов разного диаметра: здесь и большие фистулы (трубки диаметром несколько миллиметров), и среднесосудистая часть (сосуды диаметром меньше 1 мм), и крохотные сосудистые «ниточки». В сосудах разного диаметра кровь течет с разной скоростью. Нейрохирурги чаще начинают с мелких сосудов, но правильно ли это?
Практика показывает, что в течение полугода после процедуры эмболизации кровоснабжение полностью перестраивается. Однако это происходит не у всех: у 2 % пациентов за это время случается кровоизлияние. Так можно ли узнать, когда закончится процесс перестройки гемодинамики у конкретного пациента?
Кровь существует в движении
Рассматривать работу головного мозга как механическую – очень непривычно. Только задумайтесь: весь сложный каскад молекулярных, биологических и физиологических действий, которые позволяют нам поднять руку при встрече, отвечают за наше понимание точных наук и любовь к музыке, – все это запускается кровотоком в головном мозге!
Кровь – очень загадочная субстанция, существующая только в движении. Останавливается она лишь тогда, когда нарушается целостность сосудов: малейший перебой в кровоснабжении одной из зон головного мозга приводит к отключению жизненно важных функций, потере речи и частичному параличу. К счастью, мозг очень пластичен и способен включать резервные сосудистые системы, но и врачам нужно действовать быстро, а для этого они должны понимать, как идут процессы гемодинамики в норме и при патологии.
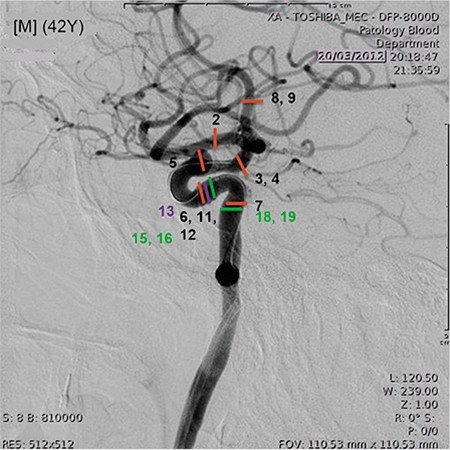 В общем виде задача, которая встала перед математиками, звучала так: есть две операции, которые проведены по одному сценарию и с похожими результатами, но с разными клиническими исходами. Требуется определить причины возникших осложнений и найти параметры, которые определяют безопасность хирургического лечения у пациентов со случайно выявленными аномалиями сосудов головного мозга.
В общем виде задача, которая встала перед математиками, звучала так: есть две операции, которые проведены по одному сценарию и с похожими результатами, но с разными клиническими исходами. Требуется определить причины возникших осложнений и найти параметры, которые определяют безопасность хирургического лечения у пациентов со случайно выявленными аномалиями сосудов головного мозга.
Важно, что в дискуссиях между учеными и медиками сразу было достигнуто понимание, что создать модель, описывающую течение крови в сосудах головного мозга, невозможно без точных экспериментальных клинических данных, которые можно получить только путем мониторинга во время операции. В противном случае можно будет написать интересные академические статьи о компьютерном моделировании, которые вряд ли окажут заметное влияние на хирургическую практику.
Для мониторинга гемодинамики был приобретен прибор ComboMap известного американского производителя Volcano. Вопреки первоначальному скепсису, ученым удалось усовершенствовать его «родное» программное обеспечение. В конечном счете на свет появился новый, во многом оригинальный приборно-измерительный комплекс для эндоваскулярного интраоперационного мониторинга.
КРОВОТОК КАК НЕЛИНЕЙНЫЙ ОСЦИЛЛЯТОР Параметры кровотока, которые оцениваются во время нейрохирургических операций, – это параметры очень сложной системы, представляющей собой пульсирующий нестационарный поток жидкости в трубке-сосуде. Упругие стенки сосуда помогают течению, а сам он погружен в гелеобразное вещество мозга, помещенного в твердую мозговую оболочку и черепную коробку. На графиках «давление – скорость» видно, что пульсирующая динамика этих показателей представляет собой почти периодическую функцию. Почти, потому что на самом деле здесь накладывается сразу несколько периодических процессов, включая пульсацию сердца, ритм дыхания и т. д. Упрощенно говоря, весь человек – это система связанных осцилляторов (колебательных контуров).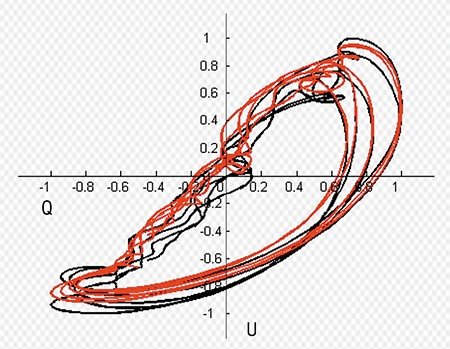 Гармонический осциллятор – удобная модель, которая широко используется во многих разделах физики. Но нелегко понять, как связаны между собой колебательные процессы в сердечной, дыхательной и пищеварительной системе. Новосибирские исследователи решили начать с простой модели единого осциллятора. Ведь если в здоровом организме все работает «как часы», система в действительности не должна быть слишком сложной.
Гармонический осциллятор – удобная модель, которая широко используется во многих разделах физики. Но нелегко понять, как связаны между собой колебательные процессы в сердечной, дыхательной и пищеварительной системе. Новосибирские исследователи решили начать с простой модели единого осциллятора. Ведь если в здоровом организме все работает «как часы», система в действительности не должна быть слишком сложной.
Для моделирования кровотока в головном мозге было решено использовать дифференциальное уравнение, описывающее нелинейный осциллятор Ван дер Поля—Дуффинга. Фактически речь идет о достаточно простой математической модели поведения нелинейной пружинки, которая по-разному работает на растяжение и сжатие, да к тому же погружена в вязкую среду. Несмотря на внешнюю простоту, это уравнение имеет много решений в зависимости от того, какими свойствами обладает упругая среда, как устроена сама пружина. В нашем случае нужно учесть свойства всех компонентов системы: и пульсирующий поток крови, и упругие стенки сосуда, и среду, которая его окружает.
Оказалось, что модель нелинейного осциллятора действительно хорошо описывает и предсказывает поведение кровотока в окрестностях сосудистой аномалии. Расчеты показали, что патологические отклонения происходят не произвольным путем: имеется определенный набор образцов «поведения», при которых периодичность колебаний нарушается, возникают сбои кровотока.
Конечным итогом исследования должно стать построение исчерпывающей математической модели гемодинамики головного мозга. Описывать кровоток в головном мозге с помощью уравнений – фантастически сложная задача, выходящая за рамки возможностей современной математики, гидродинамики и механики. Но никто и не ждет от ученых создания супермодели, которая объяснит все. Сейчас работы ведутся в рамках нескольких моделей, созданных на основе клинических экспериментальных данных, а не абстрактных рассуждений
Очень тонкий, волосовидный датчик прибора позволяет с высокой точностью измерять давление и скорость потока крови в сосудах диаметром более 1,5 мм. Измерения проводили до и после операции в одних и тех же точках, расположенных на различных расстояниях от сосудистой аномалии, что дало возможность качественно и количественно оценить параметры кровотока. На основе этих данных была создана математическая модель кровотока головного мозга, которая позволяет предсказывать поведение сосудов в разных условиях. Аппарат диаграмм «давление – скорость» и «расход – поток энергии» позволяет характеризовать тип сосудистой аномалии по гемодинамическим параметрам и оценивать эффективность непосредственно по ходу операции. На сегодня такой мониторинг является уникальным не только в России, но и в мире.
Риск сведен к минимуму
Конкретным результатом работы врачей и ученых-гидродинамиков стала разработка нового алгоритма эндоваскулярного лечения АВМ. На примере локальной математической модели АВМ были рассмотрены различные гипотетические сценарии ее эмболизации. Оказалось, что если сначала выключить мелкие «составляющие» аномалии, то значительно увеличивается поток по фистуле и соседним здоровым сосудам. Последующее же выключение самого большого сосуда может сделать нагрузку на эту «резервную» систему непосильной. Поэтому начинать эмболизацию нужно с самого крупного сосуда, а потом ждать, пока кровяной поток не перераспределится. Это означает, что при аномалиях средних и крупных размеров лечение должно быть поэтапным, причем за одно вмешательство не следует выключать более 60% объема АВМ.
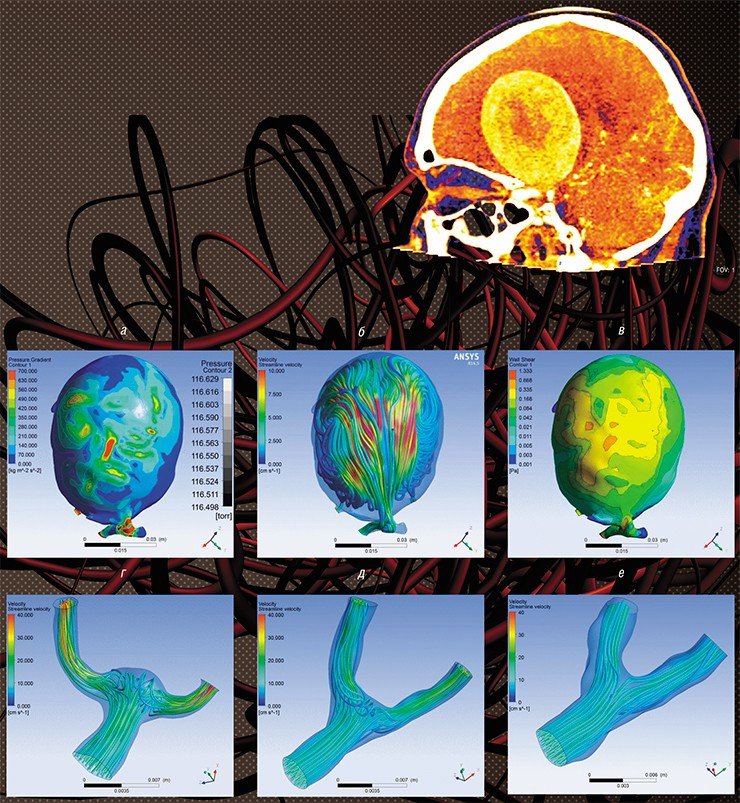
Неожиданный результат дала оценка временного интервала, достаточного для перестройки кровообращения после оперативного вмешательства. Обычно перерыв между операциями составлял около полугода, но исследования на модели показали, что кровоток перестраивается за неделю. Это очень важно, потому что, как упоминалось выше, за столь длительный срок у 2 % пациентов происходят кровоизлияния в мозг; недельный перерыв сводит риск к минимуму.
С появлением гемодинамической модели удалось решить и некоторые проблемы, связанные с лечением пациентов с несколькими аневризмами. Оценив поведение параметра «скорость-давление» для каждой аневризмы, можно легко определить, от какой из них нужно избавиться в первую очередь. Благодаря мониторингу во время операций есть возможность сразу оценивать результаты действий и менять тактику по ходу операции. Например, если установки одного стента окажется недостаточно, можно поставить спираль или дополнительный стент. В результате пациент избегает повторной операции.
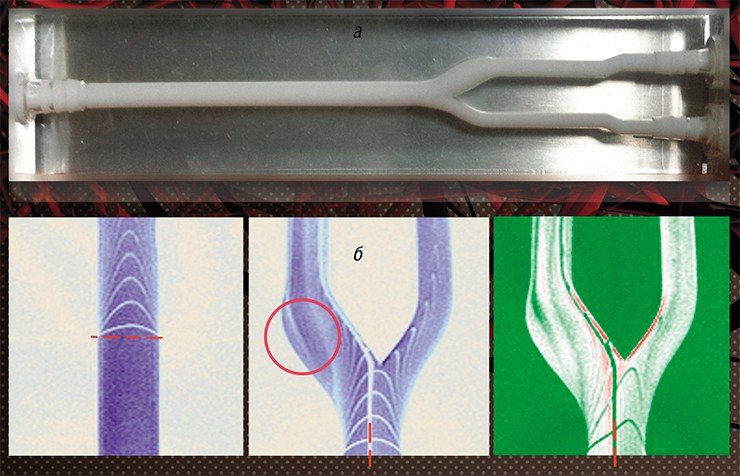
Математики помогли нейрохирургам решить и проблему, связанную с так называемыми бифуркационными аневризмами – сосудистыми «тройниками», которые образуются на месте расхождения сонных артерий. Даже после казавшегося успешным лечения такие аномалии очень часто возвращаются в исходное состояние. Оказалось, что все дело в величине угла между сосудами. Когда аневризму закрывают спиралями, в этих местах могут образовываться дочерние вихревые потоки, которые вызывают сужение артерий, незаметное на ангиограмме. Поток крови по сосудам затрудняется, а у шейки аневризмы – увеличивается, и аномалия снова начинает расти. Чтобы избежать этого осложнения, нужно ставить стенты таким образом, чтобы паразитные потоки не образовывались.
Своими результатами новосибирские специалисты делятся с коллегами по всему миру. Но нужно понимать, что у разных клиник свой формат работы, у разных хирургов – свои предпочтения. Есть приверженцы открытых операций на головном мозге, кто-то просто удаляет аномалию. Результат операции также можно оценивать по-разному. Ведь есть еще качество жизни, на котором может отразиться даже шрам на голове. Так, в США после успешно проведенной открытой операции по удалению АВМ около 14 % американцев теряют работу, а после эндоваскулярных – только 2–3 %. И любые разработки, которые увеличивают эффективность и снижают риск этих операций, будут всегда востребованы.
Понять законы движения крови в сосудах головного мозга и научиться управлять ими – задача амбициозная, решить которую силами специалистов одного профиля невозможно. Результаты работ по мониторингу нейрохирургических операций стали основой для развития и других исследовательских направлений.
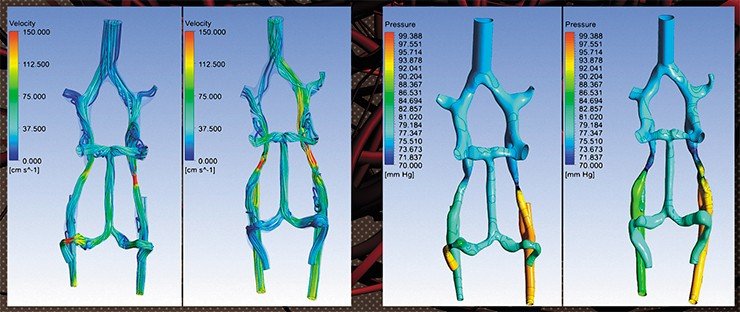
Так, при содействии Международного томографического центра СО РАН (Новосибирск) была создана физическая модель сосудов из упругих материалов, имитирующих реальные ткани. С помощью специального насоса в эти «сосуды» нагнетается жидкость (вода+глицерин), имитирующая кровь, а для визуализации движения используется магнитно-резонансный томограф. Эксперименты на подобных моделях позволяют оценить последствия различных воздействий на сосуды, которые невозможно осуществить при реальных операциях. Например, проверить, как увеличится скорость кровотока, если повысить давление на 10 мм ртутного столба. Такие исследования интересны с точки зрения и фундаментальной, и прикладной гидродинамики, так как дают много информации о течении жидкости в упругих средах. Математическое моделирование таких сложных систем – дело будущего, в России же подобные эксперименты больше нигде не проводятся.
Еще одно направление работ связано с изучением влияния гемодинамики на физиологические и интеллектуальные возможности человека. Совместно со специалистами из Института цитологии и генетики СО РАН (Новосибирск) была создана компьютерная модель сети кровеносных сосудов головного мозга ряда лабораторных животных для мониторинга различий параметров гемодинамики у разных особей одного и того же вида с разными физиологическими и поведенческими характеристиками. Все расчеты проводятся на базе Информационно-вычислительного центра Новосибирского государственного университета.
Сегодняшний день замечателен тем, что у ученых есть возможность решать такие мультидисциплинарные задачи. Все «перегородки» между различными областями знаний стираются, в результате чего создается коллектив, который может проводить полный цикл исследований – от получения клинических данных и их обработки до создания математических моделей, и «возвращения» результатов в виде рекомендательных протоколов в клинику. Очень важно, что у молодежи эти работы вызывают огромный интерес. Например, в Институте гидродинамики СО РАН проходит специализацию много перспективных студентов из НГУ, которых привлекает характер работы, связанный с решением «живых задач», имеющих непосредственный выход на практику.
Литература
Кривошапкин А. Л., Панарин В. А., Орлов К. Ю. и др. Алгоритм предупреждения гемодинамических кровоизлияний при эмболизации церебральных артериовенозных мальформаций // Бюллетень СО РАМН. 2013. Т. 33. № 6. С. 65–73.
Панарин В. А., Орлов К. Ю., Кривошапкин А. Л., и др. Использование гидродинамических расчетов в выборе сценария эмболизации церебральной артериовенозной мальформации c наличием фистульного компонента // Патология кровообращения и кардиохирургия. 2012. Т. 16. № 3. С. 39–43.
Чупахин А. П., Черевко А. А., Хе А. К. и др. Измерения и анализ локальной церебральной гемодинамики у больных с сосудистыми мальформациями головного мозга // Патология кровообращения и кардиохирургия. 2012. Т. 16. № 4. С. 27–31.
Cherevko A. A., Mikhaylova A. V., Chupakhin A. P. et al. Relaxation oscillation model of hemodynamic parameters in the cerebral vessels // J. Phys.: Conf. Ser. 2016. V. 722. 012045.
Cherevko A. A., Bord E. E., Khe A. K. et al. Using non-linear analogue of Nyquist diagrams for analysis of the equation describing the hemodynamics in blood vessels near pathologies // J. Phys.: Conf. Ser. 2016. V. 722. 012005.
Редакция благодарит специалиста по связям с общественностью СФБМИЦ им. акад. Е. Н. Мешалкина (Новосибирск) Е. А. Воронову за помощь в подготовке публикации.
Фотографии предоставлены пресс-службой СФБМИЦ им. акад. Е. Н. Мешалкина







