«Ядерная» диагностика: увидеть невидимое
Слово «ядерная» в приложении к чему-либо обычного человека всегда настораживает. И диагностическая ядерная медицина в этом смысле не исключение. Автор этой статьи, не медик, но научный сотрудник с физическим образованием, следит за развитием этой активно развивающейся области современного здравоохранения в силу своих научных интересов, связанных с математическим моделированием. Одна из главных целей этой публикации не просто познакомить широкого читателя с самыми передовыми диагностическими технологиями, но и обосновать необходимость создания в России мультидисциплинарного исследовательского центра ядерной медицины, которого в нашей стране пока нет
Ядерная медицина – так называют раздел клинической медицины, который использует в диагностике и лечении радиоактивные фармацевтические препараты. Современными методами диагностики в ядерной медицине являются позитронно-эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография (ОЭКТ). Сегодня их широко используют в онкологии, кардиологии и нейрологии. В последнее десятилетие особое внимание в мировой клинической практике уделялось методу ПЭТ, который на сегодня признан «золотым стандартом» в диагностике раковых заболеваний.
 За последние годы и в России построено более десятка ПЭТ-центров, в первую очередь в Москве и Санкт-Петербурге. Федеральная сеть центров ядерной медицины расширяется, охватывая различные регионы страны: уже построены ПЭТ-центры в Уфе, Хабаровске, Челябинске, Красноярске, Ханты-Мансийске, Казани, Екатеринбурге, Белгороде, Тольятти.
За последние годы и в России построено более десятка ПЭТ-центров, в первую очередь в Москве и Санкт-Петербурге. Федеральная сеть центров ядерной медицины расширяется, охватывая различные регионы страны: уже построены ПЭТ-центры в Уфе, Хабаровске, Челябинске, Красноярске, Ханты-Мансийске, Казани, Екатеринбурге, Белгороде, Тольятти.
В мае 2018 г. на Петербургском международном экономическом форуме было подписано соглашение о стратегическом партнерстве Новосибирской области и ООО «Лечебно-диагностический центр Международного института биологических систем имени Сергея Березина» по созданию центра ядерной медицины в Новосибирске. Стоимость проекта составит более 1 млрд рублей, а сам центр планируется ввести в эксплуатацию в ближайшие годы.
В связи с этим возникает ряд вопросов, которые интересны не только специалистам, но и широкой общественности. Например, какую информацию несут изображения, полученные с помощью диагностических методов ядерной медицины? В чем состоит их преимущество при онкологических заболеваниях? Какова лучевая нагрузка на пациента при обследованиях методами ПЭТ и ОЭКТ? Сколько стоит такое обследование, и кто будет за него платить?
От морфологии – к физиологии
К стандартным и широко известным методам диагностики сегодня можно отнести рентгеновскую компьютерную томографию (КТ) и магнитно-резонансную томографию (МРТ), каждый из этих методов имеет свою нишу приложения.
С помощью КТ регистрируют степень поглощения рентгеновского излучения биологическими тканями, которая зависит от плотности среды. Эти изображения имеют высокую контрастность в случае соседства сред с существенно различающейся плотностью, например, «мягкие ткани–кости», из-за чего КТ наиболее широко используется для диагностики травм и болезней костей и оценки состояния легких. А с использованием контрастных веществ КТ применяют и для исследования кровеносных сосудов, в том числе для выявления инсульта.
Метод МРТ основан на явлении ядерного магнитного резонанса. С его помощью получают изображение пространственного распределения протонов (ядер атомов водорода, входящих в состав молекулы H2O), которое наиболее контрастно для мягких тканей с различным содержанием воды. МРТ используют для исследования головного и спинного мозга, диагностики опухолей, заболеваний нервной системы.
И КТ, и МРТ позволяют получать высококачественные «анатомические изображения» с высокой (менее 1 мм) степенью разрешения. Однако при онкологических заболеваниях необходимо различать нормальные и аномальные структуры в пределах одного и того же органа, и в таких случаях этим методам часто недостает чувствительности, особенно на ранних стадиях болезни.
ВЗВЕШЕННЫЙ РИСК С ростом числа «лучевых» медицинских процедур в научной литературе начал активно обсуждаться вопрос о допустимых дозах поглощенного излучения. Лучевую нагрузку на пациента оказывают все современные томографические методы, кроме МРТ. И сегодня врачи при направлении больных на подобные обследования руководствуются двумя принципами: обоснование и оптимизация, – соотнося риски с возможностью получения жизненно важной информации. Проблема лучевого риска особенно значима в педиатрии, а также для пациентов детородного возраста. С увеличением возраста пациентов вероятность неблагоприятных последствий быстро снижается.Напомним, что на всех нас действует природный радиационный фон, создаваемый космическим излучением и излучением природных радионуклидов, в основном радоном. В мире средняя доза облучения за счет изотопов радона в помещениях составляет около 1,3 мЗв/год, в России – около 2,4 мЗв/год. Доза облучения при КТ составляет от 1 до 10 мЗв в зависимости от вида обследованных органов, а при КТ-ангиографии – 15 мЗв. Лучевая нагрузка при радионуклидных методах примерно сопоставима: 6 мЗв при исследовании перфузии миокарда методом ОЭКТ с использованием препарата Тс99m-МИБИ, 3,7—13,9 мЗв при ПЭТ всего тела с использованием препарата ФДГ. При этом по ценности получаемой информации эти методы несравнимы ни с какими другими
Усилить чувствительность методов КТ и МРТ можно с помощью контрастных веществ. Большинство опухолей, особенно злокачественных, имеют лучшее кровоснабжение, чем здоровые ткани, и контрастное вещество будет накапливаться в них в большей концентрации. Однако эти отличия не всегда настолько значимы, чтобы на основе визуальных оценок можно было поставить диагноз.
Оба этих метода дают изображения, основанные преимущественно на морфологических различиях тканей. Принципиальное отличие диагностических методов ядерной медицины состоит в том, что они позволяют визуализировать метаболические процессы (химические реакции, необходимые для поддержания жизни), протекающие в организме на клеточном уровне.
Метим опухоль
Диагностические методы ядерной медицины, и ПЭТ и ОЭКТ, используют радиофармпрепараты, состоящие из рабочего вещества с присоединенной к нему радиоактивной «меткой». Рабочее вещество – это специально подобранное молекулярное соединение, которое участвует в естественных метаболических процессах в организме человека.
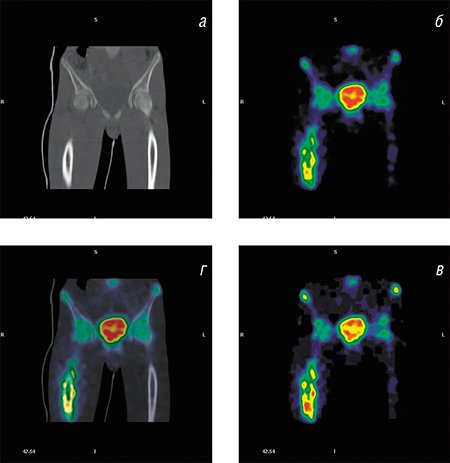 Например, в кардиологии для оценки кровоснабжения миокарда методом ОЭКТ широко применяется препарат Тс99m-МИБИ на основе метокси-изобутил-изонитрила, который захватывается здоровыми клетками миокарда. Метка накапливается в областях с ненарушенным кровоснабжением, и только в неповрежденных клетках, что позволяет диагностировать патологии кровоснабжения миокарда и выявлять области некротического повреждения.
Например, в кардиологии для оценки кровоснабжения миокарда методом ОЭКТ широко применяется препарат Тс99m-МИБИ на основе метокси-изобутил-изонитрила, который захватывается здоровыми клетками миокарда. Метка накапливается в областях с ненарушенным кровоснабжением, и только в неповрежденных клетках, что позволяет диагностировать патологии кровоснабжения миокарда и выявлять области некротического повреждения.
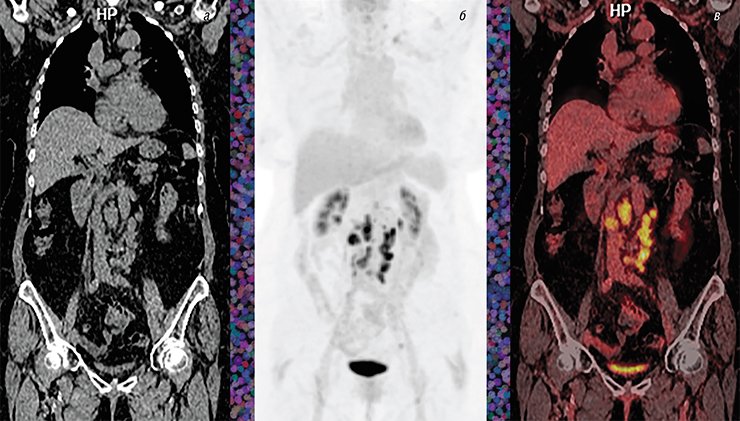
В онкологии метод ОЭКТ в последние годы уступает свои позиции ПЭТ. В этой области медицины практически все ПЭТ-обследования проводят с помощью препарата фтордезоксиглюкоза, по составу близкому к обыкновенной глюкозе и меченному изотопом фтора 18F. Глюкоза – универсальный источник энергии, поэтому раковые клетки, отличающиеся усиленным метаболизмом, накапливают этот препарат в более высоких концентрациях, чем здоровые. И на ПЭТ-изображениях очаги поражения видны в виде ярких пятен.
В ОЭКТ и ПЭТ используются разные радионуклиды-метки. В первом случае это радиоактивные вещества, которые при распаде испускают гамма-кванты. Радионуклиды, использующиеся при ПЭТ-диагностике, испускают позитроны – античастицы электронов. В биологических тканях присутствует много свободных электронов, поэтому позитрон встречается с электроном, пройдя расстояние менее 1—2 мм. Частицы аннигилируют, выделяя энергию в виде двух гамма-квантов, вылетающих в противоположных направлениях, которые и регистрируются детекторами. Поток гамма-квантов при ПЭТ существенно выше, что и обеспечивает более высокое качество получаемых изображений.
В 2012 г. в широко известном медицинском журнале The New England Journal of Medicine вышла статья «Бремя болезней и меняющиеся задачи медицины», где была приведена таблица причин смертности населения г. Бостон за период с 1812 по 2012 гг. В начале XIX в. довольно частой была «смерть от разрыва пушечного ядра», столетие спустя основными причинами смерти были пневмония, грипп, туберкулез и желудочно-кишечные инфекции. В 2010 г. доминирующими причинами смерти стали сердечно-сосудистые заболевания и рак. Примерно такая же динамика наблюдается во всем мире и в России. Ученые предсказывают, что в ближайшие годы онкологические заболевания выйдут в абсолютные лидеры благодаря достигнутому прогрессу в диагностике и лечении сердечно-сосудистых заболеваний и выявлении основных причин этих патологий.Сейчас Минздрав России работает над новой национальной онкологической программой, рассчитанной до 2030 г. Ожидается, что большая роль в этой программе будет отведена развитию современных методов диагностической и терапевтической ядерной медицины, созданию ПЭТ-центров на территории России
В чем преимущества метода ПЭТ в сравнении с другими видами томографии для диагностики рака? Во-первых, он позволяет не только дифференцировать доброкачественные и злокачественные образования, но и обнаруживать опухоль на самой ранней стадии развития, когда шансов на успех излечивания существенно больше. Во-вторых, это единственный метод, с помощью которого можно просканировать все тело после обнаружения первичной опухоли, чтобы диагностировать наличие или отсутствие метастазов, что чрезвычайно важно для определения тактики лечения. Наконец, только ПЭТ дает самую раннюю оценку эффективности проводимого лечения, а также позволяет отличить рецидив от морфологических повреждений ткани после хирургических и лучевых процедур.
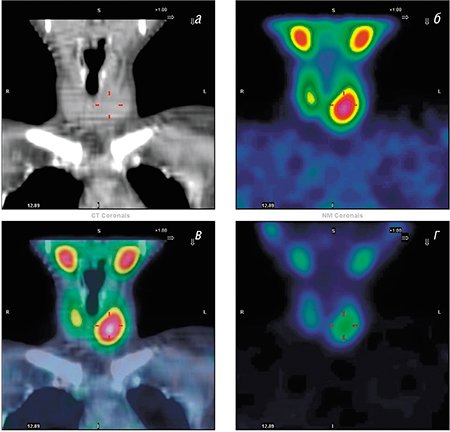
ПЭТ-исследования используют и для контроля опухолевого процесса уже после курса терапии. Например, при изначально гормонопозитивном раке молочной железы опухоль иногда прогрессирует после окончания стандартной 5-летней гормонотерапии. Но в рутинной клинической практике онкологи часто пренебрегают возможностью повторного установления диагноза, особенно при внутригрудной и внутрибрюшинной локализации метастазов. Это непросто сделать даже с помощью ПЭТ-диагностики из-за низкой метаболической активности очагов вследствие небольших размеров. Однако эти ограничения можно преодолеть за счет использования нового препарата – 18F-фторэтилтирозина, который еще только входит в практику передовых клиник.
Нужно отметить, что «молекулярные изображения», полученные с помощью диагностических методов ядерной медицины, не обладают той высокой четкостью, которая присуща анатомическим изображениям КТ и МРТ. В самом начале своего развития этот раздел получил даже шутливое название unclear medicine вместо nuclear medicine. Чтобы привязать очаги поражения к анатомическому строению, в современной диагностической ядерной медицине используют гибридные ПЭТ/КТ- и ПЭТ/МРТ-системы, при которых изображения, полученные разными методами, накладываются друг на друга.
Решают кадры
«Проблема России не в томографах, проблема России – в мозгах, в катастрофическом недостатке специалистов и исследований в этой области». Эта цитата из приветственного доклада хирурга-онколога академика М. И. Давыдова на конференции по медицинской физике в 2010 г. остается актуальной и доныне.
В Европе, США, Японии и Китае быстрое развитие ядерной медицины в последние годы привело к росту числа исследований в этой области, увеличению численности и повышению уровня подготовки специалистов. Текущую ситуацию в России можно оценить как критическую. Чтобы решить проблему подготовки кадров для рутинной и исследовательской работы в области ядерной медицины, нужно вводить соответствующие курсы на действующих кафедрах медицинских вузов, а также готовить немедицинских специалистов: радиохимиков, медицинских физиков, математиков, биологов.
Назрела необходимость быстро решать вопрос образовательной подготовки специалистов для ядерной медицины, так как было бы стратегической ошибкой закупать дорогостоящее высокотехнологичное оборудование и при этом не иметь грамотных специалистов, которые могут на нем работать.
С учетом все возрастающей сложности медицинских технологий визуализации задача интерпретации полученных изображений становится все более трудной для врачей. К решению этой проблемы сегодня подключаются исследователи в области «больших данных» и искусственного интеллекта, специалисты в области решения обратных некорректных задач, создатели новых радиофармацевтических препаратов. Такой подход требует создания сильных исследовательских групп, объединяющих врачей, инженеров, физиков, химиков, биологов, математиков.
Будущее ядерной медицины определяется, прежде всего, мультидисциплинарными фундаментальными исследованиями, направленными на разработку более эффективных радиофармпрепаратов, обеспечение радиационной безопасности и создание новых аппаратных средств регистрации гамма-излучения, а также на совершенствование математических методов обработки полученной информации. Кстати сказать, в мире фундаментальные исследования в этой области ведутся сегодня настолько интенсивно и широко, что основной Европейский журнал по ядерной медицине и молекулярной визуализации (EJNMMI) даже разделился на несколько дисциплинарных журналов.
Ниже мы коснемся только одного из направлений, близкого автору по роду его научной деятельности, которое связано с применением математического моделирования и компьютерных имитаций в области диагностической ядерной медицины. Необходимость такого подхода диктуется невозможностью из-за лучевой нагрузки проводить исследования на людях, тогда как эксперименты на мелких животных не могут решить проблем, возникающих при диагностике человека.
Матмоделирование в помощь
Томографические исследования в новосибирском Институте теоретической и прикладной механики (ИТПМ) СО РАН были инициированы д. ф.–м. н. Н. Г. Преображенским еще в 1980-е гг. с целью использовать их для диагностики газа и плазмы. В начале 2000-х гг. специалисты института совместно с врачами НМИЦ им. академика Е. Н. Мешалкина (Новосибирск) начали применять математическое моделирование для компьютерной имитации процедуры обследования кардиологических больных методом ОЭКТ. Сейчас эти исследования продолжаются в сотрудничестве с Институтом вычислительной математики и математической геофизики СО РАН, а также Национальным медицинским исследовательским центром кардиологии (Москва), Венским медицинским университетом и отделением ядерной медицины Центральной клинической больницы Вены (Австрия) при поддержке РФФИ и Австрийского научного фонда.
Математическое моделирование процедуры ОЭКТ и ПЭТ – это сложная физико-математическая проблема, состоящая из ряда задач: создания математических моделей (фантомов), описывающих распределение радиофармпрепарата в органах пациента; моделирования процесса формирования «сырых» проекционных данных, регистрируемых детекторами; разработки метода решения обратной задачи реконструкции изображений из «сырых» данных. Фактически при компьютерном моделировании математический фантом служит виртуальным «пациентом», а реальная томографическая установка заменяется виртуальной системой.
Эти исследования позволяют выявить причины возникновения на изображениях «ложных дефектов», приводящих к неправильному диагнозу, а также оценить предельные размеры патологических очагов, которые можно визуализировать в зависимости от их локализации и индивидуальных особенностей анатомического строения пациента. С помощью этого подхода можно также тестировать новые алгоритмы реконструкции изображений и выполнять исследования по оптимизации протокола сбора данных.
При онкологических заболеваниях пациентам часто необходимо неоднократно проводить ПЭТ-сканирование, чтобы выявить метастазы, оценить эффективность терапии и контролировать возможный рецидив опухолевого процесса. Цена зависит от вида используемого препарата и органов тела, которые будут обследованы. «Мировая» стоимость одного обследования всего тела составляет около 1 тыс. долларов. Попасть на такую диагностику можно по направлению из онкодиспансера. В этом случае для жителей регионов, где уже имеются центры федеральной сети, обследование будет проведено за счет ОМС. Судя по сообщениям в СМИ, половина обследований в будущем Центре ядерной медицины в Новосибирске будет покрываться за счет ОМСВ России подобная работа пока ведется только в ИТПМ СО РАН. Несколько лет тому назад совместно с отделением томографии НМИЦ им. ак. Е. Н. Мешалкина был разработан первый отечественный 3D-математический фантом для исследований в области диагностической ядерной кардиологии. Этот фантом описывает распределение препарата Тс99m-МИБИ в органах грудной клетки среднестатистического пациента мужского пола при исследовании перфузии (кровоснабжения) миокарда методом ОЭКТ. Рассчитанные для него проекционные данные хорошо согласуются с данными реальных клинических обследований. Фантом использовался в различных исследованиях, в том числе по снижению дозы радиофармпрепарата с целью уменьшения лучевой нагрузки на пациента.
Существует два подхода к развитию фантомов: на основе методов компьютерной графики и на основе простых фигур, описываемых уравнениями пространственной геометрии. С самого начала мы хотели построить фантомы, которые можно было бы легко трансформировать, меняя размеры и положение органов, чтобы исследовать влияние анатомического строения пациентов на качество изображений.
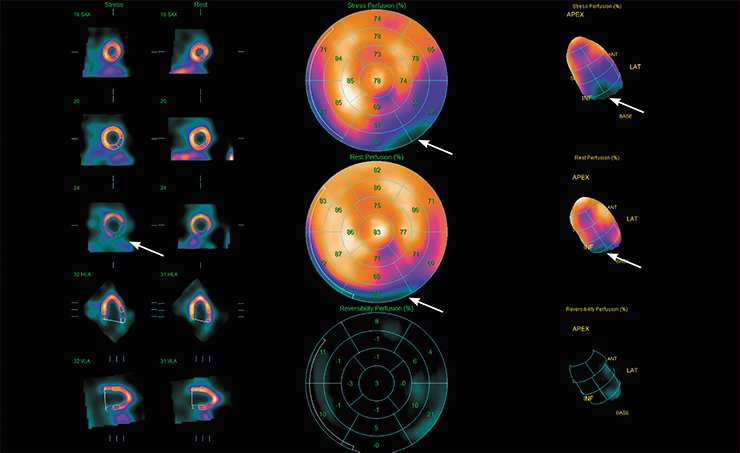
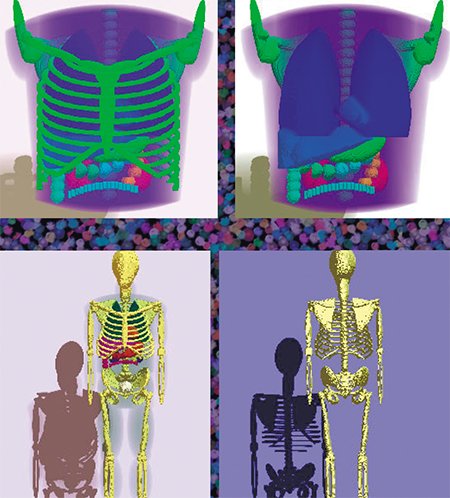 Например, в течение более 20 лет оставалась непонятой причина появления «ложных дефектов» на изображениях в верхушечной зоне миокарда при исследовании его перфузии. Эти артефакты имитируют или маскируют поражения миокарда, что затрудняет интерпретацию изображений и вынуждает назначать дополнительные дорогостоящие обследования. По результатам исследований на основе численных методов с использованием нашего фантома были предложены рекомендации по внесению изменений в протокол обследований пациентов.
Например, в течение более 20 лет оставалась непонятой причина появления «ложных дефектов» на изображениях в верхушечной зоне миокарда при исследовании его перфузии. Эти артефакты имитируют или маскируют поражения миокарда, что затрудняет интерпретацию изображений и вынуждает назначать дополнительные дорогостоящие обследования. По результатам исследований на основе численных методов с использованием нашего фантома были предложены рекомендации по внесению изменений в протокол обследований пациентов.
Сегодня в процессе создания находится фантом для компьютерной имитации процедуры обследования «всего тела» методом ПЭТ.
Ядерная медицина с самого начала создавалась исследовательскими коллективами, где «плечо к плечу» работали врачи, физики, химики, математики и биологи, и сегодня она продолжает активно развиваться как мультидисциплинарное направление.
У Новосибирска имеется огромный научный потенциал в области диагностической, терапевтической и интервенционной ядерной медицины: перспективные разработки и хорошие заделы по разным направлениям наряду с большим опытом сотрудничества есть и в институтах СО РАН, и в медицинских учреждениях. Достаточно упомянуть лишь о методе бор-нейтронозахватной терапии рака, который успешно развивается в Институте ядерной физики СО РАН совместно с другими научными и медицинскими организациями. Создание в Новосибирске мультидисциплинарного исследовательского центра ядерной медицины даст крепкую основу для развития фундаментальных и прикладных исследований в этой области.
Литература
Беляев В. Н., Климанов В. А. Физика ядерной медицины. М.: НИЯУ МИФИ, 2012, Ч. 2, 248 с.
Климанов В. А. Физика ядерной медицины. М.: НИЯУ МИФИ, 2012, Ч. 1, 308 с.
Колядина И. В., Абдуллаев А. Г., Танишина Н. Б. и др. Мультимодальный подход к дифференциальной диагностике метастатического поражения при раке молочной железы: описание клинического случая // Злокачественные опухоли. 2017. Т. 7. № 3. С. 31—36.
Denisova N. V., Terekhov I. N. A study of myocardial perfusion SPECT imaging with reduced radiation dose using maximum likelihood and entropy-based maximum a posteriori approaches // Biomed. Phys. Eng. Express. 2016. V. 2. N. 5. P. 055015 (12).
Denisova N. V., Ansheles A. A. A study of false apical defects in myocardial perfusion imaging with SPECT/CT // Biomed. Phys. Eng. Express. 2018. V. 4. N. 6. P. 065018 (12).
Jones D. S., Podolsky S. H., Greene J. A. et al. The Burden of Disease and the Changing Task of Medicine // N Engl. J. Med. 2012. V. 366. P. 2333—2338.





