Бактериальной «коммуне» антибиотики не страшны
В последние десятилетия мы все чаще слышим о бактериальных инфекциях, вызванных устойчивостью патогенов к антимикробной терапии, – примером могут служить печально известные внутрибольничные пневмонии в нынешнюю пандемию. При этом бактерии могут проявлять чувствительность к антибиотикам в лабораторных тестах, но на практике лечение оказывается неэффективным. И вот недавно ученые обнаружили возможную причину возникновения этой проблемы и предложили пути ее решения
Хронические бактериальные инфекции, как известно, с трудом поддаются лечению антибиотиками. В таких случаях мы часто сталкиваемся с ситуацией, когда очаг инфекции колонизирован несколькими «дополнительными» видами патогенов помимо основного. Подобные полимикробные инфекции часто встречаются у легочных больных, страдающих хронической обструктивной болезнью легких, бронхиальной астмой и муковисцидозом (генетическим заболеванием, характеризующимся повышенной вязкостью секретов желез, в том числе в дыхательных путях). Может быть, именно такое «соседство» помогает патогенам противостоять антимикробной терапии?
Ученые из Кембриджского университета (Великобритания) воспроизвели и изучили полимикробные инфекции, чтобы проверить гипотезу, что в результате взаимодействия между бактериями у них меняется активность некоторых генов, что и выражается в усилении патогенных свойств.
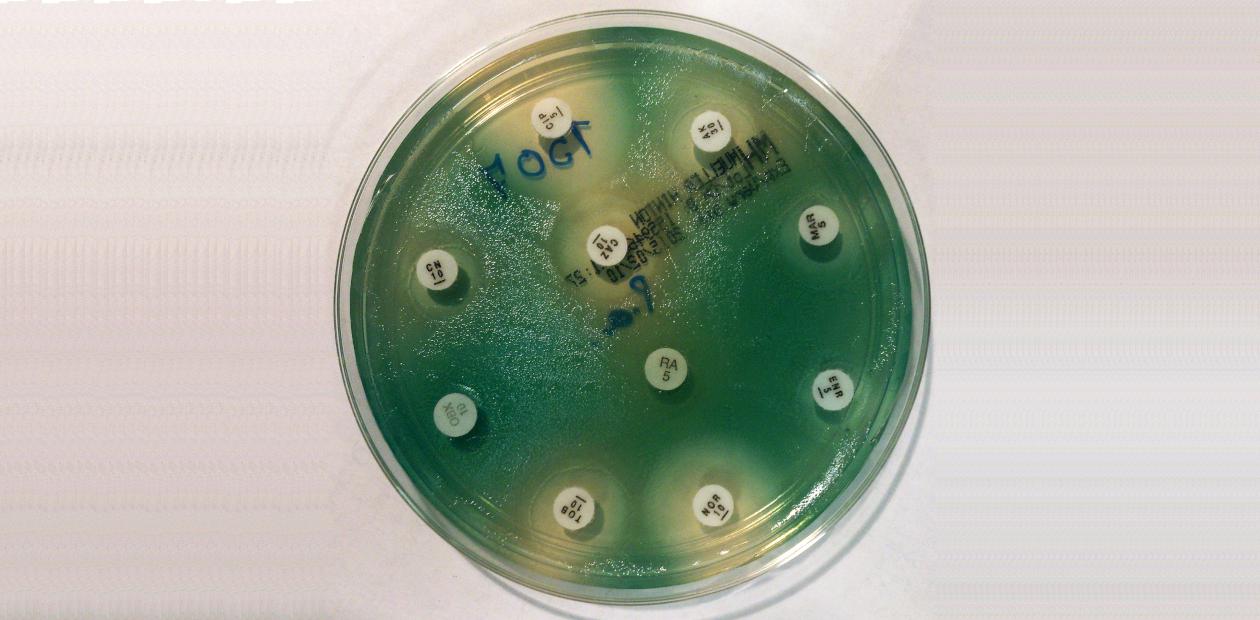
Исследователи создали упрощенную физическую модель дыхательных путей человека, содержащую искусственную мокроту, близкую к настоящей по химическому составу. В таких условиях, приближенных к реальным, они в течение нескольких недель культивировали совместно бактериальные штаммы, представляющие собой ключевые патогены, ассоциированные с муковисцидозом. При этом на культуры воздействовали специфичными противомикробными лекарствами: антибиотиками колистином против синегнойной палочки и фузидиевой кислотой – против золотистого стафилококка, а также флуконазолом против грибка Candida albicans.
Каждый из этих противомикробных агентов был эффективен против своей мишени, сталкиваясь с ней один на один. Но в присутствии других патогенов, пусть и в небольшом количестве, лекарства не работали! В таких случаях для уничтожения бактерий нужно применять намного более высокие дозы каждого препарата.
При изучении генома синегнойной палочки, выросшей в модели полимикробной инфекции, ученые открыли новый механизм лекарственной устойчивости к антибиотику колистину, и выяснили, что эти новые мутации чаще возникают именно при «совместном проживании» с другими патогенами. Эти выводы были подтверждены при изучении геномов бактерий, полученных из образцов мокроты 800 больных.
Что касается золотистого стафилококка, который оказался также намного более устойчивым к фузидиевой кислоте, то здесь, похоже, работают другие механизмы, не связанные с наследуемыми изменениями.
Полученные данные подчеркивают необходимость учитывать взаимодействие между микробами и корректировать дозировки препаратов в случае респираторных полиинфекций. Обычно в таких случаях применяют самую низкую эффективную дозу антибиотика, что неправильно, так как это увеличивает риск появления лекарственно устойчивых бактерий. Что до самой модельной системы, то она может с успехом использоваться для тестирования эффективности антибиотиков при смешанных и вторичных инфекциях.
Фото: https://commons.wikimedia.org