Оксилипины: эволюция биохимического «эсперанто»
Каждый раз, когда мы проливаем на себя горячий чай, разбиваем коленки об асфальт или заражаемся гриппом, в наших поврежденных тканях запускается синтез биологически активных веществ – оксилипинов. Это первый сигнал бедствия и крик о помощи от пострадавших клеток. Высшие многоклеточные организмы: животные, растения, грибы, водоросли – все они в своей межклеточной коммуникации используют аналогичные, удивительно похожие по структуре и функциям химические соединения. Такие же соединения умеют синтезировать и некоторые одноклеточные: простейшие и бактерии, правда, до недавнего времени было не совсем понятно для чего. Прояснить этот вопрос удалось с помощью методов биоинформатики, а попутно получилось найти и новую молекулярную мишень для борьбы с антибиотикоустойчивыми бактериями
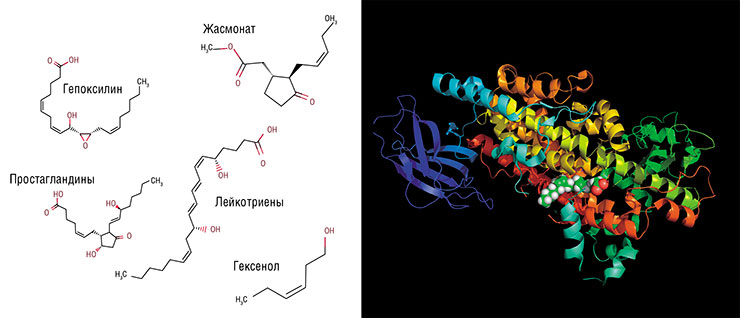
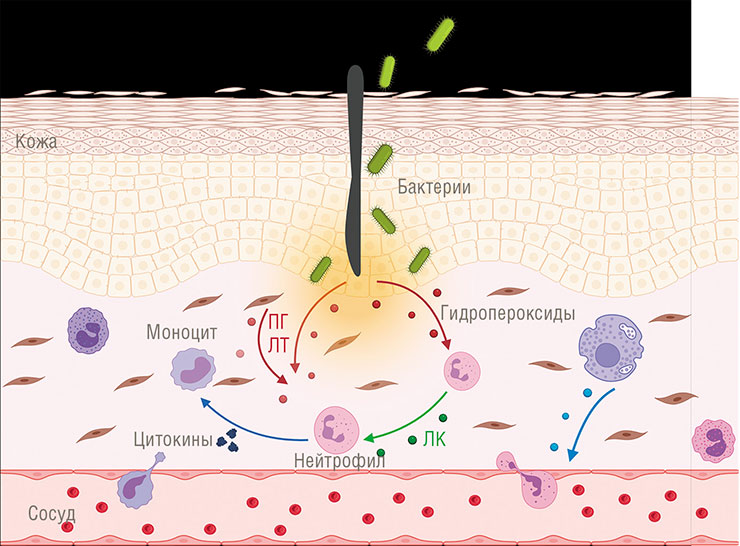
Оксилипины человека – это группа биологически активных молекул, которые дирижируют воспалением, универсальной защитной реакцией организма животных. Они регулируют почти все составляющие этого процесса: движение лейкоцитов к месту повреждения, их активацию, повышение проницаемости мелких сосудов, свертывание крови и т. п. При этом среди человеческих оксилипинов есть как стимуляторы воспаления (например, лейкотриены и большинство простагландинов), так и его супрессоры (например, липоксины).
С этой функцией оксилипинов знаком любой, кто хоть раз для подавления воспалительного процесса принимал таблетку аспирина или ибупрофена – эти препараты нацелены именно на блокирование синтеза простагландинов. А для лечения астмы иногда используются лекарства для блокирования синтеза лейкотриенов или их рецепторов, например зилеутон или монтелукаст.
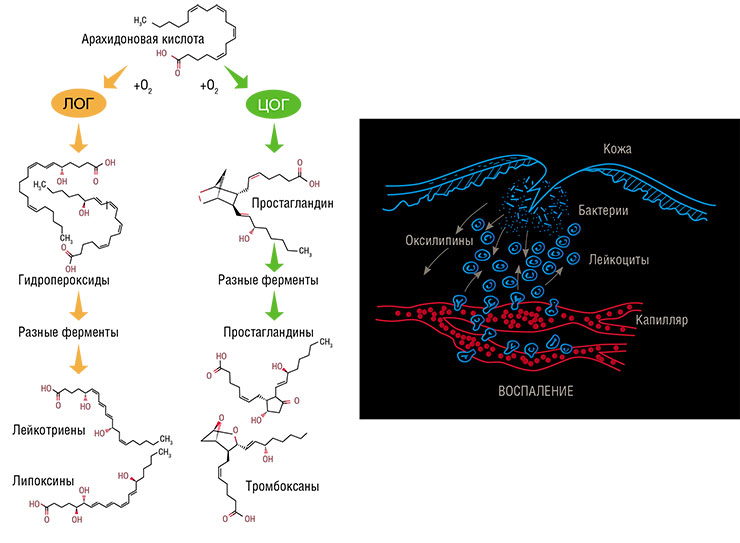
Все оксилипины синтезируются из полиненасыщенных жирных кислот, имеющих несколько двойных связей (C=C) в углеродном «хвосте». Обилие таких связей делает эти жирные кислоты удобной мишенью для присоединения кислорода, в результате чего получаются производные с группой –OH или =O, которые мы и называем оксилипинами. Из всех жирных кислот человеческие клетки используют для синтеза оксилипинов лишь одну – арахидоновую, с четырьмя изолированными двойными связями. Поскольку ее молекула содержит 20 атомов углерода, все оксилипины животных и человека называются еще эйкозаноидами (от др.-греч. двадцать).
Свободной арахидоновой кислоты в цитоплазме клетки мало, поэтому при ее повреждении специальный фермент расщепляет фосфолипиды клеточной мембраны, буквально «выдергивая» из нее эту кислоту. Ее дальнейшим окислением занимаются два основных фермента: циклооксигеназа и липоксигеназа. Оба фермента катализируют, по сути, одну и ту же реакцию перекисного окисления липидов, только делают это в разном месте, в результате чего на выходе получаются продукты разной конфигурации. К примеру, в случае циклооксигеназы молекула замыкается в пятичленное кольцо.

Всего существует шесть типов липоксигеназ, которые участвуют в производстве лейкотриенов и липоксинов. Сначала они трансформируют арахидоновую кислоту в довольно неустойчивые гидропероксиды, которые самопроизвольно преобразуются в эпоксиды, а далее целый набор ферментов наводит на них «лоск», превращая в конечный продукт. Существует и два типа циклооксигеназ, с помощью которых синтезируются простагландины.
Все вышеизложенное хорошо знакомо медикам и биологам. Но интрига в том, что потрясающе похожие на оксилипины биологически активные вещества встречаются и в других царствах живых организмов.
Растения: «Помогите, меня едят!»
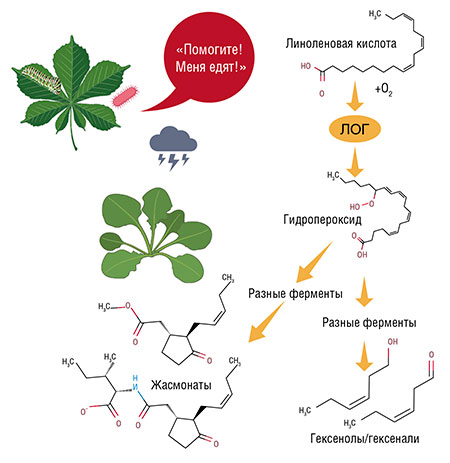
Мембраны растительных клеток не содержат арахидоновой кислоты, но зато в них есть похожая на нее линоленовая кислота, с 18 атомами углерода и 3 изолированными двойными связями (de León, Hamberg, Castresana, 2015). Эта жирная кислота используется растениями для биохимических превращений, очень похожих на биосинтез наших эйкозаноидов. Получающиеся метаболиты называют октадеканоидами, или, чтобы не путаться, просто оксилипинами.
Начальный этап производства этих веществ аналогичен тому, как это происходит у животных. У растений есть и свои липоксигеназы – гомологи животных ферментов, которые синтезируют из линоленовой кислоты гидропероксиды. А вот дальше начинаются различия. Два фермента сразу подхватывают часть молекул гидропероксида и «нарезают» их на летучие спирты и альдегиды (мы так не умеем – все наши оксилипины нелетучи).
Оставшаяся часть гидропероксида будет обработана каскадом ферментов, не похожих на человеческие (Хелдт, 2011). В итоге получается жасмоновая кислота, которую вместе с ее производными (эфиры, гликозиды и др.) называют жасмонатами. Химически их можно считать аналогами наших простагландинов, вот только синтезируются они у растений иначе.

В любом случае налицо определенное биохимическое сходство между нашими и растительными оксилипинами. Но что насчет их функций? Идея, что они также схожи, на первый взгляд кажется безумной – у растений ведь не бывает воспаления! Растительные клетки, в отличие от животных, заключены в жесткие целлюлозные оболочки, что исключает для них всякую возможность примчаться на выручку к терпящим бедствие, как это делают наши лейкоциты.
И все же, если посмотреть шире, функциональное сходство окажется фантастическим. Ведь под словом «воспаление» скрывается характерный для животных стереотипный ответ на повреждение. Но растения также реагируют на подобные ситуации, пусть и не так, как мы. И эти реакции как раз и координируются растительными оксилипинами.
У растений, как и у животных, оксилипины регулируют реакцию клеток на повреждение, вызванное травмой или внедрением патогена. Только вместо воспаления они инициируют выделение широкого круга защитных химических веществ – фитонцидовПри вторжении патогена растения пускают в ход настоящее «химическое оружие». Их возможности по части синтеза вторичных метаболитов – соединений, не участвующих в метаболизме самого растения, – многократно превосходят наши. Так, в случае нашествия бактерий или грибов они могут применить и фитоалексины (низкомолекулярные антибиотики), и дефензины (небольшие антимикробные пептиды, очень похожие на человеческие), и набор ферментов, способных разрушать клеточную стенку непрошенного гостя (Freeman, Beattie, 2008; Хелдт, 2011). Так что у растений тоже есть иммунитет – просто он очень непохож на наш.
 Жасмонаты, а также летучие альдегиды и спирты, образующиеся при их синтезе, запускают в организме растений каскад иммунного ответа. И в этом состоит их кардинальное сходство с эйкозакоидами позвоночных: и у растений, и у животных оксилипины участвуют в регуляции иммунитета.
Жасмонаты, а также летучие альдегиды и спирты, образующиеся при их синтезе, запускают в организме растений каскад иммунного ответа. И в этом состоит их кардинальное сходство с эйкозакоидами позвоночных: и у растений, и у животных оксилипины участвуют в регуляции иммунитета.
При этом белки-рецепторы, через которые действуют эти соединения, у них различаются, что кажется удивительным. У животных это преимущественно встроенные в клеточную мембрану рецепторы, по форме напоминающие серпантин и связанные с молекулами G-белка. У растений гомологи этих рецепторов не обнаружены, да и вообще рецепторы оксилипинов у них изучены плохо. Известно лишь, что для жасмонатов рецептором служит мультибелковый комплекс, совершенно не похожий на наши рецепторы оксилипинов (Mach, 2009).
Но роль оксилипинов у растений шире, чем у животных, – для них это еще и часть ответа на стресс как таковой. Эти сигнальные молекулы координируют ответ растения на засуху, избыточную соленость или освещение, а также на другие невзгоды окружающей среды. И если наши простагландины – это лишь медиаторы воспаления, то их растительные химические аналоги жасмонаты – настоящие гормоны стресса!
По сути, оксилипины переключают растение с режима роста на режим защиты. В частности, именно они ингибируют фотосинтез и деление клеток, «притормаживая» все жизненные процессы растения в начале листопада перед долгой зимой (Савченко, Застрижная, 2014).
Оксилипины решают еще одну проблему растений, связанную с отсутствием у тех вербальной и невербальной коммуникации. Животные используют звуки, движения и слова (в случае человека), чтобы общаться с сородичами, но растения так не умеют. И решают они эту проблему опять же с помощью «химии».

«Плач» растений знаком всем, кто чувствовал сладкий запах свежескошенной травы – так пахнут те самые ароматные летучие оксилипины, альдегиды и спирты, образующиеся из жирных кислот при повреждении клеток. И на нападение растительноядных животных они реагируют аналогичным образом.
Растения «плачут» не зря. Так, один из летучих жасмонатов – метиловый эфир жасмоновой кислоты – способен передаваться по воздуху от растения к растению и заблаговременно инициировать защитные реакции «соседей» (Jang et al., 2014). Кроме того, подобным образом они могут позвать на помощь другие виды, к примеру наездников – мелких паразитических насекомых, естественных врагов личинок, поедающих листья (Хелдт, 2011).
Коммуникацией функции оксилипинов растений не ограничиваются: некоторые из них сами являются антимикробными агентами и способны уничтожать бактерии и грибы. Но все-таки именно коммуникационная функция представляется особенно важной, учитывая обстоятельства, в которые растения исходно поставлены эволюцией. С этих позиций оксилипиновая сигнализация растений и животных кажется очень похожей: как животные, так и растительные клетки с помощью этих сигнальных молекул «кричат» своим соседям: «Помогите, меня едят!»
Водоросли и грибы: «Ты мне нравишься!», но «Не толкайся!»
Здесь мы вступаем на не слишком твердую почву: оксилипины и их роль в других группах организмов изучены не слишком хорошо. К примеру, наши знания на этот счет в отношении одноклеточных красных, бурых и диатомовых водорослей довольно фрагментарны.
Установлено, что водоросли также «плачут» оксилипинами в ответ на инфекцию, стресс или повреждение и используют их для иммунной защиты. Но если для растений и животных составлены подробные схемы биосинтеза этих биологически активных веществ, то про водоросли мы знаем лишь только, что у них есть липоксигеназа(-ы) с той или иной субстратной специфичностью (Andreou, Brodhun, Feussner, 2009).
Так, мы пока можем лишь догадываться о том, по какому пути у бурых и диатомовых водорослей идет биосинтез феромонов, сигнальных веществ, благодаря которым мужские и женские половые клетки находят друг друга – примечательный факт химической коммуникации у одноклеточных организмов. По структуре эти молекулы представляют собой разветвленные или циклические углеводороды, и на сегодня есть убедительные доказательства, что формируются они из оксилипинов (примерно так же, как летучие альдегиды и спирты у растений) (Rui, Boland, 2010).
Что касается такого царства многоклеточной жизни, как грибы, то биосинтез оксилипинов у них очень сложен и до конца не ясен даже специалистам.
Известно, что ферменты липоксигеназы у грибов есть. Правда, некоторые из них вместо «обычного» железа содержат марганец, но биохимический механизм их действия от этого заметно не меняется (Brodhun, Feussner, 2011). И так же, как и растения, грибы синтезируют летучие оксилипины.
Но у этих удивительных организмов, обладающих признаками как растений, так и животных, есть и гомологи наших циклооксигеназ. Однако их задача у грибов вовсе не синтез простагландинов. Эти ферменты у них либо занимаются той же работой, что липоксигеназы (превращают в гидропероксиды жирные кислоты), либо «врезают» в молекулу последних сразу две гидроксильные группы (так работают диолсинтазы).
 Оксилипины грибов выполняют важную функцию: обеспечивают им «чувство кворума» («чувство локтя»), что позволяет грибам менять свою морфологию в зависимости от плотности популяции.
Оксилипины грибов выполняют важную функцию: обеспечивают им «чувство кворума» («чувство локтя»), что позволяет грибам менять свою морфологию в зависимости от плотности популяции.
Грибы не «плачут» оксилипинами – с их помощью они говорят соседям: «Не толкайся!» или «Не мешай!» В ответ сосед может «переключиться» и сменить форму своего тела, состоящего из переплетения нитей-гиф, на компактную или вообще на одноклеточную, как у дрожжей. Именно так поступает гриб Ceratocystis ulmi, возбудитель голландской болезни ильмовых пород (Brodhun, Feussner, 2011). А гриб Aspergillus flavus под их действием может поменять стратегию бесполого размножения, перейдя из режима образования покоящейся стадии (склероция) в режим формирования спор (конидий) (Horowitz Brown et al., 2008).
И за все эти метаморфозы отвечают оксилипины, образующиеся по липоксигеназному пути. А дальние «родственники» наших циклооксигеназ участвуют в синтезе оксилипинов, регулирующих переключение между половым и бесполым размножением (Brodhun, Feussner, 2011).
Простейшие и бактерии: вопросов больше, чем ответов
Представители всех описанных выше царств, к которым принадлежат высшие эукариотические (т. е. имеющие оформленное клеточное ядро) организмы, используют оксилипины для межклеточной сигнализации. Вне зависимости от того, что хочет «сказать» клетка, с их помощью она посылает какой-то важный сигнал другой клетке. Другими словами, главная и общая функция оксилипинов – служить своего рода биохимическим «эсперанто».
Это могло бы быть примером впечатляющей эволюционной консервативности, однако мы слишком мало знаем о функциях ферментов, участвующих в синтезе этих биологически активных веществ за пределами растений, животных, грибов и водорослей. У самого эволюционного «корня» этих больших групп лежит пропасть незнания. Это удручает, ведь, по словам одного из основателей синтетической теории эволюции Ф. Г. Добжанского, «ничто в биологии не имеет смысла, кроме как в свете эволюции».
Мы же в этом смысле знаем очень мало не только о бактериях – прокариотических организмах, но даже о простейших, которые являются одноклеточными или колониальными эукариотами, неспособными к фотосинтезу, как водоросли.
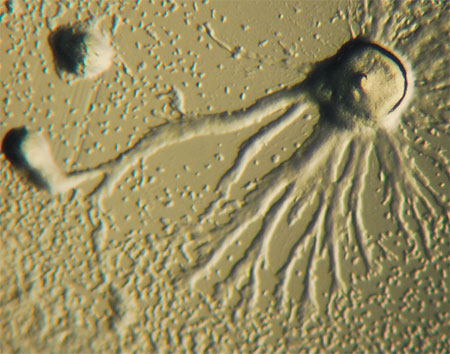
Публикаций о липоксигеназе у простейших нет. Исключение – запись в базе данных, касающаяся слизевика Dictyostelium discoideum (Phenotype and Strain Details for lipA-//dictyBase. Electronic resource). Сытый диктиостелиум представляет собой обычную одиночную почвенную амебу. Но при голодании слизевики сбиваются вместе, образуя многоклеточный агрегат, перемещающийся как единое целое, а затем и плодовое тело, напоминающее гриб. И при наличии мутации в гене липоксигеназы формирование такого плодового тела нарушается.
Что касается бактерий, то биохимия липоксигеназ описана для нескольких видов циано- и миксобактерий. Эти ферменты также превращают жирные кислоты в гидропероксиды, которые затем конвертируются в гидроксиды. Но для бактерий, как и для водорослей, сделать подробную схему биосинтеза оксилипинов пока невозможно.
Нужно отметить, что липоксигеназы удобны своей впечатляющей консервативностью: почти у всех живых организмов это семейство ферментов выполняет одни и те же функции. Более того, в основе всех этих ферментных белков лежит консервативный участок (домен), который легко распознается при анализе аминокислотной последовательности специальными программами. Поэтому оценить распространенность этих ферментов можно, просто «просканировав» имеющиеся базы данных средствами биоинформатики.
С помощью такого анализа удалось обнаружить гены, кодирующие потенциальные липоксигеназы, в 0,5 % «расшифрованных» на сегодняшний день геномов бактерий. У архей – древнейших одноклеточных организмов, не имеющих ядра и мембранных структур, которых не так давно выделили из бактерий в отдельное надцарство, – этот метод не выявил наличия липоксигеназ (Horn et al., 2015; Куракин, Самоукина, Потапова, 2020).
Полученные результаты говорят о том, что большинство бактерий спокойно обходится без липоксигеназы, хотя сотни из них этот фермент все же имеют. И это почти тот же фермент, что производит лейкотриены в нашем организме и жасмонаты в организме герани на окне. Но вот сведения о его функции у бактерий крайне скудны.
В далеком 2007 г. немецкие исследователи попытались ранить цианобактерию Nostoc punctiforme ультразвуком так же, как ранее другие научные группы – диатомовые водоросли. Оказалось, что при этом носток, как и диатомеи, «плачет» оксилипинами – продуктами работы липоксигеназ (Lang, Feussner, 2007). К сожалению, в этом исследовании не была изучена реакция других бактериальных клеток на выделение этих молекул и их возможная биологическая роль.
А вот у почвенной бактерии Myxococcus xanthus, напротив, только этот ответ и был изучен: добавление к культуре бактерии ее собственного оксилипина усиливало подвижность клеток (An, Oh, 2018). Но осталось непонятным, что означает такое поведение в реальных условиях.
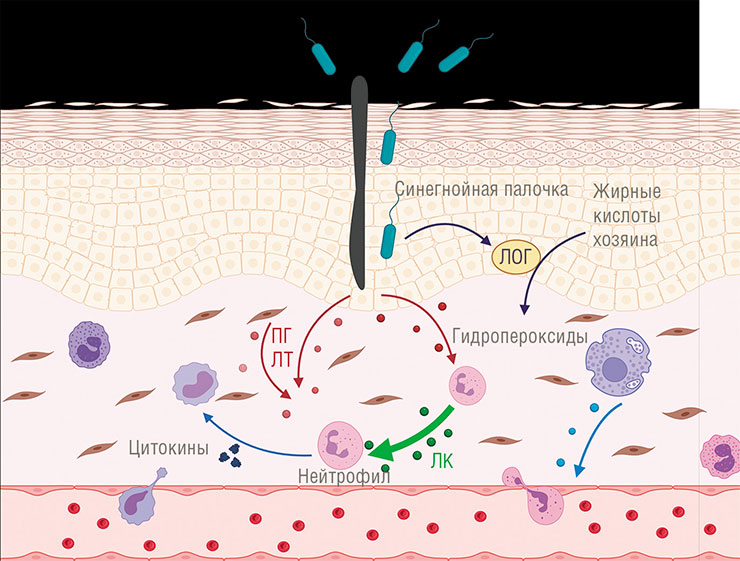
Ферменты липоксигеназы, участвующие в синтезе оксилипинов, обнаружены у некоторых бактерий, однако об их функции известно мало. Исключение – синегнойная палочка, которая использует этот фермент для активации синтеза противовоспалительных оксилипинов в зараженных клетках. Возможно, таким «трюком» пользуются и другие патогенные бактерииНа этом фоне прорывом выглядит информация о функции липоксигеназы и оксилипинов у синегнойной палочки (Pseudomonas aeruginosa), опасного внутрибольничного патогена. Как выяснилось, она ими пользуется, чтобы искусно обходить иммунный ответ зараженного человека (Morello et al., 2019).
Как это происходит? Вспомним, что у нас есть несколько групп эйкозаноидов, тормозящих воспаление, и среди них липоксины, которые служат для своевременного завершения реакции на повреждение. И синегнойная палочка применяет свою липоксигеназу, чтобы направить синтез эйкозаноидов хозяина по нужному пути! Для этого она производит вещества-предшественники липоксинов, используя наши липиды – своих у нее нет. Эти молекулы затем захватываются человеческими иммунными клетками-макрофагами, где и происходит дальнейший синтез липоксинов, молекулы которых по мере «готовности» выходят через клеточную мембрану. Другие иммунные клетки в месте проникновения патогена воспринимают их как сигнал «Отбой тревоги!», защита отключается, и бактерия может спокойно делать свое черное дело.
Но все же синегнойная палочка – это лишь одна бактерия из множества «счастливых» обладателей липоксигеназы. И мы вновь возвращаемся к вопросу: зачем бактериальному миру липоксигеназы, вернее – оксилипины, которые с их помощью синтезируются?
Слово за биоинформатикой
 Чтобы разобраться в том, для чего организмам оксилипины и как они научились их производить, мы обратились к методам биоинформатики. Главным объектом послужила липоксигеназа – самый консервативный фермент биосинтеза оксилипинов, как уже упоминалось. Мы «просканировали» белковые последовательности бактерий и простейших, имеющиеся в базах данных, чтобы найти среди них липоксигеназы. А затем стали искать связи между наличием этого фермента и какими-нибудь особенностями его обладателя (Куракин, Самоукина, Потапова, 2020).
Чтобы разобраться в том, для чего организмам оксилипины и как они научились их производить, мы обратились к методам биоинформатики. Главным объектом послужила липоксигеназа – самый консервативный фермент биосинтеза оксилипинов, как уже упоминалось. Мы «просканировали» белковые последовательности бактерий и простейших, имеющиеся в базах данных, чтобы найти среди них липоксигеназы. А затем стали искать связи между наличием этого фермента и какими-нибудь особенностями его обладателя (Куракин, Самоукина, Потапова, 2020).
Начали с простой статистики: подсчитали встречаемость липоксигеназ в разных таксономических группах и уже на этом этапе как среди бактерий, так и среди простейших выявились таксоны-лидеры.
Среди бактерий особенно отличились миксобактерии (Myxococcales), а также ностоковые (Nostocales) и осциллаториевые (Oscillatoriales) из отдела цианобактерий. Среди простейших – миксомицеты, или слизевики (Mycetozoa), и оомицеты (Oomycota). Все эти таксоны объединяет одна важная черта – многоклеточность. Нет, здесь нет ошибки – многоклеточные бактерии и простейшие (как упомянутый выше слизевик диктиостелиум) существуют.
Начнем с цианобактерий. Под микроскопом многие из них выглядят как ниточка, да и по физиологии они напоминают нитчатые зеленые водоросли. Все клетки в нити соединены в подобие единого организма, причем между клетками имеются специальные контакты-мостики, через которые они обмениваются метаболитами. А клетки колоний ностоковых даже могут дифференцироваться в разные типы: вегетативные, формирующие саму «нитку», и гетероцисты, способные фиксировать азот.
 Миксобактерии и миксомицеты, несмотря на принадлежность к разным доменам, в некотором роде коллеги: у них сходный тип многоклеточности и похожая экология. Живут они в лесной подстилке, в почве, на разлагающейся листве и древесине, а питаются другими бактериями. При недостатке пищи миксобактерии сбиваются в «рой» для коллективной охоты, а когда становится совсем голодно, собираются в единый многоклеточный организм, формируя плодовые тела. Примерно то же самое способны делать и одноклеточные слизевики.
Миксобактерии и миксомицеты, несмотря на принадлежность к разным доменам, в некотором роде коллеги: у них сходный тип многоклеточности и похожая экология. Живут они в лесной подстилке, в почве, на разлагающейся листве и древесине, а питаются другими бактериями. При недостатке пищи миксобактерии сбиваются в «рой» для коллективной охоты, а когда становится совсем голодно, собираются в единый многоклеточный организм, формируя плодовые тела. Примерно то же самое способны делать и одноклеточные слизевики.
А вот оомицеты своей жизненной формой полностью копируют… грибы. Эти псевдогрибы даже формируют мицелий из нитей, хотя с точки зрения биохимии и филогенетики они ближе к некоторым водорослям.
Таким образом, лидерами по встречаемости липоксигеназ оказались таксоны, на которых эволюция «экспериментировала» в создании многоклеточности, пусть и примитивной.
Новые свидетельства в пользу этой гипотезы дал филогенетический анализ, суть которого состоит в реконструкции эволюции белков (или нуклеиновых кислот) на основе их последовательностей. Такие филогенетические модели обычно имеют вид дерева, мы же предпочли строить их в виде сети. Причина в том, что у нас были основания предполагать, что гены липоксигеназ между бактериями распространяются не вертикально (от общего предка к потомкам), а горизонтально – между разными видами.
 И предчувствия нас не обманули: оказалось, что бактерии передавали друг другу липоксигеназы в основном именно с помощью горизонтального переноса. Это стало понятно уже по тому факту, что эволюционно отдаленные группы попали в одни филогенетические кластеры. А учитывая относительно низкую распространенность многоклеточности в бактериальном мире, можно утверждать, что это не случайное совпадение.
И предчувствия нас не обманули: оказалось, что бактерии передавали друг другу липоксигеназы в основном именно с помощью горизонтального переноса. Это стало понятно уже по тому факту, что эволюционно отдаленные группы попали в одни филогенетические кластеры. А учитывая относительно низкую распространенность многоклеточности в бактериальном мире, можно утверждать, что это не случайное совпадение.
Дополнительный анализ показал, что липоксигеназы, скорее всего, сначала появились у цианобактерий. Эти организмы первыми на Земле научились формировать многоклеточные структуры. Скорее всего, они стали делать это уже во времена так называемой кислородной катастрофы – появления в атмосфере свободного кислорода около 2,5 млрд лет назад. От цианобактерий гены липоксигеназ неоднократно заимствовала другая группа многоклеточных бактерий – миксобактерии.
Чтобы реконструировать эволюцию липоксигеназ у эукариот, мы учли статистическую значимость каждой ветки, молекулярную эволюцию соответствующих таксонов и другие факторы. Собрав все данные воедино, мы выделили на филогенетическом дереве предположительные события обретения липоксигеназ разными группами многоклеточных эукариотов. И таких событий оказалось несколько! Все они были независимы друг от друга и, что самое главное, эволюционно связаны с моментами появления многоклеточности.
Бактерии: гении и злодеи
Дополнительный статистический и эволюционный анализ дал нам и неожиданные результаты. Похоже, что не одна синегнойная палочка использует липоксигеназу для вторжения в организм человека. Таких бактерий может быть много, что значительно увеличивает масштаб проблемы.

Среди видов, которые попали в нашу выборку, многие не обладают многоклеточностью ни в каком виде. Когда эти бактерии распределили по группам на основе их экологических особенностей, то среди них обнаружилось много симбиотических и патогенных микроорганизмов для человека.
В группу патогенов вместе с синегнойной палочкой попало много ее «коллег», мало опасных для здоровых, но очень опасных для людей с ослабленной иммунной системой или сопутствующими заболеваниями. Почти все представители этой группы чаще всего являются возбудителями внутрибольничных инфекций и вызывают у больных сходные поражения: сепсис, хирургическую инфекцию кожи и подкожной клетчатки, болезни легких.
Еще одна характерная черта бактерий этой группы – легкая смена хозяев, даже если они относятся к разным царствам. К примеру, та же синегнойная палочка способна поражать не только человека, но и растения. Она в этом не одинока: так делают, к примеру, бактерии Burkholderia gladioli и Pantoea ananas. Сами их названия говорят о том, какие растения предпочитают поражать эти виды, известные как опасные внутрибольничные патогены.
Судя по нашим данным, липоксигеназы всех патогенов и симбионтов при анализе кластеризуются вместе. И это, вероятно, неслучайно. Скорее всего, все эти бактерии используют стратегию синегнойной палочки: синтезируют оксилипины, с помощью которых «обманывают» иммунную систему хозяина.
 Такая роль этих сигнальных молекул также является разновидностью коммуникации – еще одной гранью биохимического «эсперанто». Причем эволюционно она, вероятно, вторична. Сначала бактерии изобрели липоксигеназу для поддержания оксилипиновой коммуникации между клетками, и этот «язык» прижился у ряда бактерий и у многих эукариот. И лишь впоследствии небольшая группа бактерий научилась использовать его для обмана, щедро поделившись с другими «злодеями».
Такая роль этих сигнальных молекул также является разновидностью коммуникации – еще одной гранью биохимического «эсперанто». Причем эволюционно она, вероятно, вторична. Сначала бактерии изобрели липоксигеназу для поддержания оксилипиновой коммуникации между клетками, и этот «язык» прижился у ряда бактерий и у многих эукариот. И лишь впоследствии небольшая группа бактерий научилась использовать его для обмана, щедро поделившись с другими «злодеями».
В итоге нашего биоинформатического исследования вырисовывается следующая картина. Липоксигеназы – основные ферменты пути синтеза сигнальных молекул оксилипинов – были, скорее всего, «изобретены» цианобактериями. Их позаимствовали другие многоклеточные бактерии – миксобактерии. Отдельные группы эукариот также переняли липоксигеназы (от кого именно, пока неизвестно) в те периоды своей истории, когда у них возникала многоклеточность, хотя бы и примитивная. Последняя закономерность прослеживается во всем живом мире. Она объясняет, почему липоксигеназы есть только у 0,5 % бактерий, тогда как у многоклеточных растений и животных их встречаемость гораздо выше.
Но здесь возникает другой вопрос: если липоксигеназы эволюционно сопутствовали обретению многоклеточности, то какую роль они в этом сыграли? Однозначного ответа на этот вопрос пока нет. Найденная связь лишь подтверждает гипотезу, что бактерии используют липоксигеназу для синтеза оксилипинов так же, как это делают растения и животные, и что именно они были авторами этой идеи. Но вот насколько такая коммуникация критична для возникновения многоклеточности? Этот вопрос весьма интригующий – вдруг ключ к сложности современного живого мира лежит именно здесь?
Изучение эволюции оксилипиновой сигнализации и самих липоксигеназ открывает и новые возможности использования последних в качестве генетического маркера опасных штаммов бактерий либо мишени для преодоления устойчивости к антибиотикам. И в этих выводах мы не одиноки.
Изучение у бактерий оксилипиновой сигнализации, которую животные и человек используют для межклеточного «общения», возможно, сможет помочь в разработке стратегий борьбы с бактериальной устойчивостью к антибиотикамТак, в 2019 г. группа под руководством Х. Кампоса-Гомеса из американской компании Southern Research экспериментально охарактеризовала еще одну оксилипиновую коммуникационную систему у синегнойной палочки, в которой участвует фермент диолсинтаза, не родственный липоксигеназе (Martínez, Cosnahan, Wu et al., 2019). То, что бактериальным патогенам необходимо «чувство кворума» при внедрении в организм человека, было известно и ранее, но обычно оно ассоциировалось с другими химическими соединениями. Теперь известно, что в этой форме бактериальной коммуникации задействованы и оксилипины, а воздействие на них может стать принципом действия новых антибиотиков.
Позже в журнале Infection Control Today вышла заметка с обнадеживающим названием: «Новый язык бактериальной сигнализации указывает путь к лечению инфекций» (2019). В ней Кампос-Гомес заявил: «Мы пытаемся разработать новое поколение антибиотиков, которые не убивают бактерии напрямую, что снижает их шансы на выработку резистентности. Мы хотим разоружить бактерии, а иммунная система сама разберется с ними». И это заявление удивительно перекликается с нашим обзором в Laboratory News под заголовком: «Липоксигеназы микроорганизмов: следующая мишень для борьбы с антибиотикорезистентностью?» (Kurakin, Samoukina, Potapova, 2020).
Мы надеемся, что результаты изучения эволюции оксилипиновой сигнализации, в ходе которого была сделана такая случайная находка, как ассоциация с бактериальной патогенностью, привлекут внимание наших научных и медицинских коллег к липоксигеназам, и эта работа станет примером фундаментального исследования, неожиданно давшего практический выход.
Литература
Куракин Г. Ф., Самоукина А. М., Потапова Н. А. Липоксигеназы бактерий и простейших могут участвовать в межклеточной сигнализации и подавлении иммунного ответа // Биохимия. 2020. Т. 85. №. 9. С. 1256–1273.
Савченко Т. В., Застрижная О. М., Климов В. В. Оксилипины и устойчивость растений к абиотическим стрессам // Биохимия. 2014. Т. 79. № 4. С. 458–475.
Хелдт Г.-В. Биохимия растений. М.: Бином. Лаборатория знаний, 2011. 472 с.
Andreou A., Brodhun F., Feussner I. Biosynthesis of oxylipins in non-mammals //Prog. Lipid Res. 2009. V. 48. N. 3/4. P. 148–170.
Brodhun F., Feussner I. Oxylipins in fungi // FEBS J. 2011. V. 278. N. 7. P. 1047–1063.
Freeman B. C., Beattie G. A. An overview of plant defenses against pathogens and herbivores // Plant Health Instructor. 2008.
Horn T., Adel S., Schumann R. et al. Evolutionary aspects of lipoxygenases and genetic diversity of human leukotriene signaling // Prog. Lipid Res. 2015. V. 57. P. 13–39.
Morello E., Perez-Berezo T., Boisseau C. et al. Pseudomonas aeruginosa lipoxygenase LoxA contributes to lung infection by altering the host immune lipid signaling // Frontiers Microbiol. 2019. V. 10. P. 1826.
https://www.infectioncontroltoday.com/view/new-bacterial-signaling-language-offers-pathway-treat-infections
https://www.labnews.co.uk/article/2031213/microbial-lipoxygenases-a-next-target-against-antibiotic-resistance
Публикация на основе статьи в сетевом издании «Биомолекула», опубликованной в рамках конкурса «БиоМолТекст-2020/2021»