Нобелевская премия по химии 2018 – за использование эволюционного подхода в создании белков с заданными свойствами
Нобелевскую премию по химии 2018 г. разделили пополам американка Фрэнсис Арнольд (Калифорнийский технологический институт), награжденная за развитие теории направленной эволюции ферментов, и американец Джордж Смит (Миссурийский университет) совместно с британцем Грегори Уинтером из Кембриджа – за создание метода «фагового дисплея» и адаптации его для наработки терапевтических антител. Достижения лауреатов прокомментировал 9 октября на ежегодной пресс-конференции СО РАН, посвященной итогам Нобелевской недели, к.х.н. В. В. Коваль, заместитель директора по научной работе Института химической биологии и фундаментальной медицины СО РАН
Нобелевская премия по химии в этом году вручена за два разных достижения, но оба они касаются молекулярной биологии белков, точнее, как указывают многие комментаторы, использования эволюционных механизмов для получения молекул белков и пептидов с заданными свойствами.
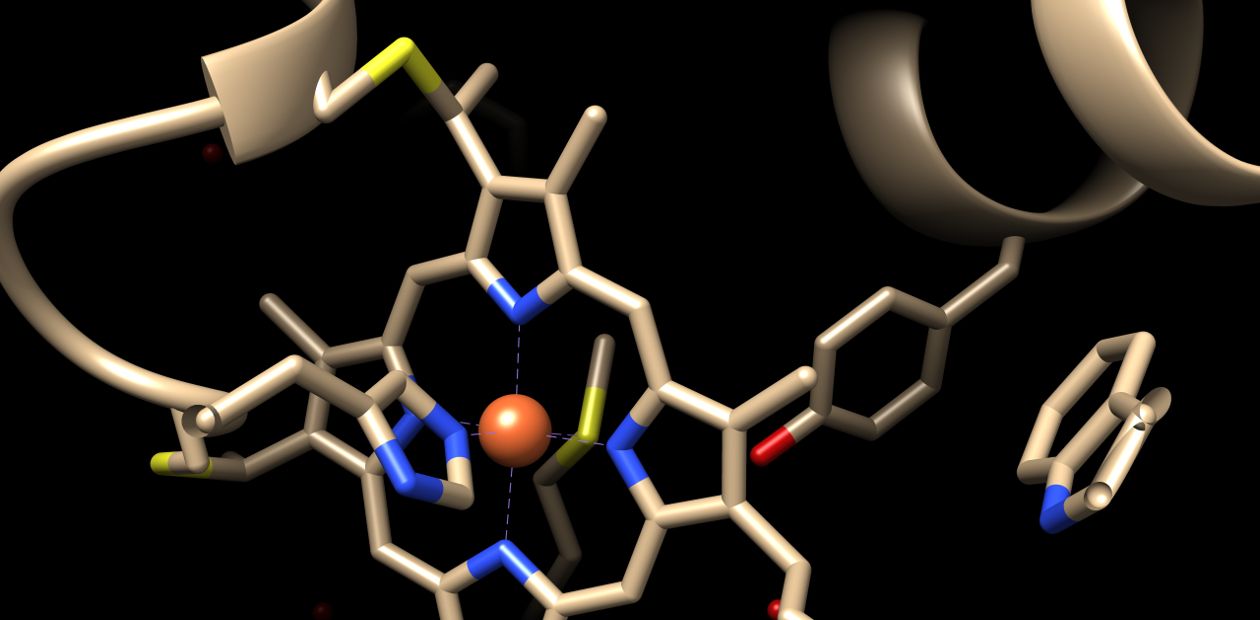
 Так, лаборатория Ф. Арнольд, ставшей пятой женщиной-лауреатом Нобелевской премии по химии, занимается направленной эволюцией ферментов. Как мы знаем, ферменты – это белки, которые служат катализаторами всех биохимических реакций, что происходят в клетке, это основа всего «живого». В процессе эволюции природа, безусловно, уже отобрала лучшие по эффективности активные центры и белковые структуры, которые работают наиболее быстро и специфично. Но человек пошел дальше. В современной медицине, в биотехнологии есть очень много задач, когда нужно изменить специфичность или оптимизировать работу живых клеток, и для этого нужно «заставить» ферменты выполнять несвойственные им функции. К примеру, большую часть витаминов сегодня получают биотехнологическим способом, а еще 10 лет назад для этих целей использовался более дорогой и длительный многостадийный химический синтез.
Так, лаборатория Ф. Арнольд, ставшей пятой женщиной-лауреатом Нобелевской премии по химии, занимается направленной эволюцией ферментов. Как мы знаем, ферменты – это белки, которые служат катализаторами всех биохимических реакций, что происходят в клетке, это основа всего «живого». В процессе эволюции природа, безусловно, уже отобрала лучшие по эффективности активные центры и белковые структуры, которые работают наиболее быстро и специфично. Но человек пошел дальше. В современной медицине, в биотехнологии есть очень много задач, когда нужно изменить специфичность или оптимизировать работу живых клеток, и для этого нужно «заставить» ферменты выполнять несвойственные им функции. К примеру, большую часть витаминов сегодня получают биотехнологическим способом, а еще 10 лет назад для этих целей использовался более дорогой и длительный многостадийный химический синтез.
Существует множество ферментов, множество белков – вводить точечные мутации и испытывать каждый вариант слишком долго и дорого. «Просчитать» заранее, какие изменения надо внести в сложную белковую структуру из сотен и тысяч аминокислот, трудно, а зачастую невозможно. Метод направленной эволюции ферментов – это скрининг, работающий по законам природы.
Как все происходит? К примеру, мы хотим определенным образом изменить какой-то фермент, чтобы он приобрел новые свойства. Для этого берем ген, кодирующий нужный фермент, и «в пробирке» генерируем образование случайным образом различных мутантных вариантов этого гена (в том числе и за счет «перетасовки» целых генных фрагментов, как это происходит при формировании половых клеток). Получившиеся ДНК-последовательности с помощью методов генной инженерии помещаем в бактерии, а затем отбираем микроорганизмы с нужной активностью ферментов. Другими словами, мы «копируем» природный эволюционный процесс, но делаем это гораздо быстрее.
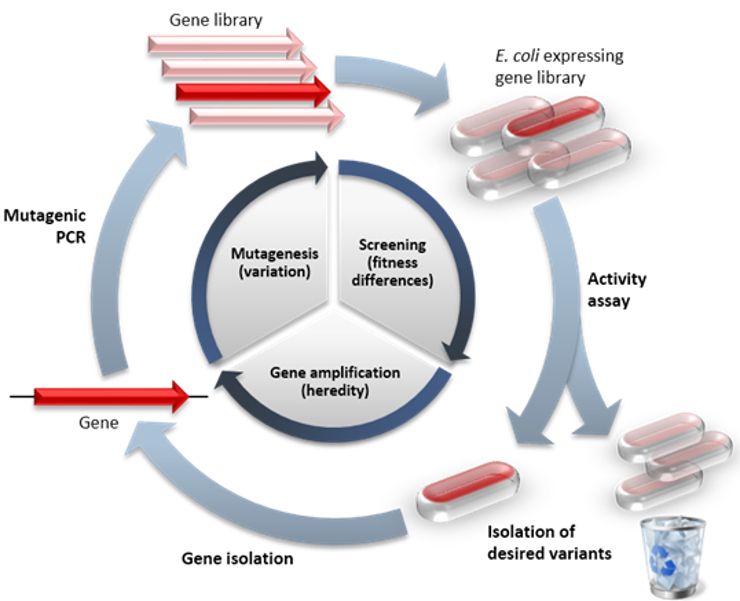
Метод направленной эволюции белков позволяет создавать ферменты с улучшенными свойствами, отсутствующие в природе ферменты, ферменты с расширенной и измененной субстратной специфичностью, «индустриальные» ферменты для биотехнологий. С помощью таких ферментов получают терапевтически значимые молекулы – витамины, антибиотики, ингибиторы и индукторы биохимических процессов и т.д. Сегодня все это – большой кусок индустрии, но при этом и важнейшее фундаментальное направление, судя по взрывному росту числа публикаций. Исследованиями в области направленной эволюции ферментов интенсивно занимаются во всех экономически развитых странах, в первую очередь в США. Подобные работы ведутся и в России, в частности, в СО РАН, однако в целом вклад отечественной науки в эту область, к сожалению, слишком мал.
Вторую половину Нобелевской премии получили исследователи, предложившие использовать для наработки белков с заданными свойствами бактериофаги – вирусы бактерий, которые имеют маленький собственный геном. Красивая идея фагового дисплея была впервые выдвинута Дж. Смитом в статье, опубликованной в Nature еще в 1985 г., когда существовала проблема соотнесения множества уже известных белков с участками ДНК, в которых эти белки закодированы. Последовательность ДНК к тому времени научились успешно секвенировать, но нужно было найти способ узнать, какие из этих расшифрованных фрагментов несут те или иные конкретные гены.
Суть технологии, предложенной для этих целей Смитом, состояла в том, чтобы встраивать фрагменты такой «неизвестной» ДНК в геном бактериофага (ученый предложил использовать для этого фаг M13 – достаточно крупный вирус кишечной палочки). И не в любое место, а туда, где находятся гены, кодирующие собственные поверхностные белки фага. В бактерии фаги размножаются, в результате чего образуется множество вирусных частиц, которые несут на поверхности уже не только свои, но и инородные белки. С помощью специфических антител к конкретному белку мы можем «выудить» из этой армии бактериофаги, несущие этот белок, «прочитать» их геном вместе со «вставкой» и идентифицировать нужный ген.
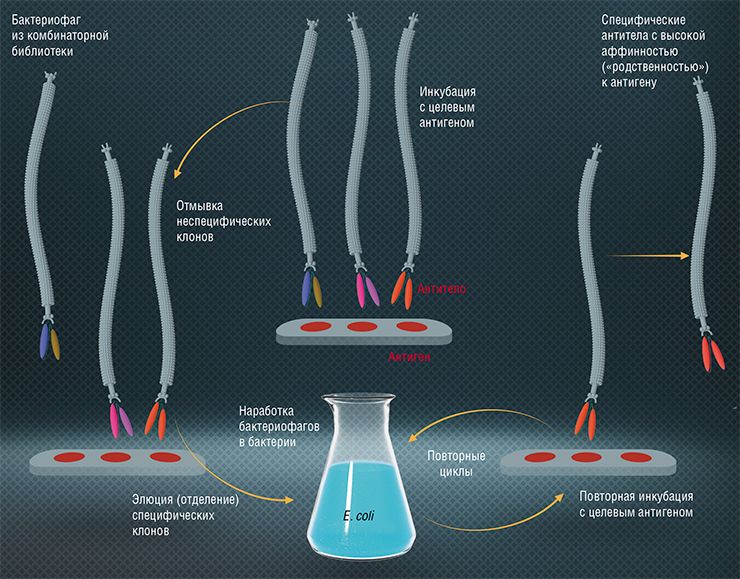
В процессе размножения фаги мутируют, поэтому в результате мы получаем обычно целый набор фаговых частиц, которые несут на своей поверхности немного различающиеся варианты белков – так получаются комбинаторные фаговые библиотеки, на основе которых можно вести отбор фагов, несущих белки с нужными свойствами. После секвенирования генома отобранных фагов исследователь получает генетическую конструкцию, которые можно «размножать» биотехнологическим способом.
Второй нобелевский лауреат, Г. Уинтер, адаптировал технологию фагового дисплея для получения антител к определенным антигенам. Он первым ввел в геном фага кусок ДНК, кодирующей фрагмент человеческого иммуноглобулина, ответственного за распознавание других молекул, а затем с помощью фагового дисплея отобрал варианты, наиболее эффективно взаимодействующие с целевой молекулой. С помощью такого подхода он и его коллеги разработали терапевтические препараты на основе антител для лечения аутоиммунных заболеваний, а затем и для применения в онкологии.
Сегодня эту замечательную методику широко используют для самых разных целей, включая отбор белков по специфическим свойствам, направленную модификацию белков, поиск, отбор и наработку терапевтических моноклональных антител, исследования рецепторов и картирования сайтов связывания антител и т.д. С ее помощью можно создавать противораковые препараты направленного действия и безопасные вакцины.
Фаговым дисплеем сегодня пользуются буквально все. В том числе в Институте химической биологии и фундаментальной медицины СО РАН с помощью этой технологии создан препарат Энцемаб от клещевого энцефалита на основе генно-инженерных гуманизированных антител, который успешно прошел доклинические испытания.
Фото: https://commons.wikimedia.org
Подготовила Татьяна Морозова