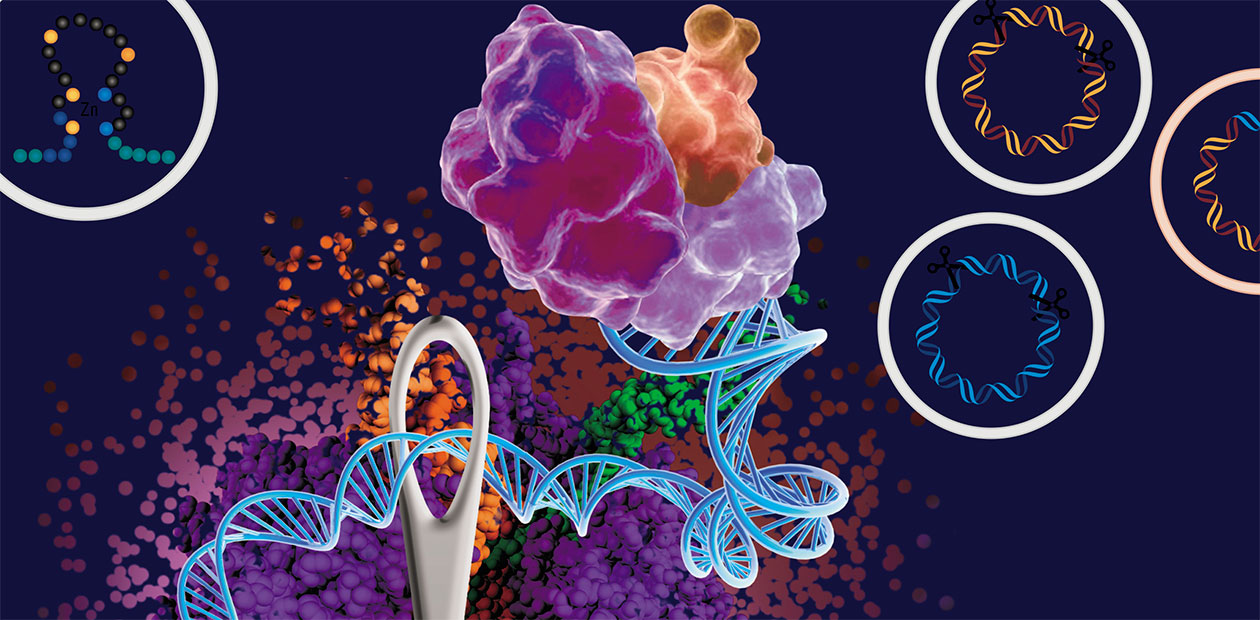
Ферменты для ДНК: скальпели, ножницы и швейные иголки
Как известно, практически все химические реакции в живых организмах протекают с огромными скоростями благодаря участию ферментов, чаще всего белковой природы. Ферменты работают как катализаторы, при этом их эффективность по сравнению с небелковыми катализаторами выше на несколько порядков. Они играют важнейшую роль во всех процессах жизнедеятельности организма, в том числе в метаболизме нуклеиновых кислот – ДНК и РНК, выполняющих функции по хранению, передаче и реализации наследственной информации любого живого существа: от бактерии до человека. Ферменты, «работающие» с нуклеиновыми кислотами, являются основными инструментами генных инженеров и крайне важны для развития современных биотехнологий. Однако поиск новых ферментов с улучшенными свойствами представляет собой нетривиальную задачу, для решения которой используются экспериментальные и биоинформационные подходы. А чтобы расширить этот поиск, к нему привлекают добровольцев-неспециалистов в рамках проектов гражданской науки, которая в последнее время становится эффективной частью научных исследований
 Колоссальная эффективность ферментативного катализа способствовала широкому применению ферментов во многих технологических процессах и сферах жизни человека. В наши дни ферментные препараты применяются в самых разных отраслях промышленности, в первую очередь пищевой (в хлебопечении, сыроварении, виноделии и др.) и легкой (например, в кожевенном производстве), при изготовлении моющих и косметических средств, а также в сельском хозяйстве (при приготовлении кормов и почвенных субстратов). Ферменты широко используются в фармацевтике и медицине, к примеру для диагностики.
Колоссальная эффективность ферментативного катализа способствовала широкому применению ферментов во многих технологических процессах и сферах жизни человека. В наши дни ферментные препараты применяются в самых разных отраслях промышленности, в первую очередь пищевой (в хлебопечении, сыроварении, виноделии и др.) и легкой (например, в кожевенном производстве), при изготовлении моющих и косметических средств, а также в сельском хозяйстве (при приготовлении кормов и почвенных субстратов). Ферменты широко используются в фармацевтике и медицине, к примеру для диагностики.
Особое место среди всех биокатализаторов занимают ферменты, способные «работать» с нуклеиновыми кислотами, ДНК и РНК. Именно таким ферментам обязано своим существованием одно из самых быстроразвивающихся направлений биотехнологии – генная инженерия, позволяющая напрямую манипулировать генетической информацией любого организма.
НОБЕЛЕВСКУЮ ПРЕМИЮ – ЗА ПЕРЕПИСЫВАНИЕ КОДА ЖИЗНИ Первое исследование ферментативного катализа как химического процесса было проведено российским химиком немецкого происхождения К. С. Кирхгофом: в 1814 г. он впервые продемонстрировал ферментативную конверсию крахмала в растворимые углеводы. В наши дни биокатализаторы являются неотъемлемой частью передовых наукоемких технологий. При этом ферменты, позволяющие синтезировать и изменять нуклеиновые кислоты, занимают среди них особое место, а их первооткрыватели были удостоены Нобелевской премии.В 1978 г. Нобелевскую премию по медицине и физиологии получили американцы Г. Смит, Д. Натанс и швейцарец В. Арбер за открытие ферментов рестриктаз, которые стали широко использоваться в молекулярной биологии и генетической инженерии. В 1993 г. премию присудили американскому биохимику К. Муллису за создание метода ПЦР (полимеразная цепная реакция), а в 2006 г. – Р. Д. Корнбергу за фундаментальные исследования молекулярных основ транскрипции (копирование генетической информации с ДНК на РНК) у высших эукариотических организмов.
В 2020 г. лауреатами Нобелевской премии стали француженка Э. Шарпантье и американка Д. Даудна за разработку метода, названного в пресс-релизе Нобелевского фонда «переписыванием кода жизни» и получившего неофициальное название «генетические ножницы». Разработанная ими технология редактирования генома с использованием ферментов-эндонуклеаз CRISPR-Cas благодаря своей простоте и удобству применения является на сегодня самой популярной среди всех методов генетического редактирования
Однако инструменты воздействия на геном появились не сразу, а возникали по мере развития молекулярной биологии, генетики и других смежных наук. Для манипулирования молекулами нуклеиновых кислот сегодня используют ферменты, исполняющие функции генетических «скальпеля», «ножниц» и «швейной иголки». С помощью этих специализированных молекулярных машин мы можем «разрезать» цепочку ДНК в строго определенном месте, вырезать из нее кусок или, напротив, вставить новый, «заштопав» дырку.
И каждый такой фермент с новыми свойствами открывает и новые возможности, служит толчком к развитию новых научных направлений. Так появилась, к примеру, система геномного редактирования CRISPR-Cas, «подсмотренная» у бактерий и позволившая совершить настоящий биотехнологический прорыв в биологии, медицине и сельском хозяйстве.
Без этих ферментов не существовало бы и таких современных диагностических систем, как получившие широкую известность ПЦР-тесты, основанные на использовании полимеразной цепной реакции, с помощью которой можно многократно умножать малые количества исходного генетического материала. За два года нынешней пандемии только в России было сделано около 240 млн ПЦР-тестов на коронавирусную инфекцию, а всего в мире – более 4,8 млрд.

К сожалению, ферменты, позволяющие манипулировать с молекулами ДНК, в буквальном смысле дороже золота. К примеру, на начало 2022 г. цены на некоторые из них превышали 30 тыс. руб. за 0,1 мл раствора очищенного фермента, тогда как актуальная мировая цена золота составляла всего около 4 тыс. руб. за 1 г.
Сейчас во всем мире, в том числе и в России, научные и биотехнологические компании постоянно ведут поиск новых, «улучшенных» ферментов для генетических технологий. Но это непростая задача. Где и как искать их, а главное, как определить, какие из найденных соединений обладают уникальными свойствами?
От тайги до британских морей
Новый исследовательский проект «Всероссийский атлас почвенных микроорганизмов как основа для поиска новых противомикробных продуцентов и ферментов с уникальными свойствами» реализуется в рамках Федеральной научно-технической программы развития генетических технологий на 2019–2027 гг. при поддержке Министерства науки и высшего образования РФ.
Проект предполагает проведение на территории РФ широкомасштабных микробиологических исследований с участием ведущих ученых и исследовательских организаций. В ходе проекта планируется собрать и проанализировать более 25 тыс. образцов почвы из разных регионов нашей страны. Одна из основных задач – поиск новых штаммов-продуцентов ферментов для редактирования ДНК, который проводится в рамках соглашений с Минобрнауки РФ на 2021–2023 гг.
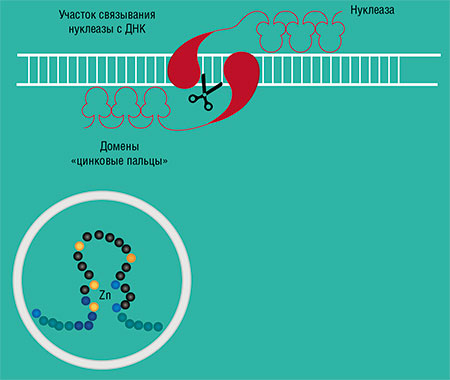
ИНСТРУМЕНТЫ ГЕННЫХ ИНЖЕНЕРОВ Какими они бывают – ферменты для манипуляции с самым сокровенным? Удивительно, но процедуры направленного изменения молекулы ДНК требуют относительно небольшого числа таких «инструментов».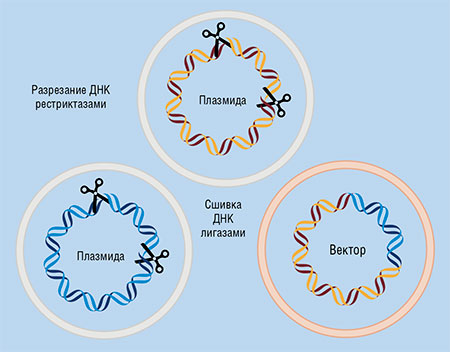 Во-первых, это ферменты, с помощью которых ДНК разрезают в определенном месте. Для выполнения такой процедуры долгое время использовали «классику» – ДНК-рестриктазы (от лат. restrictio – ограничение). В наши дни этот список активно пополняется природными и искусственными сайт-специфическими нуклеазами из семейств «цинковые пальцы», TALEN и CRISPR-Cas (Закиян, Власов, Медведев, 2014). На сегодня известно уже более 5 тыс. природных систем рестрикции-модификации, а «СибЭнзайм», одна из крупнейших российских биотехнологических компаний в этой области, производит и продает более 600 вариантов ферментов рестрикции.
Во-первых, это ферменты, с помощью которых ДНК разрезают в определенном месте. Для выполнения такой процедуры долгое время использовали «классику» – ДНК-рестриктазы (от лат. restrictio – ограничение). В наши дни этот список активно пополняется природными и искусственными сайт-специфическими нуклеазами из семейств «цинковые пальцы», TALEN и CRISPR-Cas (Закиян, Власов, Медведев, 2014). На сегодня известно уже более 5 тыс. природных систем рестрикции-модификации, а «СибЭнзайм», одна из крупнейших российских биотехнологических компаний в этой области, производит и продает более 600 вариантов ферментов рестрикции.
Следующая группа – ДНК-полимеразы, которые катализируют синтез ДНК с поразительной скоростью и точностью. Эти молекулярные машины широко используются в биотехнологии, например в многообразных ПЦР-тестах для обнаружения мутаций, которые могут привести к развитию наследственных заболеваний, а также для выявления инфекционных агентов. В биотехнологии и генетической инженерии ДНК-полимеразы, как правило, применяют для синтеза двуцепочечных фрагментов и «размножения» целевых фрагментов ДНК.
Еще одна группа ферментов может соединять или модифицировать концы фрагментов ДНК. Например, ДНК-лигазы соединяют фрагменты ДНК, используя комплементарность их «липких концов». А нуклеотидилтрансферазы способны присоединить к цепочке ДНК модифицированное звено-нуклеотид
Проект, базирующийся на принципах гражданской науки, предполагает привлечение к работе большого числа волонтеров, преимущественно школьников и студентов. Добровольцы принимают участие в начальных стадиях поиска: сборе почвы, посеве образцов на питательную среду в чашки Петри, первичном анализе микробных сообществ. Затем образцы почвы поступают в Институт химической биологии и фундаментальной медицины СО РАН (Новосибирск), который в рамках этого проекта возглавляет консорциум из семи научно-исследовательских организаций.
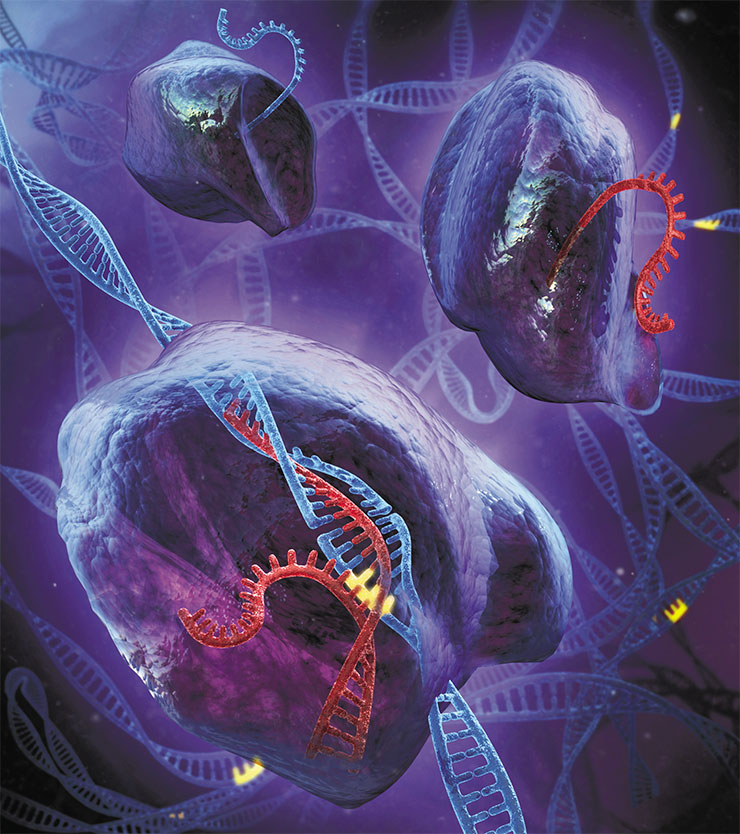
Современная система CRISPR/Cas состоит из двух основных частей: некодирующей РНК и ферментов-нуклеаз Cas. Направляющая РНК находит целевой участок гена и присоединяется к нему с помощью Cas-белков. В месте посадки нуклеаза разрезает цепь ДНК. В разрез можно встроить любую донорную молекулу ДНК: таким образом можно исправлять генетические нарушения или придавать организму новые свойства
В ИХБФМ СО РАН образцы почвы используются для культивирования микроорганизмов в лабораторных условиях. Каждый из них содержит десятки и сотни видов микроорганизмов, в том числе ранее неизвестных, которые являются потенциальными обладателями ферментов с новыми свойствами, например высокоточной ДНК-полимеразой или ДНК-рестриктазой с уникальным сайтом узнавания, либо новыми ферментами семейства CRISPR-Cas, которые являются частью системы бактериального «иммунитета».
Только в 2021 г. за первые три месяца реализации этого проекта 45 школьных команд собрали и отправили новосибирским исследователям около 500 образцов почвы.
В поиске «генетических ножниц»
 Один из генно-инженерных подходов для направленного воздействия на ДНК в составе генома – это высокоселективное расщепление на фрагменты одной либо сразу двух цепей ДНК в определенном участке. Так работают ферменты рестрикции (ДНК-рестриктазы, или рестрикционные эндонуклеазы), которые расщепляют двуцепочечную ДНК по определенным нуклеотидным последовательностям («сайты рестрикции»).
Один из генно-инженерных подходов для направленного воздействия на ДНК в составе генома – это высокоселективное расщепление на фрагменты одной либо сразу двух цепей ДНК в определенном участке. Так работают ферменты рестрикции (ДНК-рестриктазы, или рестрикционные эндонуклеазы), которые расщепляют двуцепочечную ДНК по определенным нуклеотидным последовательностям («сайты рестрикции»).
Наибольший интерес вызывают ДНК-рестриктазы, формирующие на концах разрыва характерные структуры – так называемые липкие концы. Они представляют собой одноцепочечные участки, которые можно использовать для направленного комплементарного соединения фрагментов ДНК на следующих этапах создания новой генетической конструкции.
На сегодня известны сотни ДНК-рестриктаз, отличающиеся последовательностью нуклеотидов в «сайте рестрикции» и «липких концах». Так, ферменты никующие эндонуклеазы (ДНК-никазы) специфически узнают определенную последовательность в ДНК так же, как и ДНК-рестриктазы. Однако они «разрывают» только одну цепь двойной нити.
Последние достижения в области геномной инженерии связаны с применением ДНК-нуклеаз семейства CRISPR/Cas. Они разрывают ДНК там, куда им указывает «стрелочник» – направляющая РНК, которая комплементарно присоединяется к целевому участку генома. А использование синтетических направляющих РНК позволяет внести разрыв практически в любое заданное место.
Открытие бактерий-продуцентов новых рестриктаз, высокоспецифичных к своим «сайтам рестрикции» и без побочной неспецифической активности, позволит расширить список ферментов для биотехнологий и заменить имеющиеся на более эффективные.
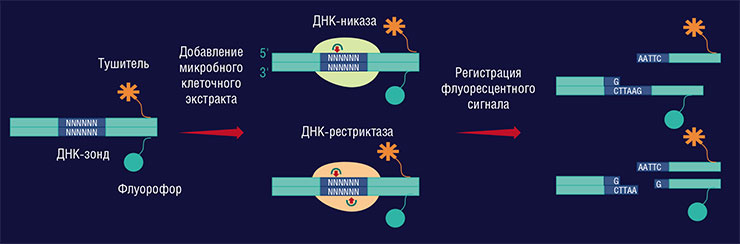
Классические варианты поиска ферментативной системы рестрикции-модификации в микроорганизмах основаны на прямом тестировании их клеточных экстрактов. Этими экстрактами обрабатывают образцы, содержащие протяженные фрагменты ДНК (например, ДНК фага λ), а затем измеряют в них содержание продуктов расщепления.
В лаборатории генетических технологий ИХБФМ СО РАН разработан высокочувствительный метод поиска ферментов рестрикции, для которого достаточно использовать одну колонию микроорганизмов, выращенную в чашке Петри.
Основой метода служат специальные ДНК-зонды – небольшие «кусочки» молекулы ДНК, каждый из которых имеет «рандомизированный» участок из шести звеньев-нуклеотидов, «собранных» случайным образом (напомним, что всего существует четыре природных нуклеотида). В результате мы получаем набор ДНК-зондов с огромным числом разных нуклеотидных последовательностей в этом участке, и среди этих вариантов могут оказаться и те, что будут узнаваться и расщепляться ферментами конкретного микроорганизма.
Активность ферментов рестрикции в исследуемом образце регистрируется по многократному увеличению флуоресцентного сигнала, который возникает лишь в том случае, если там идет активное расщепление молекул ДНК-зондов.
Сплести нить ДНК
В основе метода ПЦР лежит многократное последовательное удвоение определенного участка исходной молекулы ДНК с помощью ДНК-полимеразы – фермента, который присутствует в каждом организме без исключения. Ферменты, позволяющие проводить ПЦР с высокой точностью, очень востребованы как для исследовательских целей, так и для создания диагностических медицинских тест-систем.
Для поиска новых ДНК-полимераз в институте используют два взаимодополняющих подхода. Первый, более «классический» основан на экспериментальной проверке клеточных экстрактов всех исследуемых микроорганизмов на наличие полимеразной активности в жестких температурных условиях. При втором подходе проводится биоинформационный скрининг генов образца, кодирующих ДНК-полимеразы, с применением «маркерного шаблона». Последний был создан на основе данных строения активных центров ДНК-полимераз, которые уже используются в молекулярной биологии.
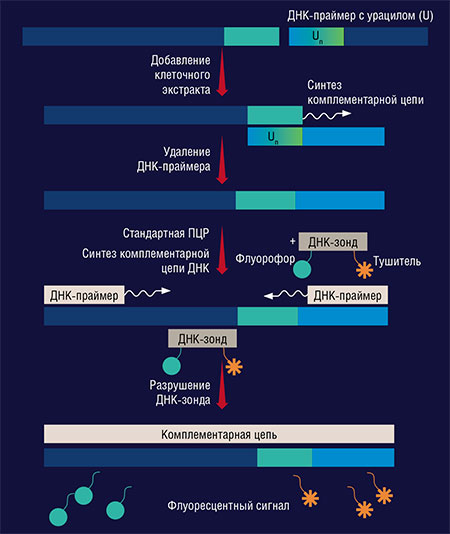 Экспериментальное определение активности микробных ДНК-полимераз проводится в несколько стадий. При этом основным субстратом служит «ДНК-матрица» – короткий фрагмент одноцепочечной ДНК, которая может достраиваться под действием ферментов полимераз, присутствующих в клеточном экстракте колонии одного из микроорганизмов почвенного образца.
Экспериментальное определение активности микробных ДНК-полимераз проводится в несколько стадий. При этом основным субстратом служит «ДНК-матрица» – короткий фрагмент одноцепочечной ДНК, которая может достраиваться под действием ферментов полимераз, присутствующих в клеточном экстракте колонии одного из микроорганизмов почвенного образца.
Чтобы выстроить по одной цепи ДНК вторую, комплементарную ей цепь, одной полимеразы недостаточно: в качестве «затравки» всегда используют праймер – короткий фрагмент ДНК, комплементарный мишени. В нашем случае применяется не совсем обычный праймер: в его составе нуклеотид тимидин заменен урацилом, который встречается только в РНК.
При инкубации матричного субстрата с праймером и клеточным экстрактом молекулы ДНК-матрицы могут удлиняться благодаря действию микробной полимеразы. Сам праймер затем удаляется путем добавления специального фермента.
На следующем этапе проводится стандартная ПЦР со стандартными праймерами и полимеразой, кроме того, в реакционную смесь добавляется специальный ДНК-зонд с флуоресцентной меткой. При достраивании комплементарной цепи на молекулах ДНК-матрицы все присоединившиеся ДНК-зонды разрушаются из-за специфической активности полимеразы, что приводит к появлению флуоресцентного сигнала. Такой результат означает, что в исходном клеточном экстракте присутствовала микробная ДНК-полимераза, которая смогла работать в заданных условиях среды.
В биоинформационном анализе используются данные геномного секвенирования микроорганизмов из образцов почвы, собранных в рамках проекта. Уже в течение первых трех месяцев работы по проекту были расшифрованы сотни последовательностей генов разных микробных ДНК-полимераз.
В дальнейшем эти данные были проанализированы, чтобы найти гомологи ферментов, которые уже используются в биотехнологии. В результате удалось обнаружить восемь генов ДНК-полимераз, потенциально обладающих нужными свойствами. При этом выяснилось, что два фермента производятся неизвестными ранее видами микроорганизмов и представляют особый интерес для дальнейшего изучения.
 Совмещение двух разных подходов позволяет, с одной стороны, отобрать микроорганизмы, ДНК-полимераза которых эффективно функционирует в «неблагоприятных» условиях, а с другой – оценить их сходство с известными ферментами.
Совмещение двух разных подходов позволяет, с одной стороны, отобрать микроорганизмы, ДНК-полимераза которых эффективно функционирует в «неблагоприятных» условиях, а с другой – оценить их сходство с известными ферментами.
Уже первые результаты по поиску ферментов для манипуляции с нуклеиновыми кислотами, полученные в рамках масштабного всероссийского проекта по изучению почвенных микроорганизмов, показали его перспективность. Но основная работа еще впереди.
Когда гены нужных ферментов будут идентифицированы, с помощью стандартных генно-инженерных методов можно будет создавать автономные генетические конструкции (плазмиды) для наработки этих биокатализаторов в клетках-суперпродуцентах, использующихся для биотехнологических целей. Очищенные препараты ферментов будут изучаться, чтобы определить эффективность ферментативной реакции и другие важные параметры, например точность встраивания нуклеотидов в растущую цепь для ДНК-полимеразы или специфичность «генетических ножниц» к определенной последовательности ДНК.
Учитывая масштабность проекта, нет сомнений, что он увенчается успехом. А открытие новых ферментов с уникальными свойствами позволит существенно расширить инструментальный арсенал генетических технологий, без которых невозможно представить современные промышленность, сельское хозяйство и медицину.
Литература
Власов В. В. Гражданская наука: приглашаются все! // НАУКА из первых рук. 2021. № 5/6(92). С. 128–145.
Власов В. В., Медведев С. П., Закиян С. М. «Редакторы геномов». От «цинковых пальцев» до CRISPR //НАУКА из первых рук. 2014. 2(56). С. 44–53.
Aschenbrenner J., Marx A. DNA polymerases and biotechnological applications // Curr. Opin. Biotechnol. 2017. V. 48. P. 187–195.
Tamura R., Toda M. Historic overview of genetic engineering technologies for human gene therapy // Neurol Med. Chir. 2020. V. 60(10). P. 483–491.
Wang F., Li P., Chu H. C. et al. Nucleic acids and their analogues for biomedical applications // Biosensors. 2022. V. 12(2). P. 93.