Хрусталик: солнечное «затмение»
Фотофизические и фотохимические процессы в глазу
Солнечный свет играет важнейшую роль в жизни всех земных организмов: без реакций фотосинтеза, в результате которых из простых веществ создаются органические соединения, само существование жизни на планете было бы невозможно. Излучение Солнца нагревает атмосферу Земли и дарит нам хорошее настроение в погожий день. Но солнечный свет, в первую очередь его ультрафиолетовая составляющая, может воздействовать на организм человека и пагубным образом, вызывая солнечные ожоги и даже рак кожи. Кроме того, наши органы зрения, в отличие от кожи, которую можно защитить одеждой, неминуемо подвергаются регулярному и продолжительному воздействию солнечного УФ-излучения. Есть ли у наших глаз природная защита от этого злокозненного света, как она устроена и как меняется с возрастом?
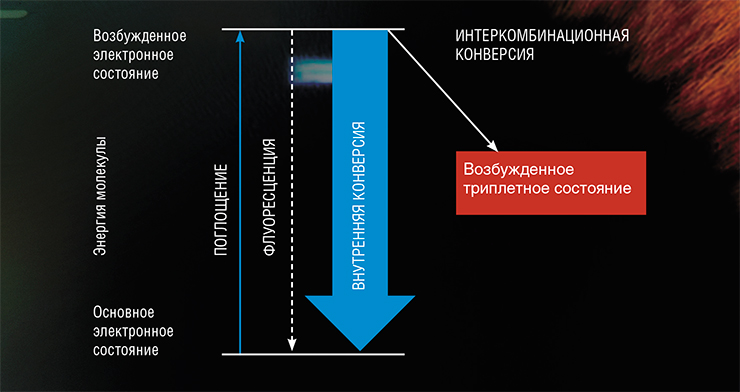
Почему ультрафиолетовое излучение представляет опасность для человека? Дело в том, что в результате поглощения света органической молекулой (например, белком) один из ее электронов (отрицательно заряженных элементарных частиц, «заселяющих» атомные орбитали с разной энергией) переходит на более высокий энергетический уровень. Такой процесс называют переходом из основного в возбужденное состояние. Сам по себе он не приносит вреда организму человека, но угрозу может представлять путь, по которому молекула будет возвращаться из такого крайне неустойчивого состояния в основное.
Возбужденная светом молекула, как богатырь в русской сказке, оказывается на распутье: перед ней открываются три пути. Во-первых, она может вернуться к первоначальному состоянию благодаря флуоресценции – излучению энергии в виде кванта света. Она также может израсходовать избыточную энергию на разогрев окружающей среды – это так называемая внутренняя конверсия. Оба эти процесса для живых существ вполне безопасны, так как не инициируют никаких химических реакций. Но вот третий путь…
 Прежде чем говорить о нем, вспомним о квантовом понятии спин, означающем момент импульса, внутренне присущий элементарным частицам, который не связан с их реальным перемещением (вращением) в пространстве и поэтому не имеет аналогии в классической механике. Благодаря своей квантовой природе спин может принимать лишь дискретные, строго определенные значения: к примеру, спин электрона равен 1/2.
Прежде чем говорить о нем, вспомним о квантовом понятии спин, означающем момент импульса, внутренне присущий элементарным частицам, который не связан с их реальным перемещением (вращением) в пространстве и поэтому не имеет аналогии в классической механике. Благодаря своей квантовой природе спин может принимать лишь дискретные, строго определенные значения: к примеру, спин электрона равен 1/2.
С наличием у электрона спина связано явление мультиплетности молекулы, которая рассчитывается на основе суммарного спина всех ее электронов плюс единица. В обычных условиях у абсолютного большинства молекул все электроны имеют пару и, соответственно, нулевой суммарный спин. Соответственно, их мультиплетность равна 1 – это так называемое синглетное состояние (S-состояние).
Однако когда один из электронов переходит на более высокий энергетический уровень, т. е. вся молекула оказывается в возбужденном состоянии, то образуется два электрона без пар. В этом случае мультиплетность молекулы зависит от проекции спинов и ее величина может принимать значение как 1, так и 3. Изменение мультиплетности с 1 на 3 означает переход молекулы из синглетного в триплетное состояние (Т-состояние), а сам процесс изменения спинового состояния молекулы называется интеркомбинационной конверсией.
Это и есть тот третий путь, на котором могут запускаться нежелательные реакции. Дело в том, что, согласно постулатам квантовой механики, переход из возбужденного триплетного состояния в основное синглетное запрещен, что позволяет Т-состоянию существовать долгое время. Такая молекула с избытком энергии становится опасной частицей, способной реагировать с большим числом своих соседей. Кстати, в S-состоянии молекула также способна запускать химические реакции, но время жизни такого состояния настолько коротко, что она, как правило, не успевает встретить партнера по реакции.
Химические реакции в таких случаях могут быть очень разнообразными и зависят в первую очередь от самих соседей. Как правило, такие реакции необратимы и приводят к повреждению молекул, прежде всего белков и липидов, поскольку они наиболее представлены в живых клетках. Накопление дефектных молекул может со временем инициировать развитие различных патологий, таких как рак кожи и катаракта – помутнение хрусталика глаза.
Свет – в тепло
Глаз млекопитающих и человека – сложный орган, состоящий из нескольких сложноорганизованных частей. Основной оптический элемент – хрусталик, который пропускает и фокусирует свет на поверхности сетчатки. Но эта его функция не единственная.
В 1970-е гг. было установлено, что хрусталик одновременно играет и роль светофильтра, поглощая излучение в ближнем ультрафиолетовом диапазоне (УФ-А-излучение, 315—400 нм). Это излучение составляет около 95 % всего УФ-излучения на поверхности Земли и не задерживается облаками и оконным стеклом. Более того, оно способно инициировать фотохимические реакции, приводящие к повреждению в первую очередь фоточувствительных клеток сетчатки.
Это открытие было сделано благодаря голландской исследовательнице Рут ван Хайнинген, которая впервые показала, что хрусталик человека содержит большие количества кинуренина (промежуточного продукта ферментативного распада аминокислоты триптофана) и его производных. Уже первые исследования доказали, что кинуренины способны поглощать излучение в УФ-А-диапазоне, а сами его не излучают, т. е. служат молекулярными УФ-фильтрами. Однако механизм их «работы» оставался неизвестным до недавнего времени.
При изучении фотофизических и фотохимических свойств кинуренина в Международном томографическом центре СО РАН (Новосибирск) выяснилось, что в водных растворах под действием УФ-А-излучения эта молекула светится слабо (Sherin et al., 2009) и производит крайне малое количество реакционно-активных триплетных состояний (Центалович, 2009). Это означает, что кинуренин возвращается из возбужденного состояния в обычное преимущественно путем преобразования энергии света в тепло, т. е. с помощью внутренней конверсии, причем очень быстро и эффективно.
Чтобы понять, как это происходит, поведение кинуренина исследовали в широком наборе растворителей. Оказалось, что скорость перехода этой молекулы из возбужденного состояния в основное напрямую зависит от способности растворителя образовывать межмолекулярные водородные связи, при которых атом водорода связывает между собой два электроотрицательных атома. Так, в водном растворе время перехода было равно 30 пс (1 пикосекунда = 10–12 секунды), в спиртовых – на порядок больше. В тех же растворителях, которые не могут быть донором водородной связи, эта величина возрастала в 100 раз! Иными словами, именно межмолекулярные водородные связи обеспечивают доминирование внутренней конверсии в фотофизике кинуренина.
Установление механизма работы кинуренина в качестве молекулярного УФ-фильтра важно с точки зрения фотобиологии. Стало понятно, что ему требуется среда, насыщенная межмолекулярными водородными связями, например спирты или вода. В отсутствие водородных связей молекулы в синглетном возбужденном состоянии переходят в реакционно-активные триплетные состояния (Sherin, 2009). После этого светофильтр превращается в фотосенсибилизатор, который под действием света может повреждать молекулы из своего ближайшего окружения, в данном случае – белки хрусталика глаза.
Как стареет хрусталик
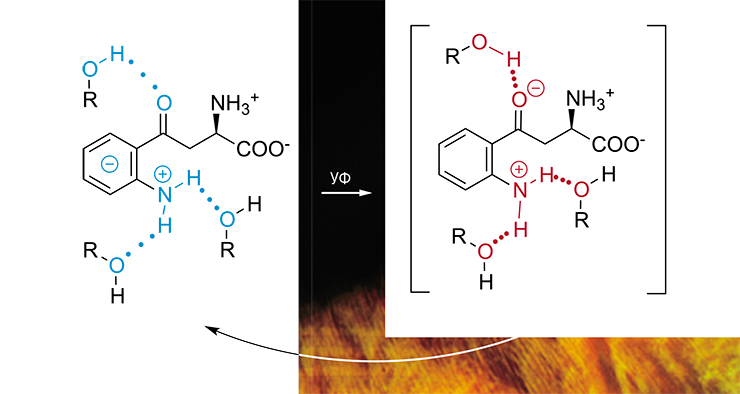
Как показали исследования австралийских ученых, с возрастом содержание кинуренинов в хрусталике человека существенно снижается (Bova et al., 2001) во многом из-за их присоединения к белкам (Korlimbinis et al., 2007). Это естественный процесс, в результате которого в хрусталике идет накопление белков, модифицированных кинуренином. Но чем является такой «присоединенный» кинуренин – эффективным УФ-фильтром или фотосенсибилизатором?
Эксперименты с использованием кинуренина, к которому были искусственно присоединены аминокислоты или белки, показали, что скорость «гибели» его возбужденного состояния зависит от объема присоединенной молекулы (Sherin et al., 2010). Чем больший объем будет занимать молекула-заместитель, тем меньше возможностей остается для кинуренина установить межмолекулярные водородные связи. А это, в свою очередь, замедлит процесс внутренней конверсии поглощенной энергии.
В случае белка важную роль играет и само расположение кинуренина внутри крупной и упорядоченной макромолекулы: чем глубже он будет находиться, тем дольше будет «жить» его возбужденное состояние и, соответственно, тем больше шансов для него перейти в реакционно-активное Т-состояние. Таким образом, прочное связывание кинуренина с белками хрусталика усиливает его фотосенсибилизирующие свойства.

Образование триплетных состояний кинуренина является первым шагом на пути модификации белков внутри клеток хрусталика, к слову сказать, очень необычных. Они представляют собой прозрачные волокна длиной до 1 см, тянущиеся от переднего к заднему краю хрусталика и плотно прилегающие друг к другу на манер луковичных чешуй. Их отличительная особенность – отсутствие клеточных ядер и органелл, которые могли бы рассеивать свет и ухудшать параметры светопропускания ткани. Соответственно, в клетках хрусталика нет биохимической машины по синтезу, восстановлению и утилизации белков, поэтому его белки – кристаллины – не обновляются на протяжении всей жизни человека.
Тем самым с возрастом белки хрусталика накапливают многочисленные химические модификации, которые приводят к существенному изменению свойств хрусталика: увеличению его жесткости, появлению желтой окраски и возрастанию светорассеяния. Однако до недавнего времени оставалось неясным, какие именно изменения в структуре белков могут вызывать возбужденные светом молекулы кинуренинов.
Как свет «сшивает» белки
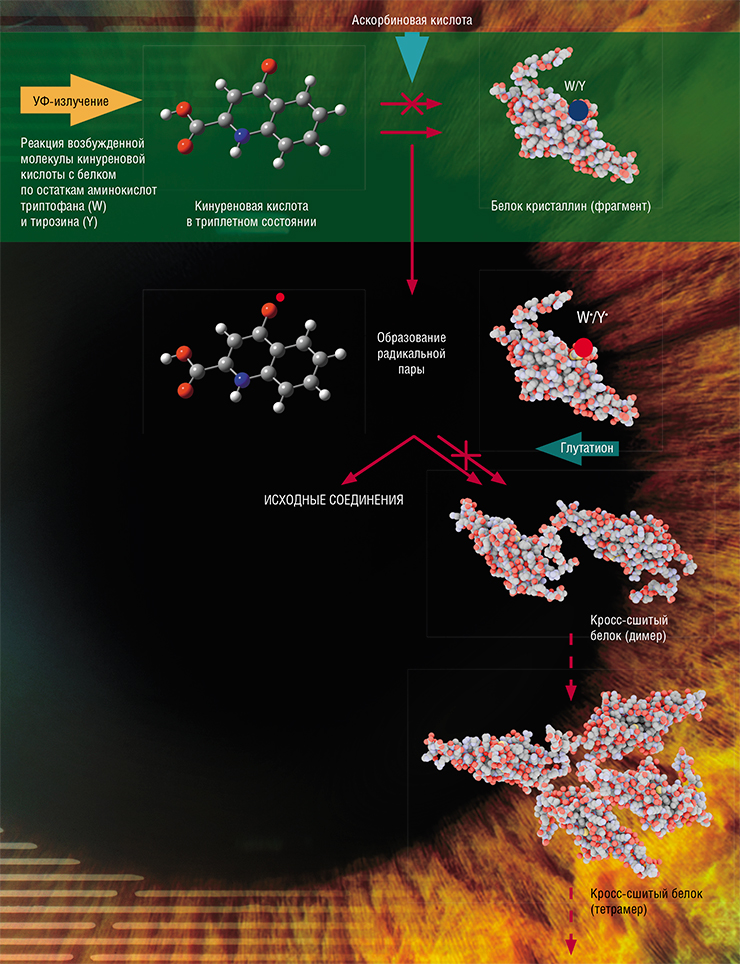
Мощным фотосенсибилизатором является одно из производных кинуренина – кинуреновая кислота. Однако эксперименты по длительному облучению белков в присутствии этого вещества дали неожиданные результаты. Несмотря на то что под действием света кинуреновая кислота образует триплетные состояния почти со 100 % эффективностью (1 квант света – 1 молекула), лишь малая часть дальнейших реакций приводит к модификации белков (Sherin et al., 2016).
Оказалось, что в триплетном состоянии кинуреновая кислота охотно отбирает электрон у белков с образованием свободных радикалов и не менее охотно отдает его обратно при следующей встрече. В итоге в растворе преимущественно идут быстрые обратные реакции с образованием исходных веществ, а не реакции, приводящие к повреждению белков (Sormacheva et al., 2020).
Тем не менее белок в форме радикала «страдает», имея неспаренный электрон, и при встрече с себе подобным «с удовольствием» им делится с формированием полноценной электронной пары. В результате белковые молекулы образуют прочную и крепкую ковалентную связь, сшиваясь друг с другом навечно.
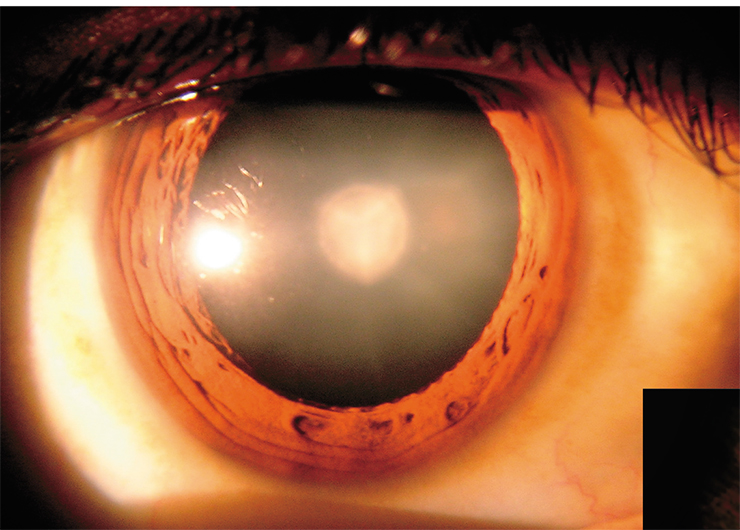
Процесс такого «сшивания» белков небыстрый, ведь им нужно найти на поверхности друг у друга радикальные центры, при том что сами молекулы представляют собой большие глобулы. Зато маленькая и подвижная молекула кинуреновой кислоты делает это гораздо быстрее, нейтрализуя радикальные центры белков. Тем не менее некоторые белки успевают «сшиться», образуя глобулы из двух, трех молекул и более. На каком-то этапе они могут терять водорастворимость и выпадать в осадок. Так в хрусталике глаза появляются светорассеивающие области – развивается катаракта.
Другим любопытным результатом этих экспериментов стало выяснение роли молекулярного кислорода в фотохимических реакциях (Sormacheva et al., 2020). Оказалось, что когда радикал кинуреновой кислоты вступает в реакцию с остаточным кислородом, то первый возвращается в исходное состояние, а второй, захватив «лишний» электрон, превращается в супероксид-анион. Несмотря на то что супероксид-анион широко известен как очень опасная реакционная форма кислорода, его образование, напротив, способствует возвращению кинуреновой кислоты и белков в исходные состояния. Так был обнаружен удивительный эффект, когда кислород выполняет защитную функцию, существенно снижая количество необратимых модификаций аминокислот.
Известно, что хрусталик человеческого глаза в больших концентрациях содержит антиоксиданты – глутатион и аскорбиновую кислоту. Фотолиз кинуреновой кислоты с белком в присутствии этих соединений показал, что оба антиоксиданта действительно успешно предотвращают модификацию белков и могут защитить хрусталик от фотоиндуцированных повреждений.
При этом механизм действия у них оказался разный. Аскорбиновая кислота является эффективным «тушителем» триплетных состояний, что предотвращает реакции возбужденных молекул кинуренинов с молекулами белков. А вот глутатион – это игрок второй линии защиты: он способен перехватывать свободные радикалы, восстанавливая их до исходного состояния и предотвращая связывание молекул белков по радикальным механизмам.
Следует отметить, что эффективность (или на языке фотохимии – квантовые выходы) реакций, приводящих к фотоповреждениям белков хрусталика, очень мала: выход триплетных состояний для большинства кинуренинов не превышает 1 %, причем даже в самых «бескислородных» растворах уровень общего распада белка составлял всего 1—2 % от поглощенных квантов света (Sherin et al., 2016; Savina et al., 2020).
Таким образом, общая эффективность фотоиндуцированных радикальных реакций в хрусталике не превышает 0,01 %. А природные антиоксиданты, глутатион и аскорбиновая кислота, многократно снижают эффективность этих реакций, «перехватывая» реакционно-активные частицы, и практически полностью предотвращают фотоиндуцированные модификации белков.
Чтобы сохранить целостность хрусталика глаза, природа использует уникальный каскад процессов трансформации энергии опасного для живых организмов УФ-излучения света в тепло. Как результат, ткани глаза остаются эффективно защищенными от пагубного солнечного излучения в молодом и среднем возрасте. С годами эффективность транспорта малых молекул в хрусталике снижается, что приводит к накоплению продуктов распада и замедлению поступления нужных веществ, включая антиоксиданты. В результате модификация белков ускоряется и накопление таких необратимых изменений может дать начало развитию катаракты.
Тем не менее катаракта не является неизбежным следствием старения: у многих людей хрусталики остаются прозрачными даже в очень преклонном возрасте. Самые частые вопросы, которые задают на эту тему: «Почему у большинства людей до 50 лет хрусталик остается прозрачным, а потом вдруг начинает мутнеть?» и «Можно ли что-нибудь сделать уже сейчас, чтобы замедлить развитие катаракты?»
Мы полагаем, что возникновение катаракты в первую очередь обусловлено не многолетним накоплением модифицированных белков, а ослаблением природной антиоксидантной защиты хрусталика. Отсюда следуют достаточно тривиальные рекомендации: наилучшей профилактикой катаракты является здоровый и активный образ жизни, поддерживающий защитные системы организма в хорошем состоянии.
Заметим, что человеческий организм не способен синтезировать аскорбиновую кислоту, играющую важную роль в защите белков хрусталика. Следовательно, очень важно в течение всего года получать в пищу достаточное количество свежих фруктов и других продуктов, содержащих этот антиоксидант. А так как содержание УФ-фильтров в хрусталиках людей старшего возраста значительно уменьшается, для них намного более актуальным, чем для молодежи, становится использование в повседневной жизни солнцезащитных очков.
Литература
Центалович Ю. П., Снытникова О. А., Сагдеев Р. З. Фотохимические и термические реакции кинуренинов // Успехи химии. 2008. Т. 77. № 9. С. 844–853.
Bova L. M. Sweeney M. H., Jamie J. F. and Truscott R. J. Changes in Human Ocular UV Protection with Age // Invest. Ophthalmol. Vis. Sci. 2001. V. 42. N. 1. P. 200–205.
Korlimbinis A., Aquilina J. A., Truscott R. J. W. Protein-bound and free UV filters in cataract lenses. The concentration of UV filters is much lower than in normal lenses // Exp. Eye Res. 2007. V. 85. P. 219–225.
Savina E. D. Tsentalovich Yu. P., Sherin P. S. UV-A induced damage to lysozyme via Type I photochemical reactions sensitized by kynurenic acid // Free Rad. Biol. Med. 2020. V. 152. P. 482–493.
Sherin P. S., Grilj J., Tsentalovich Yu. P. and Vauthey E. Ultrafast excited-state dynamics of kynurenine – a UV filter of the human eye // J. Phys. Chem. B. 2009. V. 113. P. 4953–4962.
Sherin P. S., Grilj J., Kopylova L. V. et al. Photophysics and photochemistry of UV filter kynurenine covalently attached to amino acids and to a model protein // J. Phys. Chem. B. 2010. V. 114. P. 11909–11919.
Sherin P. S., Zelentsova E. A., Sormacheva E. D. et al. Aggregation of -crystallins in kynurenic acid-sensitized UVA photolysis under anaerobic conditions // Phys. Chem. Chem. Phys. 2016. V. 18. P. 8827–8839.
R. van Heyningen. Fluorescent Glucoside in the Human Lens // Nature. 1971. N. 230. P. 393–394.
Работа выполнена при поддержке РНФ (проект № 18-73-10014)