Метаболом – молекулярное «зеркало» жизни
В нашем организме постоянно меняется количество и состав не только белков – продуктов активации тех или иных генов, но и более простых органических молекул, образующихся в результате различных метаболических процессов или попадающих в него из внешней среды. Такие молекулярные «профили» несут в себе уникальную информацию, которую можно использовать для самых разных практических целей. С помощью этого подхода новосибирским исследователям уже удалось выяснить причины развития возрастной катаракты, найти потенциальные пребиотики и опухолевые биомаркеры, а также помочь криминалистам в решении задачи, важной для раскрытия преступлений
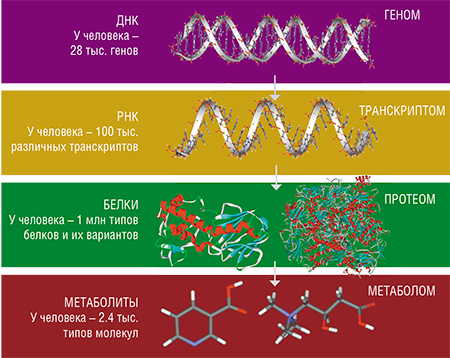 Вторая половина XX в. – это время бурного развития молекулярной биологии, в первую очередь генетики. Яркий пример – успешная реализация одного из наиболее амбициозных международных научных проектов, «Генома человека», получившего широкий резонанс, и не только в научных кругах. Все это привело к рождению целой группы далеко не таких известных среди широкой общественности «постгеномных» научных исследований, в которых изучаются молекулярные продукты реализации наследственной информации в организме.
Вторая половина XX в. – это время бурного развития молекулярной биологии, в первую очередь генетики. Яркий пример – успешная реализация одного из наиболее амбициозных международных научных проектов, «Генома человека», получившего широкий резонанс, и не только в научных кругах. Все это привело к рождению целой группы далеко не таких известных среди широкой общественности «постгеномных» научных исследований, в которых изучаются молекулярные продукты реализации наследственной информации в организме.
Предметом исследования метаболомики, самой молодой из постгеномных наук, является метаболом – совокупность малых (с молекулярной массой менее 1 кДа*) молекул в организме, органе, ткани или клетке. К метаболитам относятся аминокислоты, органические кислоты, сахара, нуклеотиды и многие другие классы органических соединений.
Анализ метаболома является ключевым моментом для понимания динамических процессов, происходящих в организме. При нормальных условиях концентрация тех или иных соединений в ткани или жидкости определяется их ролью в метаболических процессах и, как правило, меняется в небольших пределах. Однако при патологии метаболомный профиль пораженной ткани может резко измениться. Изучая динамику состава и концентрации метаболитов, можно понять молекулярные основы возникновения множества заболеваний или, по крайней мере, выявить их биомаркеры.
Сегодня в метаболомике выделяют три направления. Качественная метаболомика «опознает» метаболиты в ткани вне зависимости от их концентрации. Этот подход полезен на начальных этапах исследований, а также в ряде специфических приложений (например, в антидопинговых лабораториях). Самое большое число работ выполняется с применением полуколичественного подхода, при котором сравниваются исследуемый и контрольный образцы (например, патологической и здоровой тканей). Но наиболее информативный и вместе с тем трудоемкий подход – количественный, при котором измеряются абсолютные значения концентраций метаболитов в исследуемой ткани.

Разработкой и применением методов количественной метаболомики для решения конкретных задач в биологии и медицине занимаются исследователи из лаборатории протеомики и метаболомики новосибирского Института «Международный томографический центр» СО РАН. Так, с помощью этого подхода удалось выяснить причины возникновения катаракты, обнаружить потенциальные кишечные пребиотики, установить биомаркеры трудноизлечимых опухолей мозга, и добиться успеха в решении задачи, важной для криминологии, – установления точного времени наступления смерти.
Как уберечься от катаракты
Хрусталик глаза представляет собой биологическую линзу. Чтобы успешно выполнять свои оптические функции, он должен быть гибким, прозрачным и иметь высокий коэффициент преломления света. Однако сегодня более половины людей во всем мире старше 65 лет страдает возрастной ядерной катарактой, или помутнением центра хрусталика, что является основной причиной слепоты.
Большая часть хрусталика состоит из длинных шестигранных клеток-волокон, лишенных ядер и органелл и заполненных большим количеством специальных структурных белков – кристаллинов. Но у этой совершенной конструкции есть и недостаток: волокна хрусталика практически не имеют метаболической активности, в том числе в них не происходит обновления структурных белков. Да и сами такие клетки не обновляются: «настоящие» клетки, обеспечивающие рост хрусталика в течение жизни, имеются лишь в его эпителиальном слое, состоящем из одного слоя плоских неороговевающих клеток. Поэтому в центральной части хрусталика в любое мгновение нашей жизни находятся все те же волокна, с которыми мы родились, и с теми же белками.
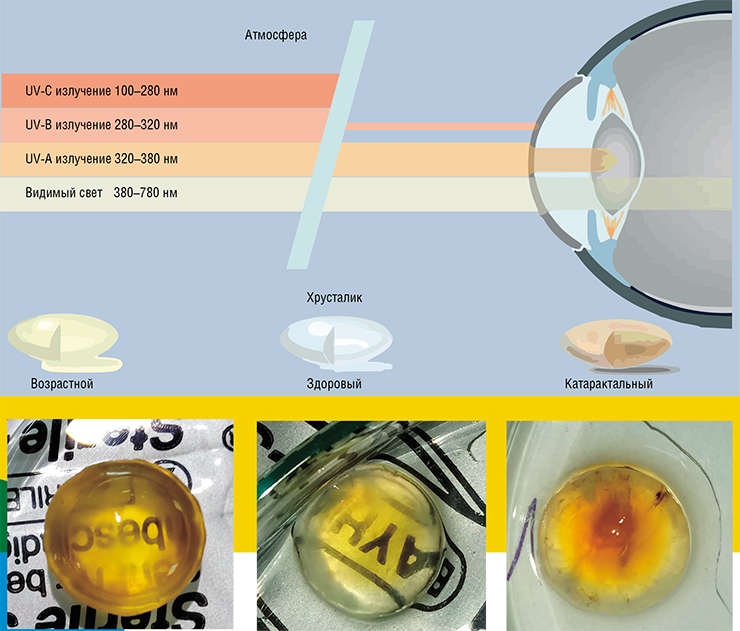
Со временем белки хрусталика «стареют», накапливая многочисленные модификации, в результате чего окрашиваются, теряют растворимость и слипаются. Выпадающие в осадок большие белковые агрегаты начинают рассеивать свет, что, как считается, и приводит к катаракте. Но хотя механизм этого заболевания понятен, первоначальные причины его возникновения до сих пор не ясны.
Одна из возможных причин – стресс. Известно, что любая биологическая ткань подвержена стрессам: окислительному, осмотическому, в результате действия солнечной радиации и т. д. Поскольку в клетках хрусталика не работает большинство обычных клеточных механизмов, то защищаться они могут только с помощью метаболитов (антиоксидантов, осмолитов, УФ-фильтров), которые должны где-то синтезироваться и медленно диффундировать к центру хрусталика. И чтобы понять механизмы развития катаракты, необходимо установить происхождение этих соединений.
Как известно, хрусталик со всех сторон омывается внутриглазной жидкостью, секретируемой цилиарным телом (частью средней, или сосудистой, оболочки глаза, на которой подвешен хрусталик). Именно эта жидкость в данном случае осуществляет функции крови – снабжает питательными веществами и выводит отходы. При сравнении метаболомного состава плазмы крови и внутриглазной жидкости выяснилось, что они очень близки за одним важным исключением: концентрация аскорбиновой кислоты, важнейшего антиоксиданта, в крови в сотни раз меньше.
 Дело в том, что в процессе эволюции предки человека, как и другие высшие приматы, утратили ген одного из ферментов, ответственного за синтез аскорбиновой кислоты. Компенсировать этот дефект можно за счет аскорбата, поступающего с пищей, в первую очередь с фруктами и корнеплодами. Но хрусталик требует гораздо больше аскорбиновой кислоты, чем другие ткани, поэтому в глазу имеются специфические насосы, забирающие аскорбат из крови и накачивающие его во внутриглазную жидкость. Дальнейшее проникновение аскорбата в хрусталик происходит за счет обычной диффузии.
Дело в том, что в процессе эволюции предки человека, как и другие высшие приматы, утратили ген одного из ферментов, ответственного за синтез аскорбиновой кислоты. Компенсировать этот дефект можно за счет аскорбата, поступающего с пищей, в первую очередь с фруктами и корнеплодами. Но хрусталик требует гораздо больше аскорбиновой кислоты, чем другие ткани, поэтому в глазу имеются специфические насосы, забирающие аскорбат из крови и накачивающие его во внутриглазную жидкость. Дальнейшее проникновение аскорбата в хрусталик происходит за счет обычной диффузии.
При следующем шаге – сравнении метаболомного состава внутриглазной жидкости и хрусталика – выяснилось, что основными антиоксидантами в нем являются не только аскорбиновая кислота, но и пептид глутатион. Ответственным за поддержание внутриклеточного давления оказался шестиатомный спирт мио-инозитол. А роль УФ-фильтров играет набор производных кинуренина, продукта метаболизма аминокислоты триптофана. Концентрация всех этих соединений (за исключением аскорбата) в хрусталике оказалась во много раз выше. Из этого логично следует, что большинство «защитных» соединений хрусталика не приходит извне, а синтезируется в самом хрусталике, точнее, в его эпителиальных клетках.
Когда исследователи сравнили здоровые и катарактальные хрусталики людей одного возраста, то в последних было обнаружено гораздо меньше осмолитов, антиоксидантов и УФ-фильтров. Так появилась гипотеза, согласно которой причиной развития катаракты является снижение функции эпителиальных клеток. Это означает, что оптимальным подходом к терапевтическому лечению и профилактике катаракты может стать не «накачка» хрусталика антиоксидантами, а восстановление нормальной работы эпителиальных клеток. Это гораздо более сложная задача, решение которой, вероятно, лежит в области клеточных технологий. Например, существенно улучшить состояние стареющего хрусталика сможет подсадка в него здоровых эпителиальных клеток.
От микробиома до глиомы
В арсенале современной биомедицины важное место занимают подопытные животные, которые служат экспериментальными моделями заболеваний человека. Именно на таких объектах активно ведутся исследования по выяснению механизмов возникновения тех или иных патологий, а также отработка способов их профилактики и лечения.
Например, лабораторные мыши с врожденным колитом и с воспалением кишечника в активной фазе являются моделями пациентов с наследственной и с приобретенной формами заболевания, а также с колоректальным раком. Подобные модели сейчас используют для поиска эффективных про- и пребиотиков, а также для отработки методов лечения путем манипуляции с кишечной микрофлорой.
Одна из работ по метаболомному профилированию тканей и сыворотки крови модельных животных, которые ведутся совместно с новосибирскими Институтом цитологии и генетики СО РАН и Научно-исследовательским институтом физиологии и медицины, посвящена взаимодействию между организмом-хозяином и его кишечным микробиомом на примере модельных мышей с воспалением кишечника.
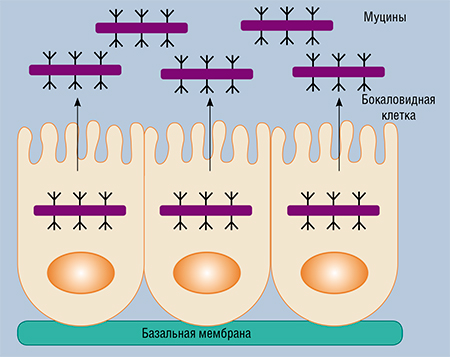 В основу этого исследования легла идея о том, что при врожденном колите и колоректальном раке во многих случаях уменьшается количество «желеобразной» выстилки кишки, состоящей преимущественно из муцина‑2, основного кишечного протеогликана – сложного высокомолекулярного соединения из белка и гетерополисахарида. А ведь этот мукозальный слой – наиболее благоприятное место обитания для симбиотических бактерий.
В основу этого исследования легла идея о том, что при врожденном колите и колоректальном раке во многих случаях уменьшается количество «желеобразной» выстилки кишки, состоящей преимущественно из муцина‑2, основного кишечного протеогликана – сложного высокомолекулярного соединения из белка и гетерополисахарида. А ведь этот мукозальный слой – наиболее благоприятное место обитания для симбиотических бактерий.
Основное взаимодействие кишечных бактерий и муцина‑2 происходит за счет гликозидных («сахарных») цепей, содержащих, наряду с другими компонентами, остатки моносахаров. Поэтому исследователи предположили, что именно эти компоненты могут во многом определять структуру микробиоты кишечника, в первую очередь толстой кишки, где муцина‑2 синтезируется особенно много.
Влияние на микрофлору ряда моносахаридов изучается на двух мышиных моделях рака кишки: на фоне врожденного колита и воспаления кишки в активной фазе, вызванного химическим агентом. Ученым уже удалось выявить положительный эффект применения одного из моносахаридов – фукозы, который приводит к нормализации в сыворотке крови уровня аминокислоты триптофана и изменению бактериального сообщества, в котором возрастает численность триптофан-продуцирующих бактерий, а также к исчезновению у подопытных животных поведенческих отклонений, возникших на фоне воспалительного процесса (Borisova et al., 2020).
Метаболомное профилирование тканей и сыворотки крови подопытных животных – экспериментальных моделей заболеваний человека – позволяет получить знания, необходимые для понимания механизмов биохимических процессов, протекающих в организме в норме и патологии, которые можно в дальнейшем использовать для диагностики, профилактики и терапии заболеванийЭто лишь первый шаг в изучении потенциальных защитных возможностей сахаров в отношении микрофлоры хозяина в норме и патологии. Однако в будущем подобные работы помогут создавать из отдельных компонентов пребиотики с заранее известным эффектом.
Метаболомный анализ тканей модельных животных может помочь и в создании диагностических средств в случае наиболее распространенного рака головного мозга у взрослых – глиомы. Эти высокоагрессивные опухоли на сегодня практически не поддаются терапевтическому лечению: клетки глиом способны быстро перестраивать метаболизм и меняться, адаптируясь к окружающей среде.
Сравнив метаболомный состав тканей здоровых животных и животных с привитой культурой опухолевых клеток линии глиобластомы человека, исследователи обнаружили, что метаболомные профили здоровых и патологических тканей значительно отличаются по концентрациям целого ряда метаболитов.

Результаты всех этих исследований также показывают, что динамика метаболических изменений в пораженных тканях отражается в метаболоме сыворотки крови. Таким образом, кровь можно использовать для метаболомного скрининга как воспалительных, так и онкологических заболеваний. Применяемый в настоящее время в медицинских лабораториях анализ крови, как правило, включает в себя определение концентраций всего лишь нескольких метаболитов (например, глюкозы, креатинина, мочевой кислоты). Если число этих соединений увеличить до нескольких десятков, то появится возможность ранней диагностики гораздо более широкого круга заболеваний, а главное, значительно повысится точность и достоверность диагноза.
Холмсу и не снилось
Уже сейчас в детективных сериалах и на страницах романов можно встретить описания того, как применяются в криминалистике методы метаболомики, в том числе для решения одной из главных задач криминалистики – установлении точного времени наступления смерти, что часто имеет решающее значение для раскрытия преступления.
Для этой цели криминалисты традиционно измеряют температуру тела, исследуют процесс трупного окоченения и образования трупных пятен, изучают реакции скелетных мышц на раздражители. «Маркерами» давности смерти может служить и степень разложения, а также присутствие в теле живых организмов, например, личинок насекомых. Сейчас активно используют и более «наукоемкие» инструменты, такие как исследования изотопов, степени деградации ДНК и других макромолекул. Однако все эти методы недостаточно точны и универсальны.
Криминалисту проще всего работать с различными биологическими жидкостями, что позволяет упростить процедуру работы с образцом и сэкономить время. Поэтому выбор стоит между кровью, мочой, суставной, спинномозговой и глазными жидкостями. При этом моча имеет очень изменчивый состав, во многом зависящий от внешних условий, а суставной и спинномозговой жидкостей мало, и их сложно извлечь. В этом смысле более перспективны сыворотка крови, стекловидное тело – желеобразное наполнение глазного яблока, и внутриглазная жидкость (ВГЖ), омывающая хрусталик глаза. Два последних образца достаточно просто получить в чистом виде.

Известно, что после смерти в биологических жидкостях происходят значительные изменения, которые определяются тремя основными факторами: запуском анаэробных (без доступа кислорода) процессов; разрушением клеток из-за прекращения работы натрий-калиевых насосов, регулирующих внутриклеточное давление; деятельностью бактерий. Эти изменения метаболомного состава биологических жидкостей открывают возможность для установления посмертного интервала. С точки зрения метаболомики оптимальными «биомаркерами» времени смерти были бы метаболиты, концентрации которых в жидкости организма изменялись бы монотонно (а лучше всего линейно) в течение относительно длительного периода после прекращения жизнедеятельности.
Новосибирские исследователи начали изучение посмертных изменений на модельных животных – кроликах (Zelentsova et al., 2016). У каждого животного забирались пробы трех биологических жидкостей с разными промежутками времени после смерти, в которых были измерены точные концентрации нескольких десятков метаболитов. На основе динамики изменений концентрации все эти соединения были разделены на несколько групп: «концентрация не меняется», «концентрация растет», «концентрация падает» и «изменения носят случайный характер».
В результате было выявлено несколько веществ (включая холин, гипоксантин и глицерин), которые показывали значительный (в десятки и сотни раз) и почти линейный рост концентрации со временем. При этом выяснилось, что состав сыворотки крови менялся гораздо более хаотично по сравнению со стекловидным телом и ВГЖ. Следовательно, именно глазные жидкости наиболее перспективны для дальнейших исследований.
Эти результаты были затем проверены на образцах сыворотки крови, внутриглазной жидкости и стекловидного тела людей с разным временем наступления смерти. Образцы были получены из банка, собранного совместно с Новосибирским областным клиническим бюро судебно-медицинской экспертизы. Количественный метаболомный анализ подтвердил, что наиболее подходящими жидкостями являются ВГЖ и стекловидное тело, а в число наиболее перспективных биомаркеров также входят гипоксантин и холин.
В конечном итоге на основе данных по изменению концентраций метаболитов была разработана математическая модель, учитывающая концентрации сразу нескольких биомаркеров, что позволяет увеличить точность определения давности наступления смерти.
Даже из немногих примеров, приведенных в этой статье, становится ясно, что количественная метаболомика может быть использована для исследования самого широкого круга биологических объектов – от клеточных культур до человеческих тканей, и успешно применена для решения разнообразных задач биологии и медицины.
В сущности, эта дисциплина делает пока самые первые шаги. Но есть все основания считать, что уже в недалеком будущем по метаболомному профилю тканей можно будет не только диагностировать заболевания человека, но и выбирать оптимальный путь их лечения.
* кДа =103 Да (дальтон – атомная единица массы, равная 1/12 массы свободного покоящегося атома углерода 12C, находящегося в основном состоянии)
Литература
Borisova M. A., Snytnikova O. A., Litvinova E. A., et al. Fucose ameliorates tryptophan metabolism and behavioral abnormalities in a mouse model of chronic colitis // Nutrients. 2020. V. 12. P. 445.
Snytnikova O. A., Khlichkina A. A., Yanshole L. V., et al. Metabolomics of the human aqueous humor // Metabolomics. 2017. V. 13(1). P. 5.
Tamara S. O., Yanshole L. V., Yanshole V. V., et al. Spatial distribution of metabolites in the human lens // Exp. Eye Res. 2016. V. 143. P. 68–74.
Tsentalovich Yu. P., Verkhovod T. D., Yanshole V. V., et al. Metabolomic composition of normal aged and cataractous human lenses // Exp. Eye Res. 2015. V. 134. P. 15–23.
Yanshole V. V., Yanshole L. V., Snytnikova O. A., and Tsentalovich Yu. P. Quantitative metabolomic analysis of changes in the lens and aqueous humor under development of age-related nuclear cataract // Metabolomics. 2019. V. 15(3). P. 29.
Zelentsova E. A., Yanshole L. V., Snytnikova O. A., et al. Post-mortem changes in the metabolomic compositions of rabbit blood, aqueous and vitreous humors // Metabolomics. 2016. V. 12. N. 11. P. 172.
Работа выполнена при поддержке РФФИ (гранты № 18-29-13023,18-33-20097 и 18-34-00137)