Мишень-РНК
Вся необходимая информация для развития и жизнедеятельности организма закодирована в его геноме. Носитель генетической информации ДНК содержит сведения не только обо всех белках, необходимых организму, но и о том, где, когда и в каком количестве должен быть синтезирован каждый белок. Биологи называют сложные механизмы регуляции работы генов системой генной экспрессии...
Несмотря на наличие в клетке саморегулирующихся и часто дублирующих друг друга сигнальных систем и механизмов исправления повреждений, в ней нередко происходят патологические изменения, ведущие к нарушению синтеза нужных белков. В итоге такие клеточные патологии приводят к болезни всего организма.
Кроме того, чужеродные белки могут появляться в организме в результате вторжения инфекционных агентов, вирусов и бактерий. В такой ситуации подавить экспрессию чужих генов означает остановить размножение патогенных микроорганизмов и уменьшить вред, наносимый ими организму.
Терапию клеточных патологий нередко можно провести разными способами – сама природа заболевания определяет оптимальный подход. Крупным технологическим прорывом 1970—1980-х гг. стала терапия моноклональными антителами, способными связываться с белками-антигенами на поверхности клеток. С их помощью стало возможным указать цель (например, раковую клетку) иммунной системе больного или доставить к этой клетке гибельный для нее химио- или радиотерапевтический агент; облегчить течение ряда аутоиммунных заболеваний. В 1986 г. был разрешен к применению первый препарат моноклональных антител, борющийся против отторжения трансплантированных органов, а сегодня в клинике применяется уже два десятка лекарств, основанных на этой технологии.
В случае наследственных заболеваний, вызываемых генными мутациями на уровне ДНК, кардинальным решением проблемы будет замена «поврежденных» участков геномной двуцепочной ДНК «исправными». Это подход генной терапии sensu stricto: «здоровый» человеческий ген вводится в клетки взамен поврежденного гена в составе специального молекулярного носителя (вектора).
Генная терапия пережила настоящий всплеск в 1990-е гг. и находилась практически почти «у постели больного»: ограниченные испытания генотерапии шли уже в нескольких госпиталях. Однако последовавшая в 1999 г. неожиданная смерть пациента в результате генотерапии и случаи постгенотерапевтических осложнений, наблюдавшиеся в 2003 г., остановили испытания.
Осложнения были связаны с недостаточной биологической безопасностью использованных в терапии вирусных векторов. Это оказалось серьезным ударом не только для «чистой» генотерапии, но и для всех вариантов клеточной терапии, в которых модифицированные вирусы служат весьма совершенными средствами адресной доставки терапевтических молекул.
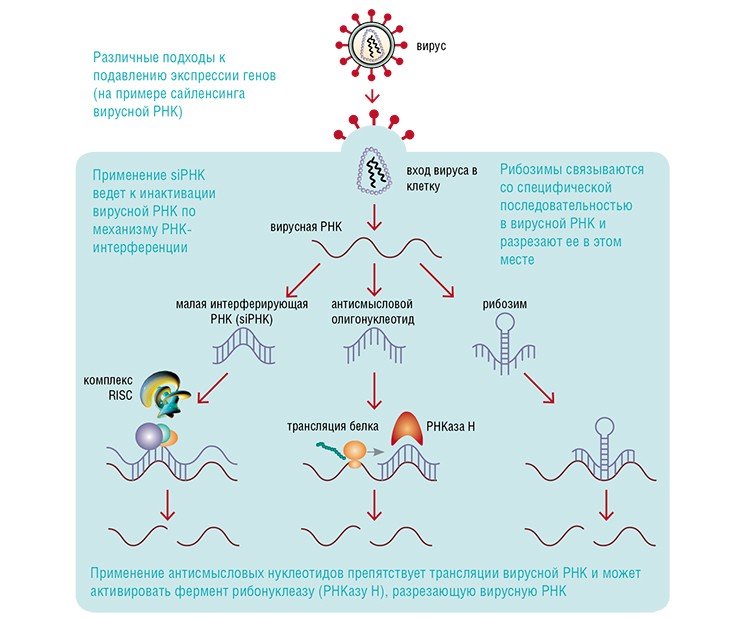
Проблема доставки является центральной в том числе и для возможной терапии антисмысловой РНК, искусственными рибозимами или малыми интерферирующими РНК, о которых идет речь в статьях этого номера (см. статьи Е. Л. Черноловской и В. Н. Сильникова).
Для огромного числа болезней – от сердечно-сосудистых и неврологических до онкологических – в корне заболевания лежит изменение экспрессии генов. Матричная РНК служит переносчиком информации из ее центрального хранилища, генома, на многочисленные рибосомы («фабрики белка»), где и происходит синтез белковых молекул. Ее центральная роль в регуляции экспрессии делает мРНК первоочередной мишенью для экспериментальных или терапевтических воздействий исследователей и врачей.
Например, «выследить» конкретную мРНК среди общей массы клеточных информационных РНК и связать ее с помощью комплементарной ей молекулы нуклеиновой кислоты – задача технологически куда более простая, чем инактивировать все молекулы синтезированного по этой матрице белка с помощью специфических антител. Да и с экономической точки зрения производство антисмысловых олигонуклеотидов тоже обходится существенно дешевле, чем производство и применение антител. Использование принципа комплементарности для регуляции генной экспрессии лежит в основе всех направлений antisense-технологии – от ее оригинального варианта, собственно антисмысловых олигонуклеотидов, до наиболее современных РНК-интерференции и триплексной технологии.
Кстати, эффективность и «точность» (или, как говорят биологи, специфичность) подавления экспрессии генов с помощью РНК-интерференции (см. статью Е. Л. Черноловской) не без оснований заставляют многих исследователей и врачей считать ее возможное применение в медицине крупнейшей революцией после применения специфических антител в терапии.
В этом выпуске мы рассказываем о разных научных и технологических подходах к контролю экспрессии генов на уровне РНК, об истории научных школ и передовых достижениях, о возможностях применения новых методов в терапии и о преградах и проблемах, которые могут встать на их пути в клиническую практику.
















