РНК-интерференция. Клин клином...
«Много» – это не всегда «хорошо». Например, когда речь идет о вирусных белках. В этом случае остановить процесс белкового синтеза – жизненная необходимость для зараженной клетки. И она как опытный гомеопат начинает излечивать «подобное подобным»...
В 2006 г. Нобелевской премии по физиологии и медицине были удостоены американские исследователи Эндрю Файр и Крэйг Мэллоу за открытие явления РНК-интерференции. Признание пришло к ним необычайно быстро – всего через восемь лет после опубликования в журнале Nature результатов их исследований, показывающих, что матричную РНК можно разрушить с помощью другой молекулы РНК, двуцепочечной. Инъекция такой дцРНК, комплементарной мРНК мышечного белка unc-22, блокировала синтез этого белка посредством разрушения самой матричной РНК.
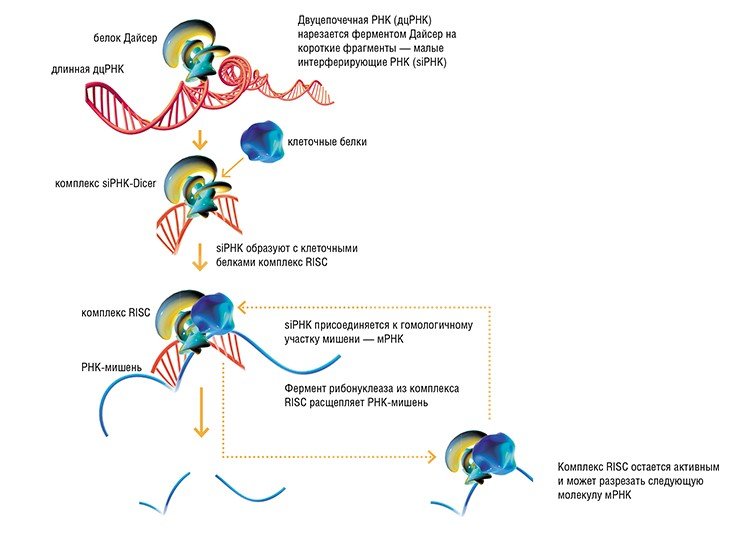
С явлением интерференции (от лат. inter – между и ferens (ferentis) – несущий) большинство из нас знакомо из курса физики: вспомним яркие пятна нефтяных разводов, причудливо расходящиеся по воде круги от брошенного камня... Однако этот термин, обозначающий взаимодействие, «наложение» по определенным законам одинаковых по своей природе объектов, встречается и в психологии, и в фонетике, и в биологииМеханизм разрушения мРНК при помощи дцРНК строго избирателен. Попадая в клетку, длинные дцРНК связываются с клеточным ферментом Дайсер (Dicer – от англий-ского dice – нарезать) – ключевым белком в механизме РНК-интерференции – и разрезаются на короткие фрагменты, так называемые короткие интерферирующие РНК (siRNAs). Последние связываются с клеточным комплексом RISC, способным разрушать молекулы РНК, и направляют его только к тем мРНК, которые «узнают» по принципу гомологии нуклеотидных последовательностей. Таким образом обеспечивается специфичность РНК-интерференции.
Возникает вопрос, откуда же берутся длинные двуцепочечные РНК, запускающие механизм РНК-интерференции – ведь в норме в клетках млекопитающих они не синтезируются. Одним из путей попадания таких РНК в клетку может быть вирусная инфекция. Геном многих известных вирусов состоит именно из такой двуцепочечной РНК (а не ДНК, как у большинства живых организмов). Кроме того, подобные молекулы могут синтезироваться в клетке в качестве промежуточного продукта в процессе размножения некоторых вирусов. Поэтому появление двуцепочечной РНК является для клетки сигналом: «Опасность!» В ответ на него защитные системы клетки включают механизм уничтожения чужеродной генетической информации. Вирусная РНК разрушается, и процесс синтеза вирусных белков в клетке блокируется.
Двуцепочечные РНК участвуют в функционировании двух важнейших клеточных систем – противовирусной защиты и регуляции экспрессии геновСледует отметить, что разрушением вирусной РНК защитные действия клетки не ограничиваются. Двуцепочечные РНК способны также стимулировать синтез интерферонов и цитокинов, оказывающих противовирусный эффект как на инфицированную, так и на соседние с ней клетки, подготавливая их к встрече с вирусом и активируя механизмы их клеточного иммунитета.
В последние годы было показано, что в клетке могут синтезироваться и свои собственные дцРНК, отличные по структуре от вирусных. Действуя по механизму РНК-интерференции, эти так называемые микроРНК могут вызывать остановку трансляции клеточных мРНК, блокируя синтез кодируемых ими белков. Таким образом, клетка может «выключать» гены, работа которых не нужна в данный момент. Следовательно, клетка, используя микроРНК, закодированные в ее собственном геноме, может регулировать экспрессию генов, реализуя свою генетическую программу развития.
Осознав, что с помощью малых интерферирующих РНК клетка справляется с целым рядом встающих перед ней проблем – от защиты от чужеродной генетической информации до регулировки программы развития клетки – исследователи поставили перед собой вопрос: нельзя ли использовать короткие синтетические молекулы РНК, гомологичные матричным РНК клетки, для разрушения последних. Такая возможность давала бы в руки ученым бесценный инструмент, способный регулировать экспрессию любого интересующего их гена. Кроме того, эти короткие олигорибонуклеотиды уже не распознаются клеткой как инфекционно опасные компоненты вирусного генома. Они не активируют клеточные механизмы противовирусной защиты и направлены исключительно на разрушение мРНК, гомологичной последовательности интерферирующей РНК.
Эксперименты показали, что это возможно, и сегодня такие синтетические молекулы, действующие по принципу РНК-интерференции, уже используются для регуляции экспрессии многих генов. Они действуют очень избирательно, разрушая только «нужные» молекулы мРНК, и проявляют активность в чрезвычайно низких концентрациях. Появление такого мощнейшего инструмента открыло для исследователей новые горизонты в области разработки целого спектра препаратов, подавляющих активность практически любых генов, в том числе вирусных и «опухолевых».
В одной лишь онкологии потенциальными мишенями для интерферирующих РНК могут являться мРНК, кодирующие различные классы белковых молекул, участвующих в процессе злокачественной трансформации. Вот только перечень классов подобных мишеней для терапевтического применения микроРНК: регуляторы клеточного цикла, ангиогенеза (роста сосудов, необходимых для питания опухоли), метастазирования и старения, белки, участвующие в блокировании апоптоза (программируемой гибели клеток), белки-иммуносупрессоры, мешающие организму самому бороться с раковыми клетками, а также белки, ответственные за устойчивость раковых клеток к химио- и радиотерапии.
Универсальная технология
При лечении ряда раковых заболеваний серьезной проблемой является устойчивость клеток опухоли к лекарственным препаратам. Такие раковые клетки способны выживать и размножаться в присутствии высоких концентраций цитостатических препаратов, когда обыкновенные, чувствительные к лекарствам опухолевые клетки неизбежно погибают.
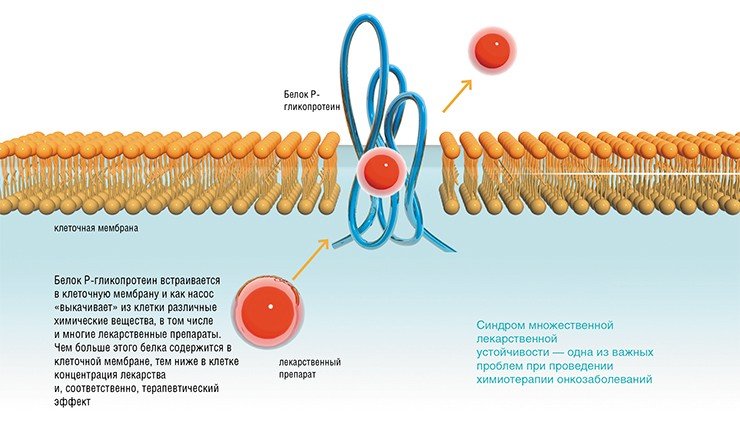
Такой синдром множественной лекарственной устойчивости связан с гиперэкспрессией клеточного гена MDR1, кодирующего P-гликопротеин. Этот транспортный белок работает как мембранный насос, «откачивающий» лекарственные препараты из цитоплазмы и таким образом снижающий их концентрацию в клетке.
Действие этого молекулярного насоса можно блокировать с помощью специальных химических веществ-ингибиторов. Но вряд ли это можно считать оптимальным решением проблемы: такие вещества сами по себе довольно токсичны и усугубляют тяжесть побочных эффектов химиотерапии. Выход из ситуации — создание таких лекарственных средств, которые устраняли бы первопричину синдрома устойчивости, то есть подавляли бы экспрессию гена MDR1.
Такие препараты на основе малых интерферирующих РНК были разработаны в новосибирском Институте химической биологии и фундаментальной медицины СО РАН. Они представляют собой комплексы синтетических олигорибонуклеотидов, гомологичных различным участкам матричной РНК гена MDR1.
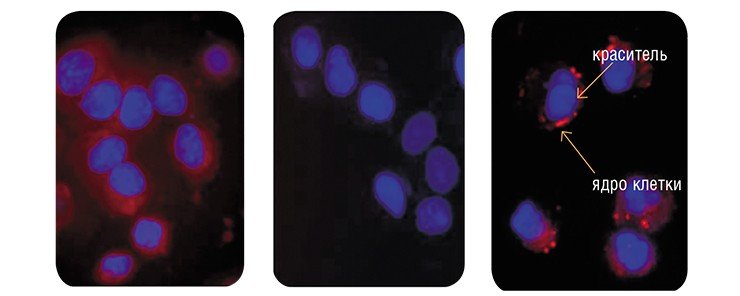
Для получения наиболее действенных малых интерферирующих РНК ими обрабатывали раковые клетки, обладающие устойчивостью к цитостатику винбластину, и отбирали те молекулы, низкие концентрации которых восстанавливали чувствительность опухолевых клеток к препарату, что приводило к гибели последних. Обработка самой эффективной из полученных siРНК снижала количество P-гликопротеина в раковых клетках в 20 раз уже через трое суток!
С использованием этого же подхода в ИХБФМ были получены ингибиторы и других «опухолевых» генов – протоонкогенов семейства MYC, играющих важную роль в регуляции клеточного цикла. Известно, что гиперэкспрессия генов c- и N-myc является одной из причин возникновения таких злокачественных опухолей, как нейробластомы. Клетки последних представляют собой не полностью дифференцированные нейральные клетки, продолжающие неконтролируемо делиться из-за нарушения генной экспрессии. Эти опухоли, нередко обнаруживающиеся у детей, далеко не всегда поддаются лечению.
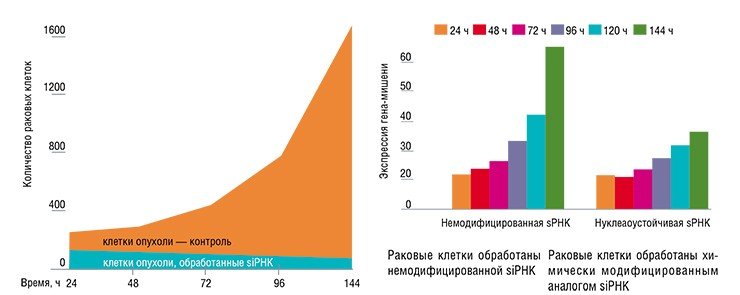
 В ходе экспериментов с серией 21-звенных интерферирующих РНК, направленных на подавление экспрессии протоонкогена c-myc, была получена высокоэффективная молекула, введение которой в клетки вызывает двадцатикратное снижение количества мРНК опухолевого гена по сравнению с контролем. В результате уже через двое суток число раковых клеток относительно уменьшилось в четыре раза.
В ходе экспериментов с серией 21-звенных интерферирующих РНК, направленных на подавление экспрессии протоонкогена c-myc, была получена высокоэффективная молекула, введение которой в клетки вызывает двадцатикратное снижение количества мРНК опухолевого гена по сравнению с контролем. В результате уже через двое суток число раковых клеток относительно уменьшилось в четыре раза.
Более того, в институте была получена siРНК, способная подавлять экспрессию сразу двух онкогенов, c-myc и N-myc. Этот препарат оказался эффективен против разных типов нейробластом, в том числе и устойчивых к лечению обычными противоопухолевыми средствами.
Полученные интерферирующие РНК могут рассматриваться как прототипы лекарственных препаратов, способных многократно повышать эффективность химиотерапии раковых заболеваний. Впрочем, до использования в медицинской практике этим препаратам еще предстоят долгий путь испытаний на лабораторных животных, а затем доклиническая и клиническая апробация.
«Химия» во благо
Для того чтобы интерферирующие РНК стали настоящими лекарствами, необходимо решить две проблемы: «защиты» и доставки РНК.
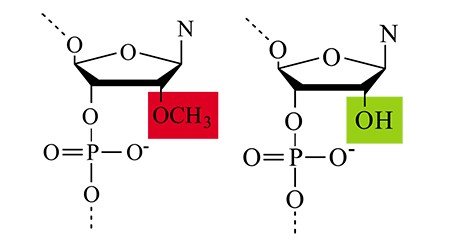
Первая связана с нестабильностью молекул РНК в крови и других биологических жидкостях. Это свойство обусловлено самой ролью РНК как переносчика генетической информации, количество которого должно подлежать быстрой регуляции. Ферменты РНКазы, содержащиеся как внутри клеток, так и во внеклеточной среде, эффективно расщепляют молекулы РНК, выполняя роль такого регулятора. Для защиты РНК от их действия природные нуклеотиды в ее составе заменяют на их химически модифицированные аналоги, придающие РНК устойчивость к действию ферментов. Однако такая замена может стать палкой о двух концах: сама биологическая активность интерферирующей РНК может снизиться либо быть полностью потеряна.
Поиски новых аналогов нуклеотидов, лишенных этих недостатков, ведутся во всем мире. Алгоритм получения нуклеазоустойчивых интерферирующих РНК, разработанный в ИХБФМ, основан на картировании чувствительных к рибонуклеазам участков молекулы siРНК и их направленной защите с помощью химически модифицированных аналогов нуклеотидов. В результате «адресно-защищенная» РНК сохраняет свою активность в присутствии 5 % сыворотки в течение восьми часов, в то время как немодифицированная siРНК полностью деградирует менее, чем за 5 минут. Благодаря приобретенной устойчивости значительно сокращается кратность введения новой дозы, необходимой для поддержания биологического эффекта.
Поиск новых «молекул-транспортеров» и «молекул-упаковщиков» для доставки интерферирующих РНК сейчас активно ведется в лабораториях всего мира, включая Россию. Уже в ближайшее время можно ожидать результатов, ознаменующих «прорыв» в эру новых технологий создания лекарствВторая проблема – создание средств доставки препарата в клетки и ткани. Для того чтобы комплексы, содержащие siРНК, попадали точно «по адресу», в их состав вводят специальные молекулы, которые и «узнают» клетки определенного типа. В качестве таких молекул могут выступать антитела, специфичность связывания которых чрезвычайно высока.
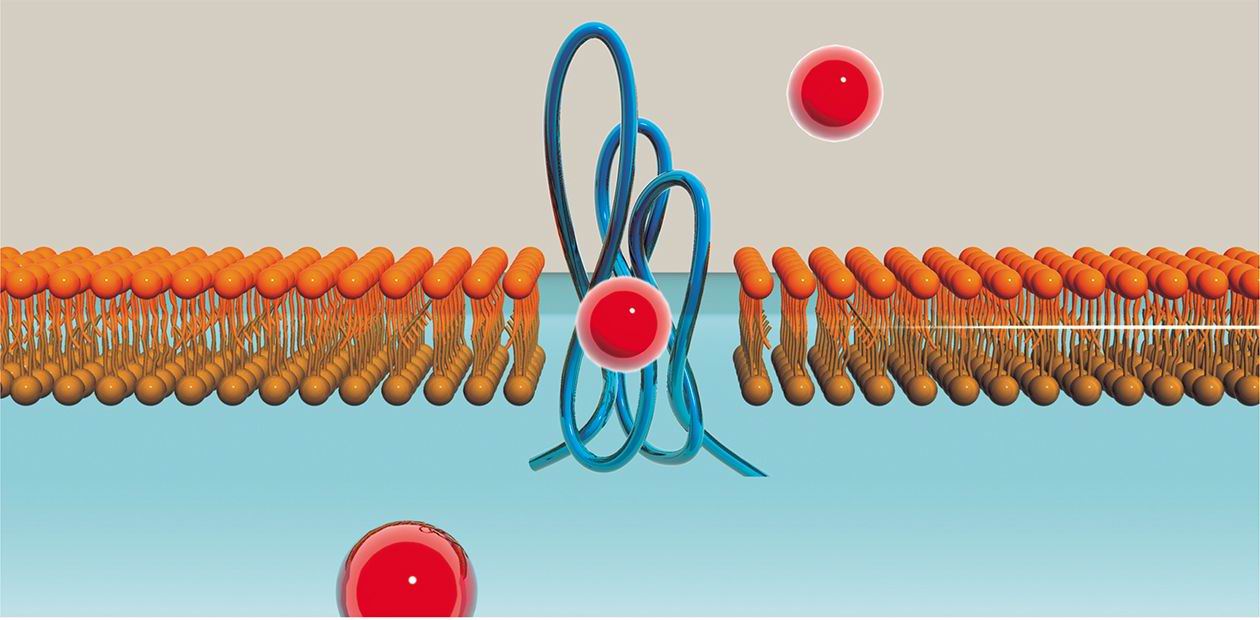
Преодоление клеточной мембраны также представляет проблему для любых заряженных молекул, в том числе и олигорибонуклеотидов. Здесь на помощь может прийти использование в качестве средств доставки препаратов катионных липидов и полимеров, которые образуют с интерферирующими РНК комплексы определенного размера. Такие комплексы способны проникать в клетки благодаря природным механизмам транспорта веществ. Другим перспективным подходом является присоединение к siРНК молекул, заведомо обладающих способностью проникать в клетки, таких как холестерин, фолат и других природных молекул, необходимых для функционирования клетки.
Проблема доставки интерферирующих РНК в некоторые типы клеток и тканей уже успешно решена, и эффективность подавления экспрессии генов-мишеней подтверждена на экспериментальных животных. Однако, как отмечают специалисты, текущее состояние дел в этой области следует считать обнадеживающим, но скромным результатом. Именно от разработки адекватных средств и схем доставки лекарственных молекул РНК в самые разные типы клеток при различных заболеваниях зависит то, как скоро всю мощь этого нового подхода в лечении удастся почувствовать на практике.
Литература
Логашенко Е. Б., Владимирова А. В., Зенков А. Н., Репкова М. Н., Веньяминова А. Г., Черноловская Е. Л., Власов В. В. (2005) Обращение фенотипа множественной лекарственной устойчивости с помощью малых интерферирующих РНК. // Известия АН, серия химическая, 2, 41—44.
Aronin N. (2006) Target selectivity in mRNA silencing. Gene Therapy, 13, 509—516.
Corey D. (2007) Chemical modification: the key to clinical application of RNA interference? // The Journal of Clinical Investigation, 117, 3615—3622.
Grimm D. and Kay M. (2007) Therapeutic application of RNAi: is mRNA targeting finally ready for prime time? The Journal of Clinical Investigation, 117, 3633—3641.
Fire A., Xu S., Montgomery M.K., Kostas S.A., Driver S. E., and Mello C.C. (1998). Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans // Nature, 391, 806—811.
Kabilova T. O., Chernolovskaya E. L., Vladimirova A. V., Vlassov V. V. (2006) Inhibition of Human Carcinoma and Neuroblastoma Cell Proliferation by anti c-Myc siRNA // Oligonucleotides, 16, 15—25.