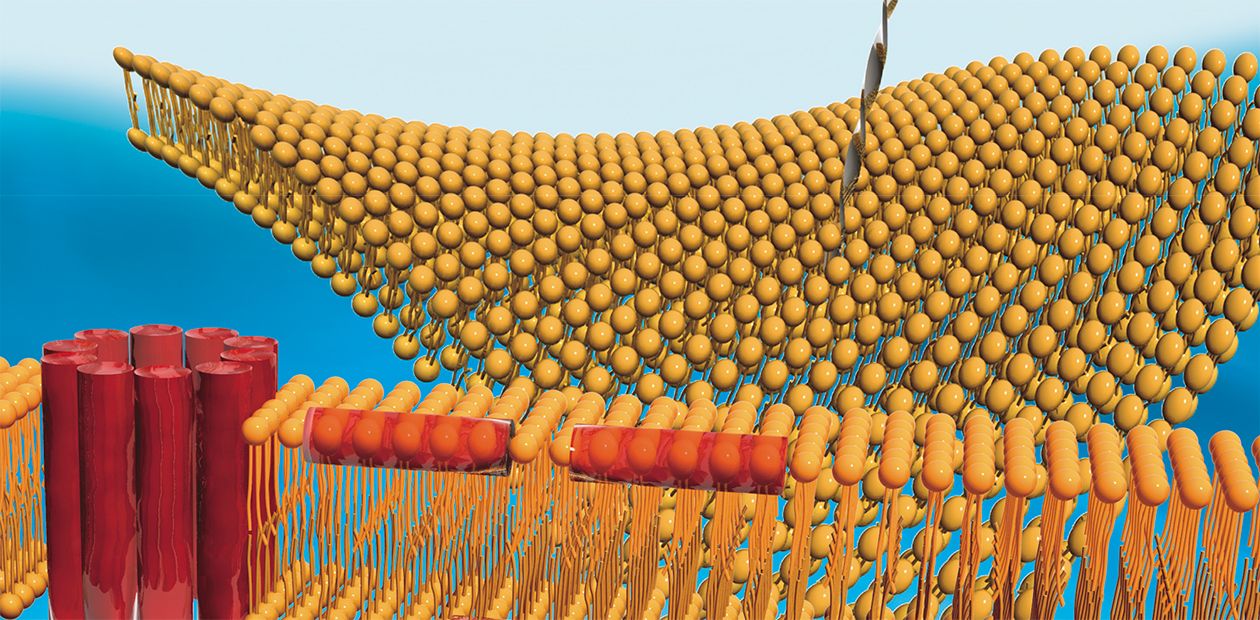
«Молекулярное сверло» антибиотика
Роль, которую антибиотики играют в нашей жизни, трудно переоценить – в свое время они стали в прямом смысле панацеей от тяжелых и трудноизлечимых болезней, вызываемых бактериями. Однако с течением времени медицина столкнулась с серьезной и неожиданной проблемой: оказалось, бактерии могут формировать устойчивость к определенному антибиотику, снижая тем самым эффективность его действия лекарства. На повестке дня стоит задача поиска таких антибиотиков, против которых бактерии были бы бессильны, для чего необходимо иметь четкое представление о механизмах антибактериальной активности этих препаратов на молекулярном уровне
Одними из наиболее перспективных антибиотиков, учитывая феномен бактериальной антибиотикорезистентности, являются препараты на основе пептидов.
Пептиды – это биологические макромолекулы, представляющие собой последовательности аминокислот, тех самых «кирпичиков», из которых состоят белки. От белков пептиды отличаются лишь размерами: число аминокислот в них невелико – от нескольких единиц до нескольких десятков.
В настоящее время известно несколько сотен пептидов-антибиотиков. И хотя их антибактериальная активность является давно установленным фактом, однако для многих антибиотиков-пептидов детальный механизм их взаимодействия с патогенами изучен недостаточно.
Ковер или бочонок?
Известно, что антибактериальная активность ряда пептидов-антибиотиков обусловлена их воздействием на оболочку бактериальной клетки – клеточную мембрану. Внедряясь в мембрану, антибиотики делают ее неизбирательно проницаемой как для молекул внешней среды, так и для собственного клеточного содержимого. В результате клетка не может поддерживать необходимый для жизнедеятельности состав внутриклеточного вещества, и бактерия погибает.
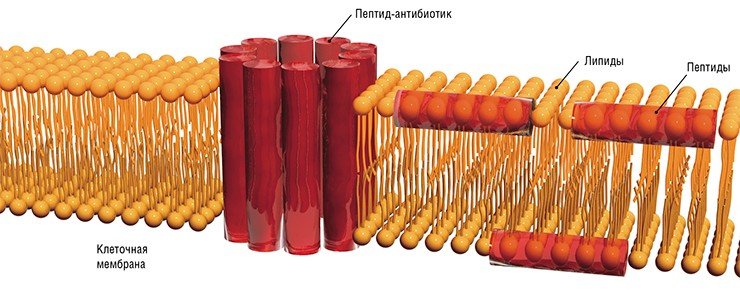
Согласно первой гипотезе о механизме взаимодействия пептида-антибиотика и бактериальной клетки, молекулы антибиотика располагаются параллельно поверхности клеточной мембраны, покрывая ее как ковер (ковровый механизм). Это приводит к нарушению самоорганизации липидного слоя и разрушению, «выкусыванию» участка мембраны.
Согласно второй гипотезе, молекулы антибиотика проникают в мембрану, располагаясь перпендикулярно поверхности. Несколько внедрившихся ассоциированных молекул формируют своеобразный, открытый с двух сторон «бочонок» (бочоночный механизм). Канал, формируемый «стенками» бочонка, приводит к нарушению целостности мембраны.
Чтобы понять, какой именно молекулярный механизм воздействия на клетку бактерии реализуется в случае конкретного антибиотика, в первую очередь нужно иметь точную информацию о пространственном расположении молекул пептидов относительно клеточной мембраны, т. е. о надмолекулярной (иначе – супрамолекулярной) структуре системы пептид–мембрана. Подобные исследования ведутся в Институте химической кинетики и горения СО РАН (Новосибирск), где для изучения супрамолекулярных структур широко привлекаются методы электронного парамагнитного резонанса (ЭПР).

Так, относительно недавно в Институте химической кинетики и горения СО РАН была разработана группа высокочувствительных методов импульсной спектроскопии ЭПР, основанных на исследовании сигнала электронного спинового эха (ЭСЭ). В этом случае на образец с меткой воздействуют специальной последовательностью импульсов переменного магнитного поля, меняющей направление магнитного момента электронов. После этого регистрируется эхо-сигнал ЭПР, обусловленный постепенной релаксацией системы в исходное положение. По изменению формы сигнала ЭСЭ со временем можно получить уникальную информацию о конфигурации отдельных биомолекул и их окружении, о супрамолекулярных структурах, организованных из нескольких макромолекул и о характере их молекулярных движений.
На сегодня имеется много различных вариантов импульсного ЭПР. Для изучения спин-меченых биологических систем широко используется так называемый импульсный двойной электрон-электронный резонанс (PELDOR). Применяя этот метод, можно с высокой точностью получить информацию о расстоянии между двумя спиновыми метками (для расстояний около 3 нм точность составляет примерно 0,1 нм). А зная расстояние между метками, можно делать выводы о взаимном расположении исследуемых молекул.
Еще один метод, основанный на изучении осцилляций огибающей спада сигнала ЭСЭ (ESEEM), дает возможность определить расстояние от спиновой метки до атомных ядер, обладающих магнитным моментом. В качестве последних могут выступать, например, ядра дейтерия, входящие в состав тяжелой воды.
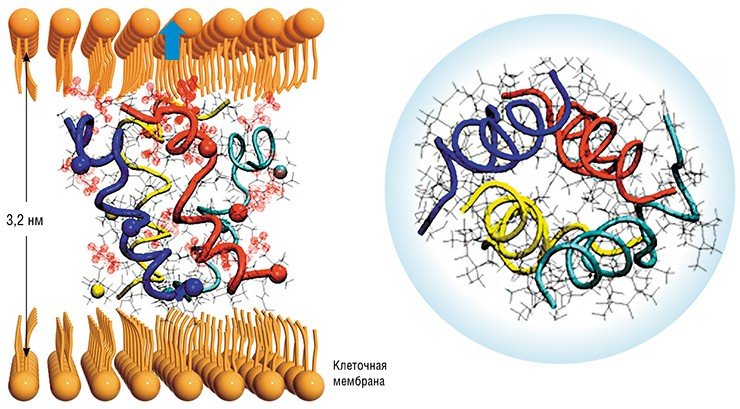
Из-за гидрофобных свойств фрагментов липидов, формирующих сердцевину клеточной мембраны, полярные гидрофильные молекулы, такие как вода, не могут проникнуть внутрь мембраны. И если последнюю поместить не в обычную воду, а в тяжелую, то по сигналу от ядер дейтерия можно судить о глубине погружения метки внутрь мембраны. В результате можно делать выводы о расположение спин-меченого пептида в мембране, т. е. о топологии системы мембрана–пептид.
Изучение общего времени затухания сигнала ЭСЭ дает информацию о движении спиновых меток. По времени затухания спинового эха можно определить скорость, а в ряде случаев и направление движения молекул
Дважды меченые
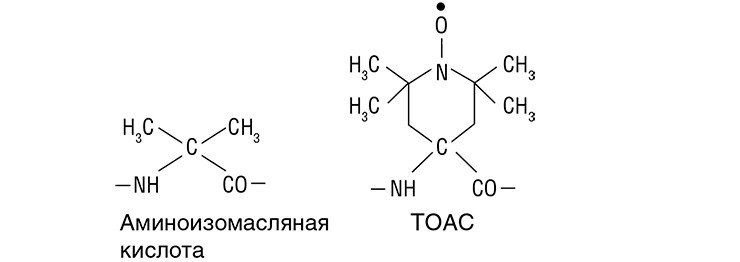
Новосибирским исследователям удалось достигнуть значительного прогресса при изучении пептидов двух типов, использующихся в качестве антибиотиков, – трихогина и аламетицина. Оба эти антибиотика, представляющие из себя достаточно длинные цепочки (трихогин состоит из десяти аминокислот, аламитицин – из двадцати), содержат в своем составе значительную долю аминоизомасляной кислоты. Чтобы пептиды можно было исследовать методами ЭПР, аминоизомасляная кислота в определенных участках их аминокислотной последовательности заменялась близкой по химическому строению спиновой меткой ТОАС:
Данные об изменениях пространственной организации дважды спин-меченых пептидов показали, что в биологических мембранах трихогин и аламетицин сворачиваются в спираль, приобретая так называемую конформацию спирали.
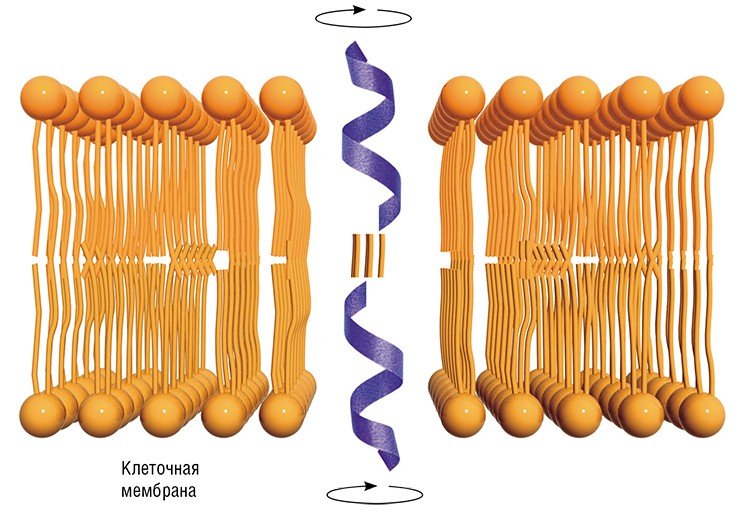
Выяснилось, что при низких концентрациях трихогин располагается параллельно поверхности мембраны. Если же его концентрацию повысить до терапевтически значимой, то антибиотик начинает проникать в мембрану, встраиваясь в нее перпендикулярно поверхности. Его молекулы, соединяясь попарно концевыми группами, образуют димеры, которые пронизывают мембрану практически насквозь.
Но поскольку внутри свернутых в спирали молекул трихогина недостаточно места для проникновения даже молекул воды, возникает вопрос: каким образом происходит нарушение избирательной проницаемости мембраны? Ответ пришел с неожиданной стороны: оказалось, что димеры трихогина могут довольно быстро вращаться вокруг своей оси. И такое вращение вполне может приводить к тому, что молекул воды будут проталкиваться вдоль спирали. Здесь можно провести достаточно близкую аналогию с работой дрели: известно, что под действием вращения сверла (а наш пептид очень на него похож) частицы материала выносятся наружу. Поэтому новый механизм взаимодействия антибиотика и мембраны с полным правом можно назвать механизмом молекулярного сверла.
Для аламетицина сделать выводы о положении его молекул в мембране оказалось намного сложнее. -Выяснилось, что его молекулы собираются в группы по четыре – образуют тетрамеры. При этом сигнал ЭПР, который складывается из сигналов большого числа расположенных рядом спиновых меток, трудно расшифровать. Определить структуру тетрамера и его положение в мембране удалось, сочетая результаты, полученные с помощью методов ЭПР, с данными рентгеновского рассеяния в кристаллах аламетицина. Так удалось установить, что расположение молекул аламетицина в мембране соответствует бочоночному типу.
Пока исследования молекулярных механизмов действия антибиотиков с помощью импульсного ЭПР спин-меченых молекул проведены только для двух представителей класса пептидов-антибиотиков – трихогина и аламетицина. Но и эти примеры убедительно показывают, что разнообразие механизмов действия этих антибактериальных средств может оказаться значительно больше, чем предполагалось ранее.
Дальнейшие исследования других пептидных антибиотиков – а их на сегодняшний день известно несколько сотен – наверняка принесут новые открытия, которые могут оказаться настолько же удивительными, как обнаруженный для трихогина механизм «молекулярного сверла».
Перед исследователями пептидных антибиотиков встает ряд и других важных вопросов: почему антибиотики уничтожают клетки бактерий и не трогают клетки самого организма, как может измениться механизм их действия при изменении липидного состава мембраны и т. д. В конечном итоге детальное знание молекулярных механизмов позволит создать новые эффективные лекарства для лечения бактериальных инфекций и выработать рекомендации по наиболее эффективному применению уже известных.
Литература
Цветков Ю. Д. , Милов А. Д., Марьясов А. Г. Импульсный двойной электрон-электронный резонанс (PELDOR) – спектроскопия ЭПР в нанометровом диапазоне расстояний // Успехи химии. № 6. С. 515—551 (2008)
Milov A. D., Samoilova R. I., Tsvetkov Yu. D., et al. Structure of self-aggregated alamethicin in ePC membranes detected by pulsed electron-electron double resonance and electron spin echo envelope modulation spectroscopies // Biophys. J. 2009. Vol. 96, P. 3197—3209.
Salnikov E. S., Erilov D. A., Milov A. D., et al. Location and aggregation of the spin-labeled peptide trichogin GA IV in a phospholipid membrane as revealed by pulsed EPR // Biophys. J. 2006. Vol. 91. P. 1532—1540.
Syryamina V. N. , Isaev N. P., Peggion C., et al. Small-amplitude backbone motions of the spin-labeled lipopeptide trichogin GA IV in a lipid membrane as revealed by electron spin echo // J. Phys. Chem. B. 2010. Vol. 114. P. 12277—12283.