В главной роли – фермент
Биохимию любого живого организма можно рассматривать в виде совокупности ферментативных реакций, и это не будет большим преувеличением. Являясь катализаторами белковой природы, ферменты, в отличие от обычных катализаторов, обладают чрезвычайно высокой эффективностью и специфичностью действия. При этом и сам фермент, и вещество, в химическом превращении которого он участвует, представляют собой большие и сложные макромолекулы с изменчивой пространственной структурой. Выявление детального механизма взаимодействия фермента и субстрата имеет большой теоретический и практический интерес, но является трудной и нетривиальной задачей, требующей привлечения широкого спектра самых современных методов исследования
Как происходит взаимодействие молекул фермента и субстрата при ферментативной реакции? Выяснить все детали этого жизненно важного процесса далеко не просто. Фактически исследователи могут иметь в своем распоряжении кристалл либо свободного фермента, либо его комплекса с конечным продуктом реакции. Получить подобный кристалл на каком-то промежуточном этапе ферментативного процесса (к примеру, непосредственно на стадии катализа) практически невозможно.
Конечно, с помощью современных молекулярно-биологических методов из этой ситуации можно найти выход. Например, внести модификацию в субстрат, которая остановит катализ, но не повлияет на его связывание с ферментом, и получить кристалл соответствующего промежуточного комплекса. Однако такими способами можно исследовать лишь ограниченное число состояний фермента и субстрата. Что же касается «бескристальных» методов определения структуры молекул, таких как ядерный магнитный резонанс (ЯМР), то их использование ограничено из-за трудности интерпретации данных.
Структурные данные, полученные вышеописанными способами, по сути, представляют собой «мгновенные» снимки конкретных структурных перестроек в молекулах фермента и субстрата. Но для современного уровня научного познания этого уже недостаточно – требуется детальный полнометражный «фильм».
На страже ДНК
Известно, что в живых клетках на постоянной страже находятся десятки ферментов, защищающих генетическую информацию от повреждения. Это связано с тем, что в процессе функционирования клеточная ДНК подвергается негативному воздействию различных физических и химических факторов внешней среды, таких как ультрафиолетовое и радиоактивное излучение, канцерогенные химические вещества и т. д. При этом одними из наиболее агрессивных факторов являются активные формы кислорода, вызывающие так называемые окислительные повреждения ДНК. Подобные повреждения генетического аппарата, обладающие цитотоксическим и мутагенным действиями, способны приводить к развитию сердечно-сосудистых, нейродегенеративных и онкологических заболеваний.
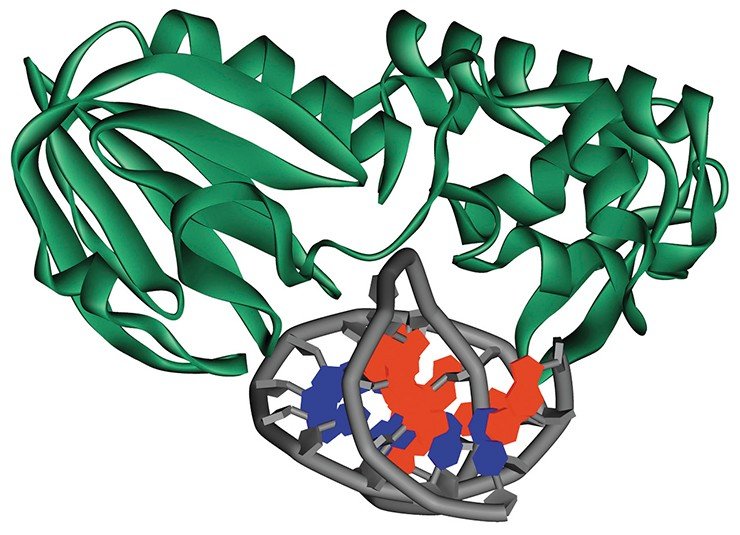
Клетка «ремонтирует» ДНК с помощью специальной системы репарации. Ферменты, входящие в эту систему, способны быстро и точно определить местоположение повреждения среди огромного количества нуклеотидных звеньев, составляющих цепочку ДНК, и инициировать процесс репарации. В поиске поврежденных нуклеотидов молекулы репарационных ферментов могут «перепрыгивать» между разными участками ДНК в составе клеточного ядра или же просто последовательно «утюжить» цепочку ДНК, причем каждый из этих ферментов способен специфически опознавать «свое» повреждение.
Изучение механизмов и особенностей действия ферментов репарации ДНК в последнее время вызывает особый интерес – подобные знания могут помочь человечеству в решении проблем раннего старения и лечении болезней, связанных с высоким уровнем образования генетических мутаций.
Флуоресцирующее видео
Регистрировать изменение структуры фермента и ДНК непосредственно в процессе их взаимодействия можно с помощью оптических методов.
Как известно, наиболее интенсивно флуоресцирующей аминокислотой является триптофан – именно он обеспечивает около 90 % всей флуоресценции белков. Поэтому триптофан используют как высокочувствительный флуоресцентный маркер при изучении конформационных изменений в молекулах белков, в том числе ферментов. Если же природных флуоресцентных свойств макромолекул оказывается недостаточно для получения нужной информации, то можно использовать специальные вещества-флуорофоры с хорошими фотофизическими свойствами.
В результате удается провести настоящую «съемку» ферментативного процесса, если в качестве «кинокамеры» использовать так называемые спектрометры остановленной струи, которые регистрируют быстрые изменения интенсивности флуоресценции в растворе.
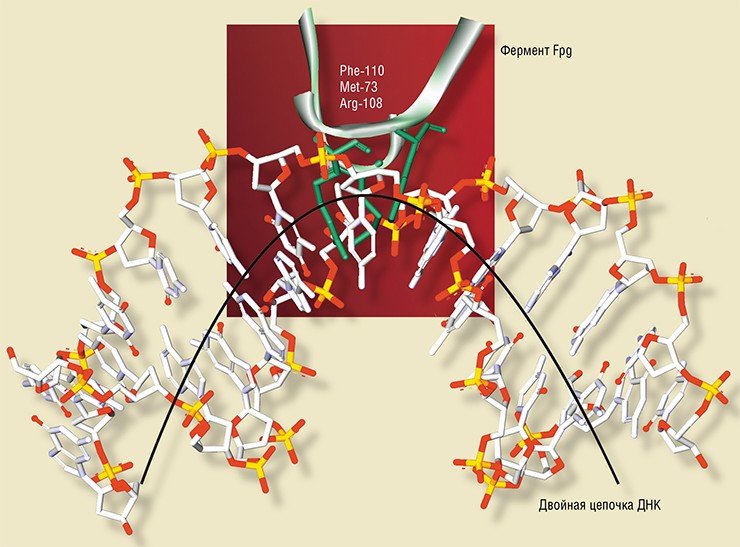
Этим способом в лаборатории исследования модификации биополимеров Института химической биологии и фундаментальной медицины СО РАН (Новосибирск) была изучена динамика изменений пространственной организации одного из ферментов репарации ДНК – формамидопиримидин-ДНК-гликозилазы (Fpg) из бактерии E. coli – при его взаимодействии с несколькими видами ДНК, содержащими различные поврежденные нуклеотиды (Koval et al., 2010).
В структуре фермента Fpg имеется пять остатков триптофана. Интерпретировать данные, полученные при регистрации динамики флуоресценции триптофана во время ферментативной реакции, помогли рентгено-структурные данные для этого фермента, находящегося в свободном состоянии и в комплексе с ДНК (Fromme, Verdine, 2002; Gilboa et al., 2002).
В результате новосибирские исследователи установили, что взаимодействие фермента с ДНК-субстратами приводит к конформационным изменениям как в молекуле самого фермента (например, встраивание некоторых его аминокислотных остатков в двойную спираль ДНК), так и в молекуле субстрата.
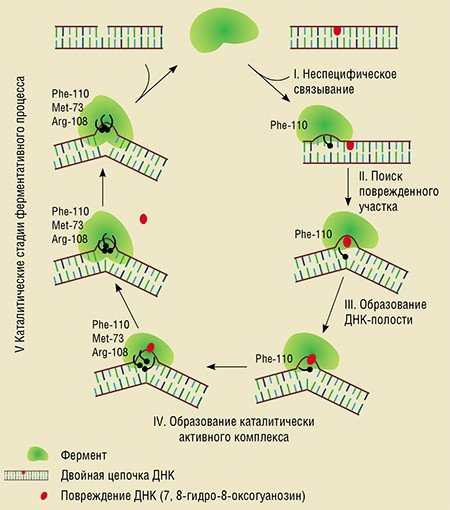
Тип изменения конформации (пространственной организации) фермента зависит от типа взаимодействия с субстратом: неспецифическое либо специфическое связывание и т.д. Было выявлено, как минимум, пять таких конформационных перестроек, каждой из которых удалось соотнести определенные «движения» молекулярной структуры фермента.
Таким способом фермент образует специфические контакты с субстратом, результатом которых является высокоэффективное узнавание и связывание поврежденных участков ДНК.
ОСТАНОВИТЬ МГНОВЕНИЕЕще в 1920-х гг. был разработан первый так называемый струевой метод, суть которого в том, что химическая реакция запускается быстрым смешиванием реагентов в проточных условиях (Hartridge, Roughton, 1923). В методе непрерывной струи растворы реагирующих веществ поступают под давлением в смесительную камеру, после чего смешанный раствор с высокой постоянной скоростью идет в трубку, вдоль которой и проводится измерение концентраций. «Возраст» смеси (т. е. время от начала ферментативной реакции) определяют по расстоянию от смесительной камеры до точки наблюдения. К сожалению, количество исходных веществ при этом измеряется литрами, а ферменты – продукт труднодоступный и дорогой.
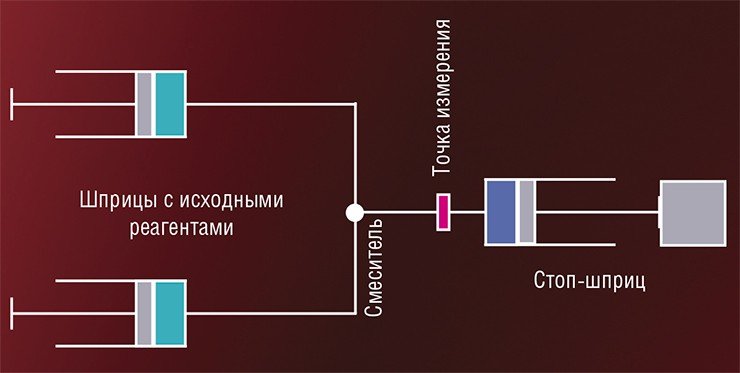
В 1930—50-х гг. были предложены две модификации этого метода (Roughton, Millikan, 1936; Chance, 1940; 1948). В методе «ускоренной струи» растворы реагирующих веществ помещают в шприцы, поршни которых приводят в движение резким толчком, а наблюдение осуществляется в фиксированной точке вблизи смесительной камеры. Скорость течения жидкости в данном случае меняется с ускорением, поэтому даже в одной точке удается исследовать растворы разного «возраста». Метод позволяет использовать весьма малые (до 0,1 л) объемы реагирующих веществ.
В методе остановленной струи раствор после смешивания поступает в трубку, заканчивающуюся поршнем. Раствор давит на поршень и перемещает его до того момента, пока поршень не упрется в ограничитель, в результате чего поток останавливается. Регистрация концентраций проводится в какой-либо фиксированной точке, при этом временная развертка регистрируемого параметра дает кинетическую кривую ферментативной реакции в интервале от миллисекунд до нескольких минут.
Этот метод, впервые предложенный в 1934 г. для реакций с временем около 10 с, был затем усовершенствован для измерения времени порядка нескольких миллисекунд, а затем и для существенно меньшего (Gibson, 1952).
Сейчас зарубежные компании производят ряд приборов для измерения быстроидущих химических процессов, в том числе основанных на методе остановленной струи, которые требуют использования небольших количеств тестируемых веществ. Поэтому этот метод нашел широкое распространение в биохимических исследованиях.
В Новосибирском научном центре установки для изучения струевыми методами химических радикальных реакций были созданы еще в 1960—70-е гг. в Институте химической кинетики и горения СО АН СССР. Однако они требовали больших расходов реагентов и не могли быть использованы для исследования таких молекул, как ферменты и нуклеиновые кислоты.
В наши дни в новосибирском Институте химической биологии и фундаментальной медицины СО РАН с помощью струевых методов проводится комплексное кинетическое исследование закономерностей функционирования защитно-репарационных систем живых организмов. Для этого используются спектрометры остановленной струи производства Applied Photophysics (Англия)
Взгляд с другой стороны
Все вышесказанное относилось к самому ферменту, а что же при этом происходит с субстратом?
Для регистрации конформационных изменений субстрата в его структуру была встроена флуоресцентная «метка» – 2-аминопурин. Фактически «снималась» та же сцена, что и в предыдущем случае, но уже с другим «главным героем».
 Для получения более полной картины в структуру ДНК-субстрата были также введены дополнительно две «метки» – флуорофор и так называемый тушитель (гаситель флуоресценции), позволяющие зарегистрировать изгибание молекулы субстрата методом резонансного переноса энергии флуоресценции (FRET).
Для получения более полной картины в структуру ДНК-субстрата были также введены дополнительно две «метки» – флуорофор и так называемый тушитель (гаситель флуоресценции), позволяющие зарегистрировать изгибание молекулы субстрата методом резонансного переноса энергии флуоресценции (FRET).
В итоге в распоряжении исследователей оказалось два «видео-ролика», описывающих поведение флуоресцирующих элементов фермента и ДНК-субстрата, что оказалось вполне достаточным для детального описания процесса взаимодействия фермента с ДНК. В результате удалось установить взаимные конформационные переходы в процессе ферментативного взаимодействия и выяснить, в какой последовательности и с какой скоростью протекают различные стадии процесса.
Эти заключения были подтверждены с помощью других аналитических методов, таких как метод быстрого прерывания реакции, позволяющий точно определить, в какой момент времени и с какой скоростью происходит образование продуктов реакции, а также метода масс-спектрометрии, с помощью которого удалось подтвердить образование ключевых промежуточных продуктов ферментативного процесса.
Таким образом, с помощью современных физико-химических методов удалось охарактеризовать природу конформационных переходов, происходящих на стадии образования фермент-субстратных комплексов, которые в конечном итоге приводят к формированию каталитически активного состояния одного из важнейших ферментов репарации ДНК.
Подобные сведения очень важны для понимания того, каким образом у живых организмов организован процесс сохранения наследственной информации и поддерживается стабильность генома. В целом же это исследование служит хорошим примером того, как использование методов быстрой кинетики позволяет глубже проникнуть в суть механизмов ферментативных реакций и понять, каким образом в природе происходит высокоспецифическое узнавание и селективное превращение одних молекул в другие.
Литература
Колдин Е. Быстрые реакции в растворе. М.: Мир, 1966.
Chance B. The enzyme-substrate compounds of catalase and peroxides// Nature. 1948. Vol. 161(4102). P. 914—917.
Работа поддержана Президентским грантом МК 1304.2010.4, грантом РФФИ № 10-04-00070, госконтрактом 02.740.11.0079, интеграционными проектами СО РАН № 28 и 48