Мы и наши микробы
Сама фраза «Мы и наши микробы» свидетельствует о сформировавшемся антропоцентрическом взгляде на микроскопических обитателей нашего тела – микробиоту. Однако микробиота представляет собой неотъемлемую часть нашего организма, развиваясь и функционируя как остальные органы и ткани. Недаром ученые говорят о «суперорганизме», или о том, что каждый из нас представляет собой сложную экосистему. Несмотря на годы изучения микробиоты, эта история далека от своего завершения. Количество непознанного и непонятного здесь существенно больше того, что удалось открыть, хотя уже полученные результаты потрясают
Американский профессор Джеффри Гордон, которого называют «отцом микробиома», в 2015 г. был номинирован на Нобелевскую премию за исследования взаимодействий бактерий кишечника с кишечной стенкой и организмом человека в целом, что говорит о серьезности научных результатов, получаемых в этой области. Так что же такое микробиом (микробиота), и почему так трудно определить, кто, как и с кем взаимодействует?
Поразительный факт: численность населяющих наше тело микроорганизмов (вирусов, бактерий, грибков), подавляющая часть которых обитает в желудочно-кишечном тракте, превышает общее число собственных клеток человека. Но самое удивительное – это разница в количестве генов, которые эти микроорганизмы несут: в среднем их в 500 раз больше, чем генов человека.
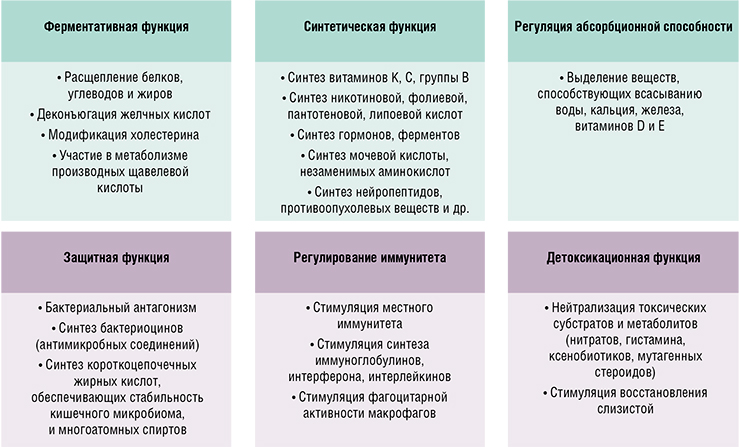
Микробиотой называют совокупность всех микроорганизмов (вирусов, бактерий, грибков), населяющих тело человека. Резидентная, или облигатная, микробиота – это микроорганизмы, постоянно присутствующие в определенном отделе организма. Это сообщество, образовавшееся в процессе совместной эволюции микробов и макроорганизма, симбиотически связано с последним и часто выполняет защитную и другие полезные для него функции. Сама же микробиота таким образом обеспечивает себе устойчивые условия для существования. Наряду с резидентной существует и транзиторная микробиота – это «посторонние» микроорганизмы, неспособные постоянно существовать в нашем теле.Считается, что общее число микробных клеток в организме человека достигает 1014, это на порядок превышает количество наших собственных клеток. Основная микробная популяция обитает в толстом кишечнике (более 500 видов), затем идет кожа (104–106 на см2), конъюнктива глаза, верхние дыхательные пути и влагалище
Микроорганизмы выполняют очень важные для нас функции, в том числе трофические и регуляторные. К примеру, кишечные бактерии разлагают непереваренные остатки пищи, выделяют в просвет кишечника различные соединения, включая витамины, ферменты и другие биологически активные вещества. Микроорганизмы активно участвуют в обменных процессах, в том числе в детоксикации, разлагая яды и токсины, поступающие с водой, пищей, воздухом и т. п.
Вся наша микробиота весит около 2 кг, что сопоставимо с такими крупными органами, как головной мозг или печень. Но в отличие от органов человека она очень плохо изучена, особенно с учетом того, как сильно микробиота варьирует от человека к человеку и у одного человека в зависимости от его состояния. И самое главное таинство – это то, как из нормального физиологического состояния она переходит в патологическое.
Как полнеть «из воздуха»
В современную индустриальную эпоху некогда существовавшие микробные балансы человеческого организма повсеместно нарушаются. Это приводит не просто к дискомфорту, но и к ускоренному старению, развитию множества патологических состояний, и не только желудочно-кишечного тракта. Что до кишечника, то за последние полвека частота его заболеваний, в том числе онкологических, взрывообразно возросла, причем в развитых странах начинает лидировать рак толстой кишки. Добавьте к этому воспалительные заболевания, такие как колиты и болезнь Крона.
Налицо факт микробного дисбаланса, который присущ не отдельным индивидам, а целым популяциям. Парадокс: питаться люди стали, на первый взгляд, лучше и разнообразнее, но практически у каждого человека наблюдаются те или иные признаки пищеварительной дисфункции.
Оказывается, дело не всегда в том, какое количество пищи и даже калорий человек потребляет. Потому что в зависимости от ферментативных свойств отдельных классов, родов и видов бактерий наша микробиота способна утилизировать даже те компоненты пищи, которые традиционно считались неперевариваемыми. Вспомним старую поговорку, что кто-то «полнеет прямо из воздуха». Это означает, что бактерии, извлекая такие дополнительные калории, делятся с организмом и запускают ряд процессов, приводящих к ожирению.
С точки зрения химика, ЖКТ – достаточно уникальная конструкция. Желудок и тонкий кишечник, запертые сфинктерами, представляют собой большие химические реакторы, где процесс пищеварения проходит с помощью ферментов, химических веществ и сильных детергентов, включая холевые кислоты, выделяемые с желчью. А благодаря кислотной среде желудка и отсутствию кислорода в тонком кишечнике там создаются относительно стерильные условия. На этой стадии из пищи извлекаются легкоусвояемые метаболиты: жиры, аминокислоты или короткие пептиды, а также «быстрые» углеводы.
Верхние отделы ЖКТ слабо обсеменены бактериями, и это неслучайно. Кислотность, антибактериальные ферменты ротовой полости и некоторые иммунные факторы контролируют процесс размножения микроорганизмов настолько, чтобы справляться и с возможными гнилостными процессами в пище. Но если в районе тонкого кишечника численность микробов возрастает, это сопровождается патологическими реакциями. Бактерии не только поедают легкоусвояемые метаболиты, но и выделяют токсины, которые тотчас всасываются в кровь.
В толстый кишечник попадает уже то, что не переварилось. В нижних отделах тонкой кишки, в месте перехода в толстый кишечник, почти полностью реабсорбируется желчь – очень токсичный продукт для микроорганизмов. Поэтому в толстом кишечнике, где среда практически нейтральна и концентрация кислорода выше, выживают разнообразные бактерии, которые очень тонко и «интимно» кооперируются.
Существует ли нормофлора?
В последние годы микробиота, обитающая на различных слизистых тканях человека, интенсивно исследуется как новая мишень для фармакологии. Поскольку медицина меняет свою философию, усиливая предсказательные и профилактические функции, кажется, что именно это новое биомедицинское направление позволит нам если не излечивать, то хотя бы предотвращать наступление тех или иных заболеваний.
Но чтобы направленно влиять на нашу микробиоту, мы должны сначала понять, что представляет собой «нормальная микрофлора». Понятие нормофлоры довольно иллюзорное. Можно считать, что у человека все в порядке, если он хорошо себя чувствует и его ничего не беспокоит с точки зрения пищеварения.
Если судить более глубоко, то нормофлора – это такое состояние триллионов клеток бактерий, при котором, во‑первых, в организме не возникает воспалительной реакции. Во-вторых, спектр метаболитов, который микробиота продуцирует, достаточен для ее автономного существования в течение длительного времени без дополнительных бактериальных интервенций.
До сих пор идут споры: можно ли это микробиотное царство разбить на энтеротипы либо это некие динамические состояния, которые переходят одно в другое, не поддаваясь четкой классификации.
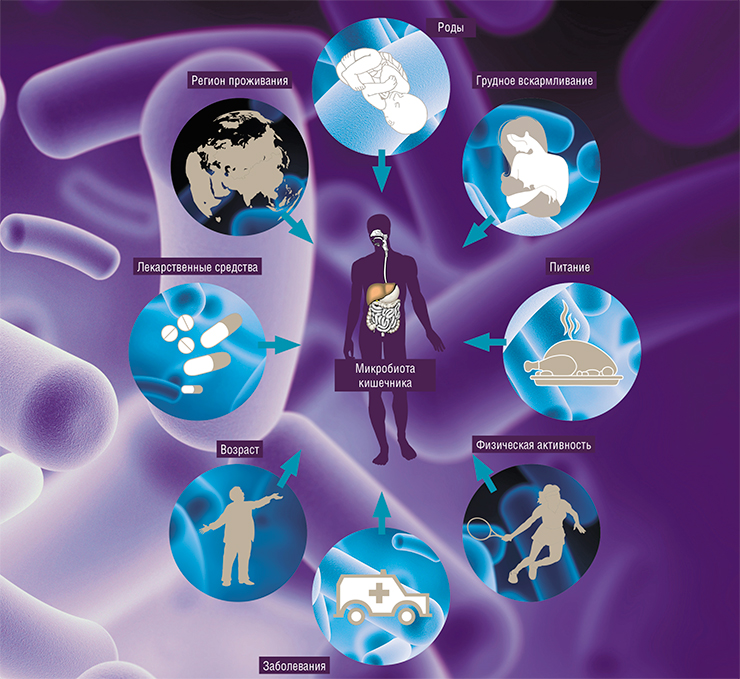
Вообще на микробное сообщество влияют многие факторы. В целом высокое разнообразие микробов и их генов в кишечнике – это хороший признак. С возрастом многообразие микробиоты падает. Подсчет генов в микробных сообществах показал, что их число у пожилых и больных людей падает примерно в два раза по сравнению со здоровыми и молодыми. И это приводит к развитию метаболического синдрома, диабета и других заболеваний.
В разных странах микробиота людей также имеет свои особенности. Но это вопрос контекста. Если, к примеру, взять города-миллионники в РФ и Европе, то никаких особенных отличий вы не обнаружите. А вот в глубинке, вдали от крупных городов, микробиота будет намного разнообразнее, напоминая микробные сообщества, характерные для людей, живших 100—150 лет назад. Это говорит о том, что, когда мы не потребляем много продуктов так называемого индустриального питания, наш микромир стремится к разнообразию.
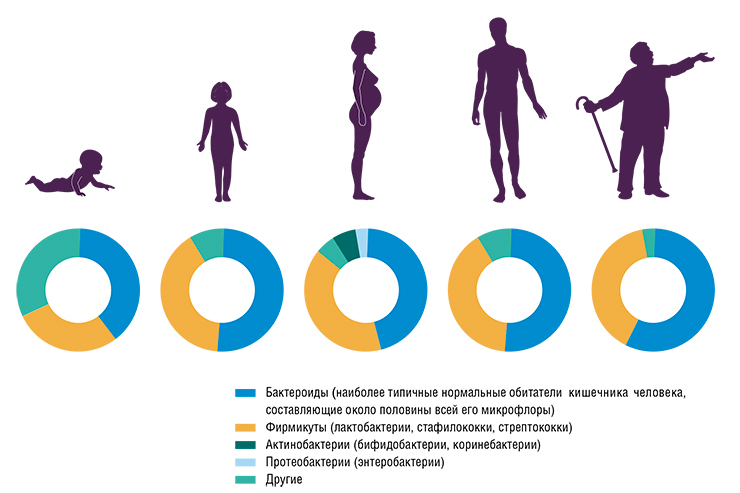
На сегодня важно, что мы научились изменять бактериальную динамику, так как интерес представляет не только и не столько состав микробиома, сколько его реакции на наши активные действия, например когда мы путешествуем, меняем характер питания, попадаем в больницу и т. п. Ведь микробиота, как и клетки нашего организма, накапливает мутации. У нас это нередко заканчивается онкологическими трансформациями клеток, но понять, что происходит с микробиотой, пока не удается. Так, известно, что уровень мутагенеза у бактерий коррелирует с частотой использования антибактериальных препаратов. И если посмотреть на антибактериальную политику в разных странах – Китае, США, Европе – и на число мутаций, которые накапливаются в микробах, то мы увидим прямую, очень четкую связь.
Сейчас ведутся метагеномные исследования по поиску закономерностей, связывающих присутствие в микробиоме тех или иных микроорганизмов с развитием заболеваний. К примеру, китайские исследователи показали связь между наличием определенных бактерий и формированием диабета 2-го типа. Но пока это лишь формальное описание феномена – сам механизм непонятен.
Нельзя забывать и об экологической составляющей микробиома. Ведь в природе синхронизируются потоки не только человеческих генов, передаваемых по наследству, но и бактериальных, которые передавались и передаются в популяциях людей как вертикально, так и горизонтально. К примеру, большинство млекопитающих являются копрофагами, это закрепленное поведение. Есть такой рефлекс и у приматов, и у людей, однако детей уже на ранних стадиях кормления от него отучают. С точки зрения санитарии это оправданно, с точки зрения бактериального переноса – не очень.
В «магазинных» продуктах содержится много генов антибиотикорезистентности, так как большинство сельскохозяйственных животных так или иначе контактирует с антибиотиками. Эти вещества используют для активации роста, снижения издержек от инфекционных заболеваний, что актуально, когда животных содержат скученно. И мы сами нередко применяем антибиотики при любых заболеваниях, а не только бактериальных.
В результате в среде происходит постепенное накопление генов устойчивости к антибиотикам. В одной из первых статей на эту тему было показано, что в почве содержится большинство современных, при этом не химически синтезированных антибактериальных соединений, которые являются природными средствами межбактериальной коммуникации.
Но самым гигантским резервуаром антибиотикоустойчивых генов сейчас является человечество. Многие инфекционные заболевания, такие как эмфизема легких, хронические пневмонии и бронхиты, которые ранее считались внутрибольничными инфекциями, – результат попадания в кровоток бактерий из их естественных «местообитаний» в нашем теле. Перемещаясь, к примеру, из кишечника в легкие, такие микроорганизмы могут привести к болезни и даже гибели человека.
В идеале для смены курсовых комбинаций антибиотиков пациентам необходимо иметь карту их антибиотикорезистентности. Иначе, как и в других странах, у нас появятся супербаги – штаммы бактерий, нечувствительные к антибиотикам.
Покажите ваши метаболиты
Один из оптимальных способов оценки микробиоты – анализ спектров бактериальных метаболитов. Но и здесь не все так просто, так как последние представляют собой очень большую и плохо изведанную палитру.
Одна из проблем заключается в том, что нет надежных способов отличить эндогенные метаболиты, которые производятся клетками человека, от попадающих в организм с продуктами питания, водой, воздухом, а также созданных микроорганизмами. На животных это можно сделать с использованием радиоактивных или изотопных меток, на человеке – нет.
Но существуют группы метаболитов, которые можно рекомендовать для применения в медицинской практике. Прежде всего это короткоцепочечные жирные кислоты. Это рутинный анализ: сегодня их соотношение определяют у любого пациента с проблемами кишечника еще до постановки диагноза.
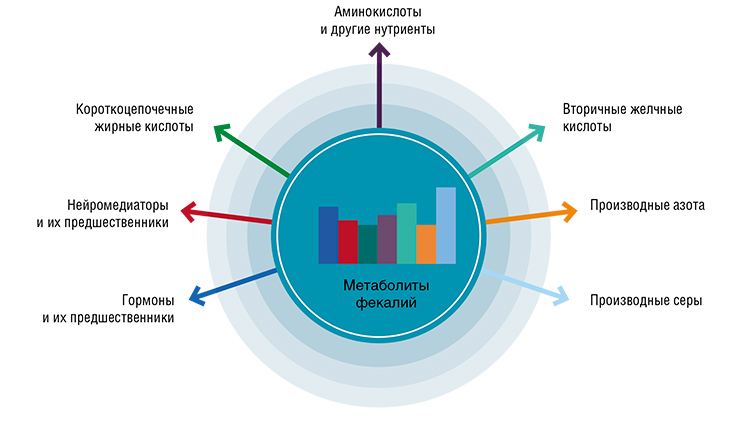
Вторая группа – гормоноподобные вещества, которые происходят из фолиевых кислот. В зависимости от спектра бактерий, которые окисляют либо продукты аддуктов фолиевой кислоты с глюкуронидами, либо ее саму, могут образовываться активные соединения стероидного ряда, имеющие свои рецепторы на надпочечниках, перикарде, миокарде, легких и т. д. Однако эти вещества эндокринологи сейчас просто «не видят».
Третья группа – индолы, которые в зависимости от химической модификации могут либо оказывать защитное действие, подавляя опасные кишечные патогены, либо быть мощным модулятором противовоспалительных реакций.
Какие существуют механизмы обратной связи между организмом и его микрофлорой? К примеру, когда вы садитесь на диету, ваши кишечные палочки секретируют пептиды, схожие с белковыми релизинг-факторами, которые выделяются в центральной нервной системе и служат для регуляции аппетита. Эти гормоноподобные бактериальные вещества, попадая в кровь, вызывают у вас чувство голода. Так бактерии «заставляют» вас их кормить.Второй пример касается людей, которые обычно потребляют мало белков животного происхождения. Соответственно, у них будет недостаток пищеварительных ферментов, в частности протеаз и липаз в тонком кишечнике. Если таким людям на пикнике «налечь» на шашлык, то белковые тела попадут в толстый кишечник, где не могут быть использованы из-за отсутствия протеолитических ферментов. В результате в кишечнике запускаются интенсивные гнилостные процессы, вызванные бурным развитием анаэробных гнилостных бактерий. На следующее утро в результате аутоинтоксикации такие люди чувствуют себя как после тяжелого похмельного синдрома
Баланс всех этих веществ важен не только для назначения персонифицированных схем лечения, но и для понимания, насколько хорошо удалось добиться конечного результата – надежной стабилизации физиологии пациента.
По-видимому, ученым и медикам предстоит большая работа по созданию ориентированной на медицину таблицы бактериальных метаболитов, разработке относительно дешевых методов их регистрации и понятных для врачей способов интерпретации. Другими словами, речь идет о выработке «показаний». И мерить метаболиты намного проще и правильнее, чем каждый раз определять состав микробиома (последнее гораздо важнее для фундаментальной науки, чем для практической медицины).
И снова дисбактериоз
В российской педиатрической практике до сих пор можно встретить диагноз «дисбактериоз», хотя в официальных международных классификациях болезней, например МКБ‑10, такого заболевания не существует. В случае диареи или других кишечных проблем у ребенка берут кал на посев, бактериологическая лаборатория подсчитывает количество 20—30 микроорганизмов (бифидо-, лакто-, актинобактерий и др.). Главной целью этих анализов является установление наличия воспалительного синдрома в кишечнике. Но бывают случаи, когда анализ четко показывает дисбактериоз, а человек чувствует себя нормально, никаких клинических симптомов нет, и наоборот.
Само слово «дисбактериоз» не совсем правильное. Речь идет скорее о дисбалансе, который касается не столько количественных характеристик бактерий, сколько большого числа метаболических параметров, включая содержание в кале коротких жирных кислот, индолов, свободной ДНК человека (если есть диарея, т. е. воспалительный синдром, кишечный эпителий активно слущивается). И дисбаланс проявляется не только внутри кишечника, как раньше думали, – это системное заболевание.
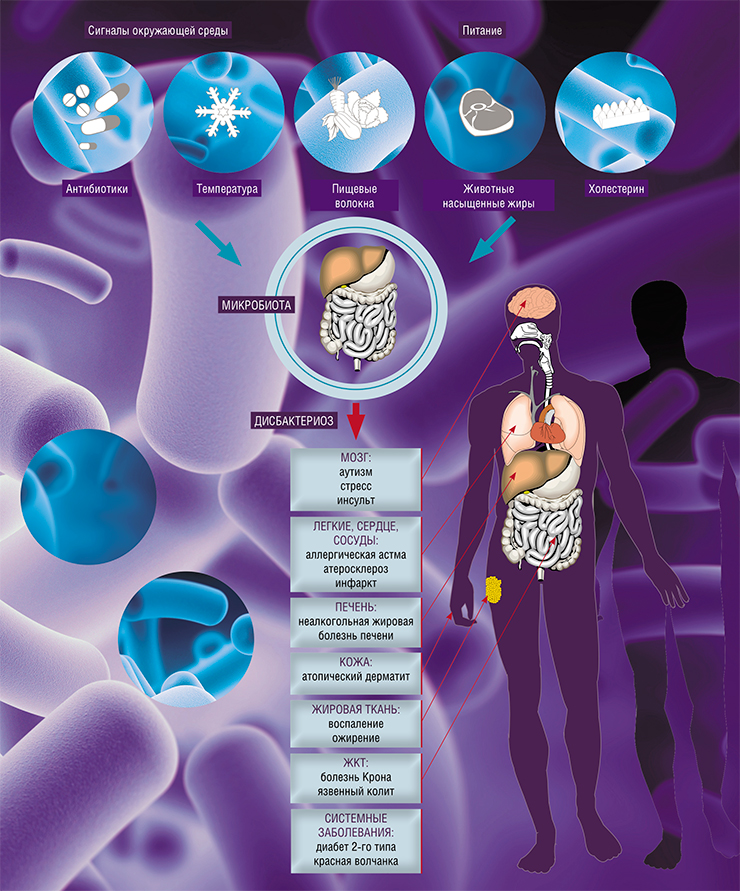
Дисбаланс кишечной флоры связан с развитием онкологических заболеваний, различных форм воспалительных процессов, а также с инфекцией клостридиями (эти бактерии часто присутствуют в кишечнике в небольшом количестве, обычно не вызывая патологии). Как правило, клостридиальная инфекция является психогенной; этих тяжелых пациентов долго и массированно лечат антибактериальными средствами.
Когда увлекались секвенированием генов и поиском бактериальных ассоциаций, выяснилось, что с кишечной миробиотой каким-то образом связаны очень многие, самые разные болезни. Среди них – метаболический синдром, диабет 2-го типа, астма, аутизм. Известно, что подсадка мышам микробиоты пациента с аутизмом приводит к формированию сходного синдрома, который снимается пересадкой микробиоты здоровых доноров.
Болезнь Крона
Остановимся подробнее на болезни Крона, хроническом воспалительном заболевании кишечника. За последнее столетие эпидемиология этого тяжелого заболевания существенно изменилась в худшую сторону: от 2–3 случаев на 100 тыс. человек в начале прошлого века до 150, как в некоторых современных скандинавских странах. Причем в эту статистику вошли лишь случаи с яркой клинической картиной. В связи с развитием методов капсульной эндоскопии, которая дала возможность смотреть прямо в середину тонкой кишки, эта статистика, вероятно, еще больше изменится.
Попыток объяснить причины и механизм развития болезни Крона было много. Так, есть генетическая теория для случаев чисто аутоиммунного процесса. И сегодня мы уже можем достаточно аккуратно распознавать генетические паттерны, которые коррелируют с вероятностью развития этой болезни у конкретного человека.
Исторически болезнь Крона ассоциировали со многими инфекционными заболеваниями, например туберкулезом кишечника. Недавно французские специалисты при исследовании западноевропейской популяции обнаружили, что с болезнью Крона тесно ассоциирован специализированный штамм кишечной палочки LF82. Этот известный уропатогенный штамм вызывает циститы (воспаление мочевого пузыря) и имеет склонность к повышенной адгезии и инвазии в клетки эпителия. Оказалось, что у некоторых пациентов с болезнью Крона эта кишечная палочка составляет до 80 % микробных сообществ, окружающих язвы в тонком кишечнике (в норме эта концентрация не превышает 3 %).
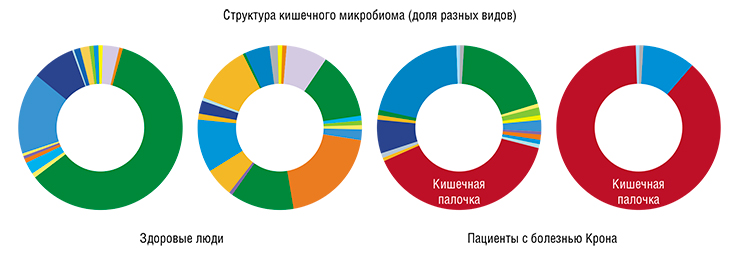
Казалось бы, если найден патоген, то можно как минимум продвинуться в лечении. Но, проведя филогенетический анализ, т. е. выделив и охарактеризовав штаммы у наших российских пациентов, мы поняли, что «наша» кишечная палочка отличается большим филогенетическим разнообразием и может принадлежать к обычной симбиотической флоре человека.
То, что мы обнаружили, является продолжением «философии контекстов». Во всех исследованных штаммах кишечной палочки у пациентов с болезнью Крона были найдены опероны (функциональные единицы генома у бактерий), связанные с утилизацией пропандиолов – продуктов распада фукозы, которая является частью защитной слизи, выделяемой слизистой оболочкой кишечника.
Эти и другие особенности бактерий кишечной палочки (например, присутствие генов, кодирующих железосодержащие белки-антиоксиданты) дают им преимущества относительно других штаммов микроорганизмов, находящихся в этот момент в кишечнике, что напоминает некоторые социальные модели развития человеческих обществ, когда скрытые группы людей при некоторых условиях становятся сильными и главными бенефициарами.
Речь идет о новой гипотезе, что кишечная палочка, не являясь в принципе патогеном, вызывающим конкретное заболевание, при развитии определенного сценария, связанного с применением антибиотиков, дисбактериозом, химическим отравлением или какими-то хроническими воспалительными процессами в слизистой, начинает получать все больше возможностей для размножения, ее численность становится подавляющей. Так начинается запуск патологического процесса.
Что такое ТФМ?
Наверное, далеко не все знают про процедуру трансплантации фекальной микробиоты (ТФМ). Не так давно американское Управление по санитарному надзору за качеством пищевых продуктов и медикаментов решило приостановить применение ТФМ в клинической практике, сославшись на два осложнения (одно со смертельным исходом) при пересадке кала. Причина – инфицирование пациентов штаммами кишечной палочки с генами множественной лекарственной устойчивости к антибиотикам.
Здесь нужно упомянуть, что в России смертельные осложнения от аппендицита составляют 1,5 %, хотя его давно научились оперировать. Если взять все опубликованные протоколы ТФМ, то мы получим процент осложнений меньше 0,001 %. К тому же это были пациенты после онкологических операций и химиотерапии, явно ослабленные. А, к примеру, наши коллеги из НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой (Санкт-Петербург) с помощью ТФМ спасают детей с острыми лейкозами, у которых главным осложнением лечения является сепсис. Использование ТФМ в такой безальтернативной ситуации, когда иммунной системы практически нет, а антибиотики не работают, может спасти до 60 % пациентов.
Но, действительно, необходимо очень четко выработать показания к применению ТФМ. Все это вопрос контекста: если мы делаем процедуру, правильно оценив все балансы, существующие на данный момент у конкретного пациента, то имеем все шансы ему помочь.
Манипуляции с микробиотой – это одно из направлений в персонализированной медицине. Так же как в случае применения таргетных препаратов, имеющих побочные действия, это должно быть очень обдуманным шагом. Оценить все возможные взаимоотношения между микробиотой и организмом практически невозможно: их настолько много, что они даже до конца не каталогизированы. Но вполне реально разработать так называемые суррогатные оценочные приемы на основе метаболического профилирования, анализа воспаления, эндоскопических практик и определенных методов контроля.
Наши наблюдения за ТФМ и процессами заселения кишечника «чужими» бактериями показывают, что, как и в случае с группами крови, здесь также существуют подходящие к друг другу группы доноров и реципиентов. Поэтому даже успешная с точки зрения клиники процедура может дать только временный эффект, и пересаженная флора через какое-то время «уходит». Кстати сказать, сегодня ведутся работы и по созданию так называемого искусственного кала, или искусственной микробиоты, но пока не очень успешно.
Представление о том, что мы «не одиноки» на своем жизненном пути, возникло очень давно, но лишь в новом веке ученые и врачи получили в свои руки инструментарий, позволивший изучать сообщества наших микроскопических сожителей.
Сама проблема составления полного каталога всех микроорганизмов, населяющих организм человека, является в первую очередь технологической, так как лишь очень немногие из них поддаются выращиванию на искусственных питательных средах. Причин этому несколько. Ведь даже очень богатые среды могут не иметь каких-то компонентов, необходимых для жизненного цикла того или иного штамма. К тому же разные бактерии обычно живут не одиночно, а составляют сообщество, поддерживая и дополняя друг друга.
Однако сейчас для того, чтобы узнать, есть ли те или иные виды бактерий в образце, достаточно выделить из него нуклеиновые кислоты, в первую очередь ДНК, и, «расшифровав» ее, сравнить с уже имеющимися базами данных. Удешевление этой процедуры позволило изучить то огромное разнообразие микроорганизмов, которые живут вместе с нами.
Наиболее сложным, но и, пожалуй, самым интересным объектом для изучения в этом смысле является кишечник. Его микробиом представляет собой очень сложную, иерархически организованную структуру. Ведь когда говорят о триллионах кишечных бактерий, то речь обычно идет о так называемой просветной флоре, той, что находится в просвете кишечника. Однако микроколонии бактерий живут и на самой слизистой – слое эпителиальных клеток, обращенных в просвет кишечника.
И здесь возникает множество вопросов. К примеру, как взаимодействуют между собой «просветные» и прикрепленные микроорганизмы, какова их роль в защите нас от патогенов, регуляции иммунитета? На сегодняшний день далеко не на все эти вопросы есть внятный ответ. При этом изучение микроорганизмов, живущих в слизистой, очень важно, так как они более устойчивы к воздействию антибиотиков и, в случае наступления антибиотик-ассоциированной диареи, могут послужить базой для регенерации кишечного микробиома.
Проблема лекарственной устойчивости бактерий заслуживает особого внимания. Если вы используете антибиотики без рекомендации врача, то размножаете у себя пусть и дружественные бактерии, но с резистентностью к подобным лекарствам. И эта способность путем горизонтального переноса генов может передаваться другим, уже болезнетворным бактериям. Поэтому бесконтрольное использование антибиотиков, безусловно, влияет на скорость распространения в человеческой популяции резистентных штаммов.
Наука о микробиоте человека сейчас очень быстро развивается. Новые данные появляются с фантастической скоростью, и с каждым месяцем мы узнаем все больше о наших микроскопических симбионтах, во многом определяющих наше здоровье и саму жизнь.
Литература
Arumugam M., Raes J., Pelletier E. et al. Enterotypes of the human gut microbiome // Nature. 2011. V. 473. P. 174–180.
Arumugam M., Sunagawa S., Mitreva M. et al. Genomic variation landscape of the human gut microbiome // Nature. 2013. V. 493. P. 45–50.
Claesson M. J., Jeffery I. B., Conde S. et al. Gut microbiota composition correlates with diet and health in the elderly // Nature. 2012. V. 488. P. 178–184.
Dubinkina V. B., Tyakht A. V., Odintsova V. Y. et al. Links of gut microbiota composition with alcohol dependence syndrome and alcoholic liver disease // Microbiome. 2017. V. 5(1):141.
Huttenhower C., Gevers D., Knight R. et al. Human Microbiome Project Consortium. Structure, function and diversity of the healthy human microbiome // Nature. 2012. V. 486. P. 207–214.
Karlsson F. H., Fåk F., Nookaew I. et al. Symptomatic atherosclerosis is associated with an altered gut metagenome // Nat. Commun. 2012. V. 3:1245.
Lagier J.-C., Million M., Hugon P. et al. Human gut microbiota: repertoire and variations // Front Cell Infect. Microbiol. 2012. V. 2:136.
Ogorodova L. M., Fedosenko S. V., Popenko A. S. et al. Comparison Study of Oropharyngeal Microbiota in Case of Bronchial Asthma and Chronic Obstructive Pulmonary Disease in Different Severity Levels // Vestn. Ross. Akad. Med. Nauk. 2015. V. 6. P. 669–678.
Olekhnovich E. I., Manolov A., Samoilov A. E. et al. Shifts in the Human Gut Microbiota Structure Caused by Quadruple Helicobacter pylori Eradication Therapy // Front Microbiol. 2019. DOI: 10.3389/fmicb.2019.01902.
O’Hara A. M. & Shanahan F. The gut flora as a forgotten organ // EMBO Rep. 2006. V. 7. P. 688–693.
Petrov V. A., Saltykova I., Zhukova I. A. et al. Analysis of Gut Microbiota in Patients with Parkinson’s Disease // Bull. Exp. Bio. l Med. 2017. V. 162(6). P. 734–737.
Qin J., Li Y., Cai Z. et al. A metagenome-wide association study of gut microbiota in type 2 diabetes // Nature. 2012. V. 490. P. 55–60.
Tyakht A. V., Kostryukova E., Popenko A. S. et al. Human gut microbiota community structures in urban and rural populations in Russia // Nat. Commun. 2013. V. 4:2469.
Tyakht A. V., Manolov A., Kanygina A. V. et al. Genetic diversity of Escherichia coli in gut microbiota of patients with Crohn’s disease discovered using metagenomic and genomic analyses // BMC Genomics. 2018. V. 19(1):968.
Wu G. D., Chen J., Hoffmann C. et al. Linking long-term dietary patterns with gut microbial enterotypes // Science. 2011. V. 334. P. 105–108.
Yatsunenko T., Rey F. E., Manary M. J. et al. Human gut microbiome viewed across age and geography // Nature. 2012. V. 486. P. 222–227.