РНК-интерференция и антисмысловой подход: конкуренты или сотоварищи?
Когда РНК-интерференция неожиданно для многих исследователей и врачей, заинтересованных в эффективных методах подавления экспрессии различных генов (нокаута генов), появилась в арсенале экспериментальных методик, ее рассматривали чуть ли не как альтернативу традиционному антисмысловому подходу. Дискуссия была настолько оживленной, что вызвала появление в 2004 г. целого блока материалов в журнале Nature, которому был предпослан заголовок: «Станет ли РНК-интерференция конкурентом антисмысловому подходу?»
ПОСТСКРИПТУМ редакционный комментарий
Когда РНК-интерференция неожиданно для многих исследователей и врачей, заинтересованных в эффективных методах подавления экспрессии различных генов (нокаута генов), появилась в арсенале экспериментальных методик, ее рассматривали чуть ли не как альтернативу традиционному антисмысловому подходу. Дискуссия была настолько оживленной, что вызвала появление в 2004 г. целого блока материалов в журнале Nature, которому был предпослан заголовок: «Станет ли РНК-интерференция конкурентом антисмысловому подходу?»
Горячие сторонники нового метода утверждали, что интерференция уже поднялась на такую высоту, куда антисмысловой подход не дерзал и заглядывать. Они ссылались на результаты своих исследований, согласно которым новый метод был на порядки более чувствительным и эффективным, чем старый. По некоторым оценкам, эффективная концентрация siРНК, необходимая для «глушения» (silencing) генов, в 100—1000 раз ниже, чем для антисмысловых последовательностей.
Представители традиционного подхода настаивали на том, что для подавления экспрессии в культуре клеток эффективность обоих методов сравнима. По их мнению, причиной недооценки эффективности антисмысловых последовательностей является либо использование старых олигонуклеотидов первого поколения (на тот момент уже были известны более совершенные олигонуклеотиды третьего поколения), либо неправильный подбор самих последовательностей-мишеней для них.
Что касается использования интерферирующих РНК in vivo, то, по словам представителя калифорнийской биотехнологической компании ISIS Pharmaceuticals, требуется существенная оптимизация этого подхода, чтобы хотя бы встать на один уровень с антисмысловыми препаратами. Такая оценка не кажется неожиданной для исследователей из ISIS – единственной фирмы, преуспевшей в выпуске на фармацевтический рынок препарата на основе антисмысловых олигонуклеотидов – Vitravene, – использующегося для лечения кожных заболеваний.
Впрочем, вряд ли с его мнением согласился бы другой представитель фармацевтической индустрии. По мнению вице-президента компании SIRNA Therapeutics, прорыв в области РНК-интерференции оказался для всех полной неожиданностью. Но для его бизнеса эта неожиданность случилась как раз вовремя. Известная до 2003 г. под названием Ribozyme Pharmaceuticals компания была в глубоком кризисе после того, как ее самые подающие надежду препараты из «антисмысловой» серии оказались неэффективными в клинических испытаниях. Переориентировавшись на технологию siРНК, она заново вошла в фармацевтический бизнес как SIRNA Therapeutics. Препарат Sirna-27, направленный на лечение возрастной дегенерации сетчатки, стал первым лекарством на основе siРНК, допущенным до клинических испытаний.
Интересно, что фармацевтические компании, использовавшие другие подходы к разработке препаратов на основе РНК, в том числе и «антисмысловые» лекарства, никогда не расценивали siРНК технологию как конкурентную. Используя свой богатый опыт в химии РНК, они немедленно и изо всех сил включились в гонку siРНК-препаратов. Особенно ценным оказался их опыт в разработке средств доставки РНК-препаратов в клетки разных типов, ведь именно отсутствие таких средств тормозит трансформацию технологий как антисмысловой, так и интерферирующей РНК в полноценную индустрию массовой разработки и производства лекарств от широчайшего спектра заболеваний.
Фирмы, разрабатывающие средства доставки, обычно оптимизируют их для обоих типов препаратов, как это делает для своих липидных систем доставки компания Neopharm из Иллинойса. При этом ведущий научный сотрудник компании считает, что в общем и целом препараты интерферирующих РНК работают лучше, чем антисмысловые.
Впрочем, индустрии siРНК нужен не только опыт средств доставки. Есть задачи, которые может решить только комбинация антисмысловой технологии и интерферирующих РНК. Так, siРНК являются эффективным средством для «глушения» генов. А можно ли заставить ген работать активнее?
Известно, что причиной ряда заболеваний, в том числе и онкологических, является повышенный клеточный уровень ряда микроРНК, который снижает активность экспрессии ряда клеточных генов. МикроРНК – это клеточные аналоги siРНК, который сама клетка использует для регуляции работы своих генов. Снять такую микроРНК-блокаду важных клеточных генов помогут так называемые антагонисты РНК (antagomiRNA) – антисмысловые молекулы, тем или иным способом инактивирующие клеточные микроРНК.
Есть и другие области применения, где антисмысловые РНК могут зарекомендовать себя лучше интерферирующих. Так, крепким орешком для siРНК могут оказаться некоторые вирусы. Существовавшая изначально точка зрения, что механизм РНК-интерференции является своеобразным клеточным иммунитетом от вирусных инфекций, оказалась справедливой только для вирусов растений и ряда низших животных. Несмотря на то, что с начала использования технологии РНК-интерференции появились сообщения об успешном подавлении активности таких вирусов, как ВИЧ (HIV-1), вирусы гепатита B и C, вирус атипичной пневмонии (SARS), гриппа типа А в различных экспериментальных системах, оказалось что многие из вирусов применяют активные и пассивные средства борьбы с siРНК. Многие белки, закодированные в геноме различных вирусов, являются супрессорами, то есть подавляют РНК-интерференцию. Среди них NS1 белок вируса гриппа А, белок оболочки вируса гепатита С, белок Tat вируса иммунодефицита человека, белок VP35 вируса Эбола и др.
Вообще оказалось, что многие РНК-вирусы снабжены неплохой системой защиты. РНК-геном ретровирусов (таких как вирус саркомы Рауса) оказался так плотно упакован внутри вирусной частицы, что просто недоступен для РНК-интерференции. Кстати, вирус иммунодефицита человека относится к роду лентивирусов семейства ретровирусов, и принцип сборки вирусной частицы у него очень близок к классическим ретровирусам.
Существуют противоречивые сообщения о возможности инактивировать геном ВИЧ внутри такой белковой упаковки с помощью siРНК. Если атакующий клетку вирус окажется защищен от интерференции, на идее создания профилактической вакцины от ВИЧ с применением этой технологии придется поставить точку. После того как геном ВИЧ встроится в хромосому атакованной клетки и начнет экспрессироваться, интерферирующим РНК останется только бороться с копиями вирусных РНК и по мере сил препятствовать размножению вируса, но «вычистить» его из клетки уже не удастся.
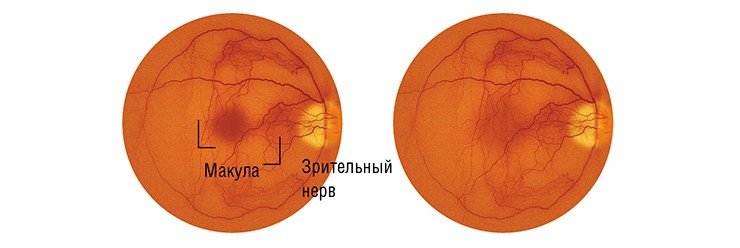
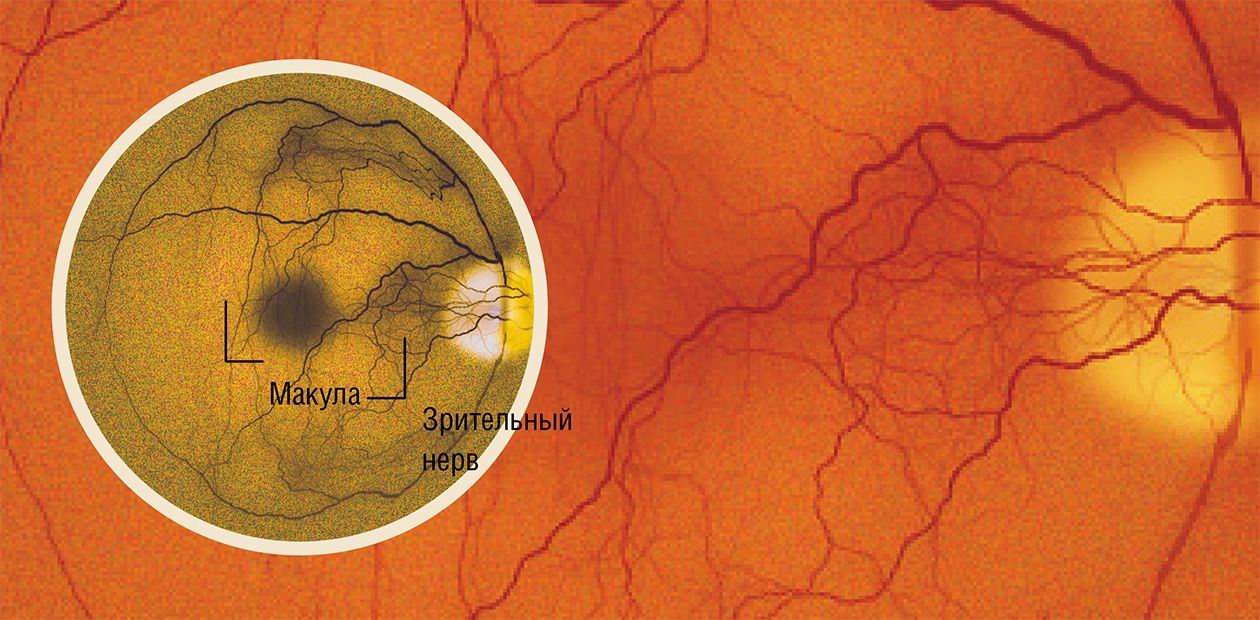
Дегенерация макулы – одна из главных причин безвозвратного снижения зрения у пожилых людей. Если раньше такой диагноз ставился обычно в возрасте 70—80 лет, то сейчас возрастной порог снизился до 40 до 60 лет. По данным Американской Академии Офтальмологии, в США возрастная дегенерация (AMD) является главной причиной утраты зрения после 50 лет.
При возрастной дегенерации сначала в поле зрения появляются точечные дефекты, затем в процесс вовлекаются более обширные области и, наконец, изображение в центре просто исчезает. Одним из ранних симптомов заболевания является искажение зрения, metamorphopsia – решетка из параллельных линий видится извивистой, местами изображение ее просто исчезает. Простым и эффективным инструментом для выявления этого симптома является Amsler Grid Test – центральная черная точка для фиксации зрения и решетка вокруг нее.
Возрастная дегенерация может приводить к полной утрате зрения. Пожалуй, самой большой утратой для тех, у кого зрение частично сохраняется, является невозможность видеть лица – вблизи или совсем.
Препарат SiRNA-27 – первое из лекарств серии интерферирующих РНК, допущенный до клинических испытаний. Всего из 8 siРНК препаратов, допущенных до испытаний, три направлены на лечение возрастной дегенерации сетчатки.
Кроме того, практически все вирусы используют стратегию «вариантов-беглецов» для пассивного ухода от контроля РНК-интерференции. Вирусы способны мутировать с огромной скоростью, накапливая в своем геноме замены букв-нуклеотидов. Для того чтобы интерферирующая РНК перестала работать, порой достаточно одной замены в участке вирусной РНК, комплементарном siРНК. Антисмысловые препараты в этом смысле куда менее требовательны и могут выдержать несколько замен, не теряя при этом своей противовирусной активности. Если в случае препаратов интерферирующей РНК для большинства опасных вирусов уже показано появление вирусных вариантов-беглецов, то уход, да и то неполный, от антисмысловых препаратов был продемонстрирован разве что для вируса атипичной пневмонии.
На сегодняшний день представляется вполне ясным, что РНК-интерференция не является конкурентом, призванным вытеснить классическую антисмысловую технологию с фармацевтического рынка. У каждого подхода есть свои сторонники и противники, и есть задачи, которые более успешно решаются в рамках той или иной технологии. Есть также и такие задачи, которые можно с большим успехом решить, применяя комбинации препаратов антисмысловых и интерферирующих РНК.
Ответ на другой вопрос: не ждет ли первоначально сверх успешную РНК-интерференцию судьба классической антисмысловой технологии, на которую два десятка лет назад возлагались огромные, но по сегодняшний день не сбывшиеся надежды, найти сложнее.
Список самых опасных врагов сегодняшней медицины, болезней – массовых убийц, препараты против которых теоретически возможно получить на основе той или иной технологии, очень близок для siРНК и антисмысловых олигонуклеотидов. Сюда входят и все виды онкологических болезней, и нейродегенеративные заболевания, такие как болезнь Альцгеймера и болезнь Хантингтона, основные сердечно-сосудистые заболевания (наследственные болезни сердца, гипертония, атеросклероз, миокардит, гипертрофия сердца и инфаркт), и болезни, связанные с нарушением работы иммунной системы (астма, псориаз, аллергические состояния, воспаления), и многие виды вирусных и невирусных гепатитов, а также ряд других вирусных инфекций.
Проблемные стороны обеих технологий также близки: потенциальная токсичность препаратов, глушение неспецифических генных каскадов, которые не предполагалось подавлять с помощью данного препарата (так называемая «стрельба мимо мишени», off-targets), и, как уже указывалось, так и не решенная для большинства тканей и типов клеток проблема доставки терапевтических молекул РНК.
Как экспериментальная технология нокаута генов РНК-интерференция уже на сегодня состоялась как подход, который стоит считать приоритетным для широчайшего спектра исследований. Она также существенно снижает расходы на тестирование кандидатных лекарственных препаратов в фармакологии. Станут ли siРНК-молекулы основой для нового поколения терапевтических препаратов или повторят судьбу антисмысловых олигонуклеотидов?
Большинство специалистов осторожно указывают на возможность терапевтического применения интерферирующих РНК ex vivo, то есть их воздействия на клетки, взятые из организма пациента для модификации. Исследователи из индустриального сектора чаще звучат оптимистичнее своих академических коллег, считающих, что РНК-интерференция не сможет «вылезти из чашки Петри», пока не будет решена проблема доставки.
Литература к редакционному комментарию
Dykxhoorn D. M. and Lieberman J. The silent revolution RNA Interference as Basic Biology, Research Tool, and Therapeutic // Annual Review of Medicine, 2005. V. 56(1):401
Haasnoot J., Westerhout E. M., Berkhout B. RNA interference against viruses: strike and counterstrike // Nature Biotechnology 25, 1435 — 1443 (2007)
Sassen S., Miska E. A., Caldas C. MicroRNA—implications for cancer// Virchows Arch. 2008 January; 452(1): 1—10
Pellish R. S., Nasir A., Ramratnam B. and Moss S. F. RNA interference — potential therapeutic applications for the gastroenterologist // Alimentary Pharmacology and Therapeutics 27 (9) , 715—723, May 2008
Wu W., Sun M., Zou G.-M. and Jianjun Chen. // International Journal of Cancer: 120, 953—960, 2006
Marquez R. T. and MCcaffrey A. P. Advances in MicroRNAs: Implications for Gene Therapists// Human Gene Therapy. January 1, 2008, 19(1): 27-38. doi:10.1089/hum. 2007.147.
Wu L., Belasco J. G.. Let Me Count the Ways: Mechanisms of Gene Regulation by miRNAs and siRNAs // Molecular Cell 29, January 18, 2008:1-7
Kurreck J. Antisense technologies. Improvement through novel chemical modifications // FEBS Journal, Volume 270, Number 8, April 2003 , pp. 1628-1644(17)
Clayton J. The silent treatment. // Nature. Vol 431, 599-605, 2004
Lieberman J., Song E., Lee S. K., Shankar P. Interfering with disease: opportunities and roadblocks to harnessing RNA interference // Trends in Molecular Medicine 2003 Sep; 9(9):397—403
Tang Y., Ge Y.-z., Q Yin J. Exploring in vitro roles of siRNA in cardiovascular disease // Acta Pharmacologica Sinica, Volume 28, Number 1, January 2007, pp. 1—9(9)
De Fougerolles A. R. Delivery Vehicles for Small Interfering RNA In Vivo // Human Gene Therapy 19:125—132, February 2008
Li C. X., Parker A., Menocal E., Xiang S., Borodyansky L. and Fruehauf J. H. Delivery of RNA interference. Cell Cycle 5(18): 2103—2109, 2006 September 15
Love T. M., Moffett H. F., Novina C. D.. Not miR-ly small RNAs: big potential for microRNAs in therapy // Journal of Allergy and Clinical Immunology, 2008 Feb ;121 (2):309—19 18269923 (P,S,E,B,D)
Aboul-Fadl T. Antisense Oligonucleotides: The State of the Art // Current Medicinal Chemistry, Volume 12, Number 19, September 2005 , pp. 2193—2214(22)