ГМО и другие генетические тайны селекции растений
Уже давно растениеводство во всем мире радуется многочисленным подаркам генной инженерии – устойчивым к вредителям и холоду, быстрорастущим и продуктивным растениям, однако для среднестатистического потребителя метка «ГМО» сегодня сродни печати Каина. Почему так? Один ответ лежит на поверхности: генные инженеры делают сегодня то, чего природа не смогла бы сделать никогда или, по крайней мере, очень нескоро, что не только впечатляет, но и пугает. Людей настораживает и то, что сами создатели ГМО не торопятся полностью исключать риск возможных негативных последствий их распространения. С другой стороны, согласно свежим опросам «Левада-центр», всего лишь 30 % россиян точно знают, что гены содержатся во всех растениях, а не только в генетически модифицированных, поэтому тотальная ГМО-боязнь во многом вызвана тотальной «генетической» безграмотностью. Между тем спектр современных методов селекции новых сортов растений очень широк, а среди разрешенных есть не менее рискованные и/или практически неизвестные широкой общественности подходы
ГМО расшифровывается как генетически модифицированный организм, что подразумевает то или иное воздействие на геном растений – хранилище наследственной информации, «святую святых» живых клеток. Сегодня большинство новейших методов селекции растений тяготеют к внесению изменений непосредственно в структуру ДНК. В результате, по определению ВОЗ, мы и получаем ГМ-растения – новые сорта, которые не могли образоваться в природе в результате размножения или естественной рекомбинации («перемешивания генов»).
Все это так, но в изменении генома растений на самом деле нет ничего нового и революционного! Человек всегда так или иначе оказывал влияние на генетику растений, которые выращивал, хотя и понятия не имел о генах.
Путь к современным культурным растениям, которые мы употребляем в пищу, начался примерно 10 тыс. лет назад, когда появилось сельское хозяйство. Человек выбирал самые здоровые и пригодные для еды растения и планомерно их выращивал. В сельском хозяйстве нет места закону естественного отбора: согласно закону человека (искусственному отбору), выживает только то растение, которое отвечает его запросам.

Позднее были обнаружены способы прямого воздействия на ДНК: в 1960-х гг. – путем провоцирования мутаций, в 1983 г. – с помощью искусственно созданной ДНК. Тем не менее традиционные методики селекции, такие как скрещивание, хотя и претерпели значительные изменения, продолжают применяться на равных с новейшими методами. Именно разнообразие подходов дает современным селекционерам эффективный набор инструментов, с помощью которых они могут «по заказу» создавать растения будущего
Ярким примером расхождения целей естественного отбора и селекции служит кукуруза. У предка этого злака зерна при созревании легко отделялись от початка и падали на землю. Такая кукуруза прекрасно размножалась, но человек неизбежно терял большую часть урожая. Что же мы видим теперь? Ядра современной кукурузы на момент зрелости прочно прикреплены к початку. Так же обстоит дело и с другими зерновыми культурами – рисом, ячменем, пшеницей.
 Все эти новые виды культурных растений, по сути, являются результатом модификации генома разными способами, например, путем скрещивания разных сортов, что приводит к появлению совершенно новых культурных форм. Огромный материал для искусственного (так же как и для естественного) отбора предоставляет природный мутационный процесс. Ведь спонтанные мутации (изменения) в ДНК растений происходят постоянно, например, в результате действия солнечного излучения. И если такая мутация приводит к появлению особей с заметными положительными отличиями, их остается только тиражировать – вот и вся селекция. Примером служит большое разнообразие современных овощей семейства крестоцветных: брокколи, цветная и белокочанная капуста происходят от одного общего предка (Kempin et al., 1995).
Все эти новые виды культурных растений, по сути, являются результатом модификации генома разными способами, например, путем скрещивания разных сортов, что приводит к появлению совершенно новых культурных форм. Огромный материал для искусственного (так же как и для естественного) отбора предоставляет природный мутационный процесс. Ведь спонтанные мутации (изменения) в ДНК растений происходят постоянно, например, в результате действия солнечного излучения. И если такая мутация приводит к появлению особей с заметными положительными отличиями, их остается только тиражировать – вот и вся селекция. Примером служит большое разнообразие современных овощей семейства крестоцветных: брокколи, цветная и белокочанная капуста происходят от одного общего предка (Kempin et al., 1995).
Дальше – больше. За последние 80 лет люди получили более 3 тыс. новых сортов растений, воздействуя на исходные формы излучением или химическими реагентами, чтобы вызвать непредсказуемые мутации в ДНК. Растения, полученные в результате такого искусственно вызванного ненаправленного мутагенеза, успешно возделывают и поныне. Более того, как это ни парадоксально, они никогда не считались ГМО. Впоследствии в обществе распространилось крайне ошибочное мнение, что первые генетически модифицированные растения появились лишь в результате использования методов генной инженерии, целенаправленно воздействующих на ДНК.
В любом случае оценивать новый сорт следует исходя из его характеристик, а не того или иного пути селекции. А чтобы составить собственное мнение об опасности ГМО, нужно как минимум понимать, откуда они берутся.
Рецепт ГМО: режь, исправляй, сшивай
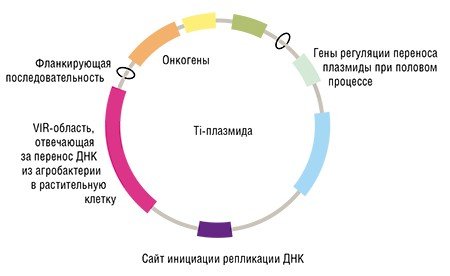
Так как же сделать ГМО из обычного растения? Рецепт довольно прост. Возьмите геном растительной клетки и добавьте в него «генетическую конструкцию» – последовательность ДНК, кодирующую производство нужного белка. Доставить ген можно с помощью вектора – молекулы ДНК или РНК, способной «размножаться» и переносить чужеродный наследственный материал из клетки в клетку. Таким образом можно добавить сразу несколько генов, например, с помощью вектора на основе кольцевой бактериальной плазмиды.
На первый взгляд все просто, если не задумываться о том, как вставить новый генный фрагмент именно в тот участок ДНК растительной клетки, который нам нужен. А ведь в этом и заключается самая сложная задача редактирования генома, результатом которого являются современные ГМО.
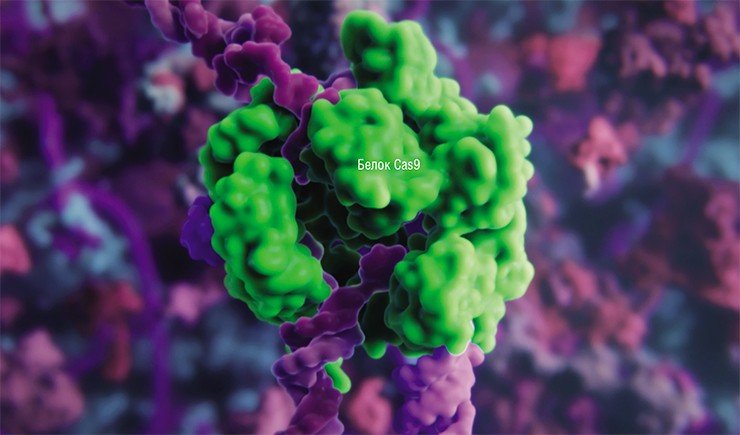
Для того, чтобы расщеплять молекулы ДНК в точно заданных участках, сначала стали использовать рестриктазы – ферменты-«ножницы», способные узнавать определенные последовательности нуклеотидов (строительных блоков ДНК). Функцию сшивки ДНК-цепи исполняли другие ферменты – ДНК-лигазы, призванные исправлять (репарировать) повреждения в структуре ДНК.
Сегодня, как и 30—40 лет назад, эти методы активно используют для получения новых вариантов бактериальных и вирусных геномов. А вот для успешной работы с геномами высших организмов (таких как растения, животные и мы с вами) этих инструментов оказалось недостаточно. Дело в том, что рестриктазы способны узнавать лишь короткие последовательности ДНК, что вполне достаточно для эффективного расщепления коротких ДНК-цепей бактерий, где такие участки встречаются нечасто. Но геномы высших организмов содержат огромное множество коротких последовательностей нуклеотидов, узнаваемых рестриктазами, поэтому «прицельность» метода оказывается очень плохой.
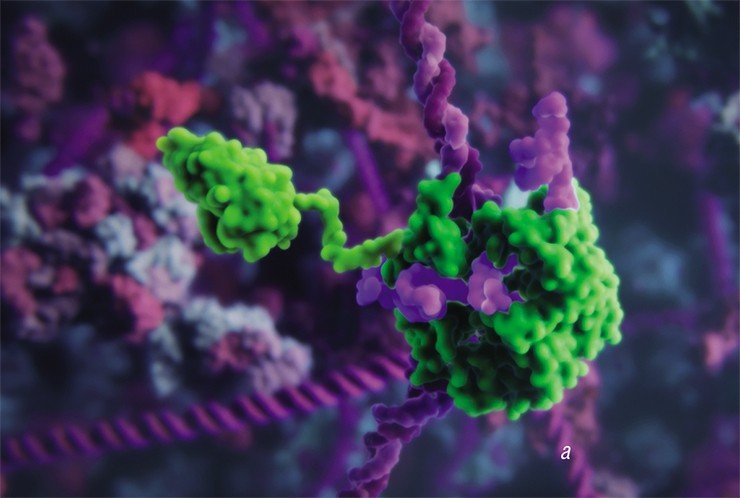
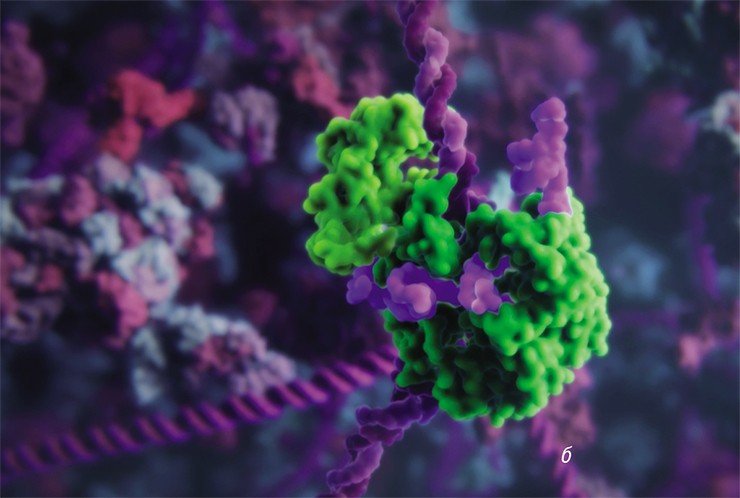
Для редактирования таких геномов пришлось создавать свои инструменты точечного воздействия на ДНК: сначала олигонуклеотид-направленный мутагенез растений, затем сайт-направленный мутагенез с использованием ферментов-нуклеаз с «цинковыми пальцами», TALENs-нуклеаз и даже мегануклеаз (Закиян, 2014; Daboussi, 2015). Но лишь с открытием в 2012—2013 гг. знаменитой технологии CRISPR/Cas9 ученые вплотную подошли к точному исправлению или редактированию генов и геномов (Cong, 2013). Возможность вносить контролируемые изменения в наследственную информацию живых клеток стала настоящим прорывом и повлекла за собой глобальные изменения в селекции.
Насколько остры генетические ножницы?
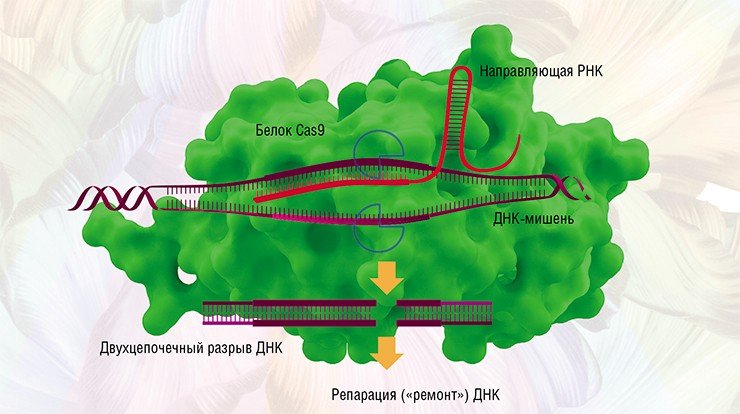
Основой системы CRISPR/Cas9 стал своеобразный молекулярный механизм, с помощью которого бактерии защищаются от бактериофагов (бактериальных вирусов). При проникновении патогенного вируса в бактерию запускается «иммунная» реакция, приводящая к расщеплению чужеродной генной последовательности. Это делает белок-«ножницы» Cas после того, как захватчик распознан по генному «портрету» – фрагментам вирусной ДНК, хранящимся в участке CRISPR бактериального генома.
На основе бактериальных CRISPR/Cas-систем ученые создали упрощенные искусственные молекулярные конструкции, включающие белок Cas9 и обеспечивающие невероятную точность при разрезании цепей ДНК (Закиян, 2014). С их помощью стало возможным проводить все виды модификаций генома: вносить точечные мутации, встраивать, исправлять, заменять или удалять крупные ДНК-последовательности и фрагменты выбранных генов.
С помощью системы CRISPR/Cas9 уже внесены точные модификации в геном множества растений, в частности, получены новые сорта риса, устойчивые к поражению гнилью, вызываемой фитопатогенными бактериями Xanthomonas, а также знаменитый «золотой рис», содержащий ген бета-каротина (Chen, Gao, 2013). Была решена и нетривиальная задача – создание растений-«биофабрик», способных синтезировать белки человека: инсулин, необходимый для больных сахарным диабетом, и альбумин, применяемый при лечении ожогов и цирроза.

Но несмотря на подтвержденную эффективность системы CRISPR/Cas9 все еще остается риск неспецифичного воздействия на ДНК и нарушения последовательности кодирующих генов. Неудивительно, что настоящий взрыв в мировом сообществе вызвала публикация китайских ученых из Университета Сунь Ятсена (КНР), несколько лет назад впервые применивших CRISPR/Cas9 для исправления генома эмбрионов человека с целью лечения генетического заболевания талассемии. При этом лишь для 4-х из 86 подопытных оплодотворенных яйцеклеток удалось достичь положительного результата (Liang et al., 2015).
На пути развития технологий, использующих принципы синтетической биологии, еще остается множество социальных барьеров, несмотря на то, что современные ГМ-продукты обладают высоким уровнем безопасности. В свое время большой резонанс вызвали справедливо оспариваемые статьи о развитии раковых опухолей у крыс и гибели бабочек, спровоцированных использованием ГМО (Walker, 2006). В результате общенациональный опрос в США, проведенный Hart Research Associates в 2010 г., показал, что не более 10 % людей не связывают генную инженерию с угрозой биотерроризма, нанесением вреда окружающей среде и здоровью человека, а также не считают создание искусственной жизни чем-то аморальным. В то же время анализ общественного мнения в Великобритании показал, что более половины населения признает полезность новых биотехнологий для общества, несмотря на сопряженный с ними экологический риск (Philp et al., 2014). Об уровне биологического образования в России можно судить по опросу, проведенному в 2015 г. в Казани, где 55 % горожан высказались за полный запрет ГМО, при том что лишь 15 % респондентов честно признались, что затрудняются сказать о том, что такое ГМО, а большая часть (48 %!) предложили изъять из продажи «любые пищевые продукты, содержащие гены» (Бизнес Online, 2015). Если учесть, что «гены» имеются в клетках всех живых организмов, включая бактерии, то таких борцов ожидает безрадостное гастрономическое будущее: крахмал с маслом на первое и сахар с соком на второе, ведь даже в обычном молоке присутствуют соматические клетки со своим генным содержимымСегодня ряд специалистов призывают к мораторию на любые эксперименты, связанные с редактированием генов человеческих эмбрионов или половых клеток. Их опасения можно понять: когда речь идет о геноме человека, успех должен быть гарантирован. И все же прогресс не остановить: недавно Великобритания стала второй страной, где исследователям было позволено проводить подобные эксперименты (Ершов, 2016).
Тем не менее страх человека перед вмешательством в геном живых организмов не только не убывает, но и в некоторых случаях даже продолжает расти. Вследствие этого оборот и потребление продуктов геномного редактирования растений строго контролируются на законодательном уровне, что препятствует переходу мирового сельского хозяйства на использование продвинутых методов селекции. Однако ученые не сдаются и предлагают сократить до минимума и даже исключить возможные риски негативных последствий введения новых генов в организм растений.
Снижаем риски: от ТРАНС к ЦИС и ниже
Сейчас прохождение всех тестов на биобезопасность и вывод на рынок генетически модифицированных организмов, в том числе растений, жестко регулируется на международном уровне. В этом вопросе правовая база ЕС опирается на директиву Европейского парламента и Совета Европейского союза от 12 марта 2001 г. «О преднамеренном выпуске в окружающую среду генетически модифицированных организмов». Примечательно, что данный нормативный документ исключает из перечня ГМО организмы, полученные путем скрещивания, экстракорпорального оплодотворения, полиплоидной индукции, возникновения мутаций и слияния протопластов скрещиваемых видов (соматическая гибридизация).
 Законодательство РФ в области ГМО растительного происхождения регулируют 4 федеральных закона и 6 постановлений Правительства РФ, в том числе федеральный закон № 86-ФЗ «О государственном регулировании в области генно-инженерной деятельности» от 5 июля 1996 г. Ожидается вступление в силу постановления, позволяющего узаконить возделывание ГМ-культур на территории России, которые пока можно выращивать только на опытных участках. Для ввоза в нашу страну сегодня разрешены 22 линии пищевых и кормовых ГМ-растений, среди которых кукуруза, картофель, соя, сахарная свекла и рис, а любые ГМО и ГМ-продукты должны проходить обязательную регистрацию.
Законодательство РФ в области ГМО растительного происхождения регулируют 4 федеральных закона и 6 постановлений Правительства РФ, в том числе федеральный закон № 86-ФЗ «О государственном регулировании в области генно-инженерной деятельности» от 5 июля 1996 г. Ожидается вступление в силу постановления, позволяющего узаконить возделывание ГМ-культур на территории России, которые пока можно выращивать только на опытных участках. Для ввоза в нашу страну сегодня разрешены 22 линии пищевых и кормовых ГМ-растений, среди которых кукуруза, картофель, соя, сахарная свекла и рис, а любые ГМО и ГМ-продукты должны проходить обязательную регистрацию.
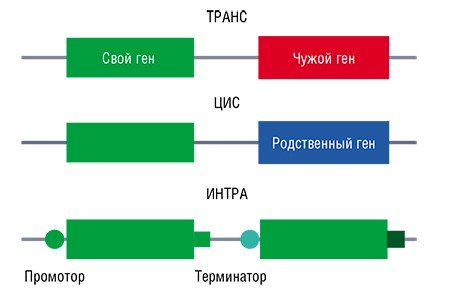
В свою очередь, мировое ученое сообщество считает, что нужно различать ГМО по способу получения и делать послабления для продуктов, полученных умеренным вмешательством. Так появилась система деления ГМО на три вида: ТРАНС, ЦИС и ИНТРА.
 Трансгенными сегодня называют организмы с искусственно введенными генами, которые в принципе не могут быть приобретены путем естественного скрещивания. Это могут быть гены растений других видов или животных, например рис, в геном которого встроен ген кукурузы. Потенциальная опасность трансгенных культур в том, что приобретенные таким образом новые качества могут повлиять на пригодность к использованию в пищевых или кормовых целях, а затем передаться диким родственникам, что может иметь непредсказуемые последствия для природных экосистем. По этой причине законодательные и регулирующие органы развитых стран уделяют большое внимание биобезопасности таких культур, чтобы снизить риск экологических сдвигов.
Трансгенными сегодня называют организмы с искусственно введенными генами, которые в принципе не могут быть приобретены путем естественного скрещивания. Это могут быть гены растений других видов или животных, например рис, в геном которого встроен ген кукурузы. Потенциальная опасность трансгенных культур в том, что приобретенные таким образом новые качества могут повлиять на пригодность к использованию в пищевых или кормовых целях, а затем передаться диким родственникам, что может иметь непредсказуемые последствия для природных экосистем. По этой причине законодательные и регулирующие органы развитых стран уделяют большое внимание биобезопасности таких культур, чтобы снизить риск экологических сдвигов.
В геном цисгенных растений могут быть введены гены организмов того же или близких видов, с которыми возможно скрещивание в естественных условиях. При этом сам целевой ген не должен быть видоизменен или оторван от своих регуляторных последовательностей. Пример цисгенного растения – картофель, не подверженный картофельной гнили благодаря встраиванию генов диких видов картофеля из Анд, устойчивых к этому заболеванию. Такой картофель сейчас создается в Бельгии (VIB’s fact series, 2015). Важно, что цисгенезис не привносит в организм растения принципиально новых для него признаков и, по сути, аналогичен традиционному скрещиванию с родственными дикими формами.
Интрагенезис можно считать продолжением концепции цисгенезиса, но в этом случае в ДНК растения встраивают его собственный ген, совмещенный с регуляторными участками других его генов. В ходе такой модификации искусственно создаются новые комбинации из уже имеющихся в растении участков ДНК (Holme, 2013). Подобное изменение регуляции активности генов позволяет усиливать полезные признаки (например, способность накапливать витамины в листьях) или, напротив, устранять или сводить к минимуму нежелательные.
Между тем при современном регулировании оборота ГМО-различия между трансгенными и цисгенными растениями не учитываются, хотя эти типы кардинально различаются. Из-за жестких рамок, установленных законодательством, получение и использование цисгенных растений серьезно затруднено, что может заблокировать или значительно отсрочить проведение дальнейших исследований по улучшению сортов сельскохозяйственных культур. Пока лишь в Канаде контроль за цисгенными растениями менее строг по сравнению с трансгенными (Schouten, 2006).
Соматический Франкенштейн
Интересно то, что в мощной законодательной «обороне» против ГМО оказались бреши, появившиеся благодаря ряду парадоксов и допущений, которые на руку смелым селекционерам. Один из примеров – соматическая гибридизация. Другими словами, формирование новых форм растений путем комбинирования ядерных и других (митохондриальных и пластидных) генов при культивировании и слиянии обычных соматических клеток, составляющих ткань растения и не принимающих участия в половом размножении. Этот тип гибридизации растений достаточно широко распространен, при этом на территории ЕС такие соматические гибриды не считаются ГМО. Соответственно их оборот не подвергается строгому контролю.
Что же это за волшебный способ селекции? На первом этапе клетки растений двух разных видов (как правило, культурного и дикорастущего) обрабатывают специальными агентами, разрушающими клеточную оболочку, чтобы получить протопласты. Далее химическим или механическим способом провоцируют слипание и слияние протопластов, которые в дальнейшем восстанавливают общую клеточную оболочку. В результате из двух и более «родительских» клеток образуется новый живой организм – регенерант, или соматический гибрид.
Судьба родительских геномов при этом может быть различной. Два ядра могут синхронно делиться без слияния, образуя двуядерные дочерние клетки. Если же они сольются во время митотического деления, то в итоге получатся устойчивые одноядерные дочерние клетки, несущие смешанный генетический материал. Что касается внеядерного генома, то он тоже может быть получен как от одного родителя, так и быть смешанным. С помощью соматической гибридизации можно получать самые разные гибриды, включая такие, создание которых в принципе невозможно половым путем: например, гибриды, несущие цитоплазматические гены не от материнского растения, а от обоих родителей; «цибриды», содержащие ядро от одного из родителей, а цитоплазму от другого, и др.

Использование соматических клеток при гибридизации позволяет успешно работать с отдаленными, обычно нескрещиваемыми видами и полностью стерильными растениями. Иными словами, этот метод используют, если возникает необходимость преодолеть несовместимость культурных и дикорастущих видов. Таким способом можно получать межклассовые гибридные клеточные колонии: рис + соя, ячмень + табак и даже табак + мышь (Makonkawkeyoon, 1995)! Правда, большинство таких регенерантов сами размножаться уже не способны, а иногда и вовсе представляют собой скорее скопление клеток, чем полноценный организм.
Интересно, что, хотя метод соматической гибридизации влечет за собой значительную «перетасовку» генов, а его результаты очень непредсказуемы, он, тем не менее, разрешен для использования в сельском хозяйстве, в отличие от методов направленного мутагенеза. Как говорила Алиса в Стране чудес, «чем дальше, тем страньше».
Что скрывается под прививкой
А теперь пришло время обратиться к методам, которые должны удовлетворить стандарты даже самых ярых приверженцев натуральных продуктов. Ведь методы эти используются уже очень давно, и они не встречают общественного или законодательного сопротивления. Но оказывается, что с точки зрения генетики эти методы вовсе не «безгрешны», а их комбинация с новейшими подходами открывает перспективы, о которых вы, возможно, и не подозревали.
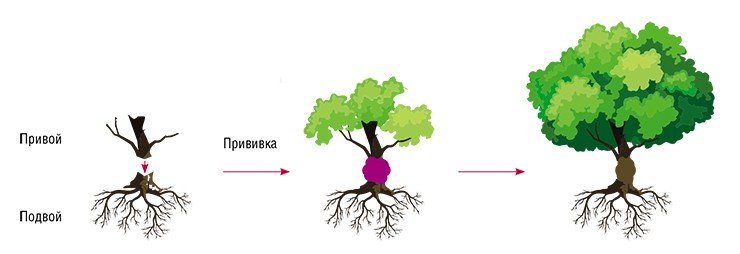
Например, давно известным способом размножения растений, с которым повсеместно сталкиваются садоводы-любители, является прививка. Суть ее в том, что стебель одного растения (привой) пересаживают на корень другого (подвой). В конце XIX в. этот метод помог спасти европейские сорта винограда Vitis vinifera от нашествия насекомого филлоксеры, повреждающего корни. Прививку осуществляли на североамериканский виноград Vitis labrusca, устойчивый к этому вредителю (Трошин, 1999). А в 2003 г. фермер из Орегона Р. Баур с помощью прививки получил настоящий «томак» (томат + табак), совсем как у Гомера из популярного американского мультсериала «Симпсоны». Пробы показали наличие в томаке никотина, правда, только в листьях, а не в плодах (Philipkoski, 2003).
Что же происходит с растением в результате прививки, если геномы подвоя и привоя не меняются? Во-первых, у подвоя могут увеличиваться или уменьшаться сила роста, размер плодов, сроки созревания. При этом новые признаки не передаются потомству в случае размножения семенами, так как не являются наследственными. Во-вторых, в результате использования прививки возможны «химерные» изменения, и в итоге привитое растение будет состоять из генетически разнородных клеток. Этот эффект также не наследуется. Его часто используют в декоративном цветоводстве и садоводстве для получения растений с мозаичной окраской листьев или соцветий.
В ходе прививки возможно и появление настоящих мутаций, спровоцированных специфическими веществами (этилметансульфонатом, этилимином и др.), которые поступают к привою от подвоя. Однако частота появления мутаций после прививок крайне низка. Неоспоримым преимуществом прививок является возможность размножать мутации, не передающиеся по наследству, а основным недостатком – большой объем исходного материала.
Прививка растений – это, безусловно, метод проверенный и безопасный. Но что произойдет, если в качестве подвоя использовать растение, перенесшее генетическую модификацию? Будет ли полученное растение ГМО? Оказывается, нет: согласно законам плоды таких гибридов не входят в перечень ГМО, так как ДНК привоя остается неизмененной. Однако мы не можем быть уверены в том, что никакого обмена наследственной информацией между привоем и подвоем не происходит. К примеру, от корневища к привою могут перейти молекулы РНК, регулирующие работу генома, а это означает, что нельзя предсказать и уровень производства тех или иных белков в привитом растении.
Берем генетический разбег!
Но прививка – это далеко не единственный окольный путь для создания новых сортов с измененной активностью ДНК. Ускоренное скрещивание деревьев и кустарников (fast-track breeding) – это даже не метод, а целый комплекс методик, направленных на сокращение сроков получения новых сортов, что особенно важно для многолетних культур. Ведь цикл размножения деревьев с крупными плодами (например, ореха или сливы) может доходить до 10 лет и более (van Nocker, 2014). Это означает, что после посадки первого гибрида селекционер вынужден ждать 5—10 лет, пока тот вырастет и повзрослеет, чтобы продолжить работу. Если же необходимо провести несколько последовательных скрещиваний, выведение нового сорта дерева может занять и 30 лет. В современных условиях никто не готов столько ждать.

Чтобы максимально ускорить процесс, ученые давно поливают своих подопытных гормонами роста, выращивают их при высоких температурах и прибегают к другим уловкам, таким как ДНК-технологии. Среди безобидных можно отметить маркер-вспомогательный отбор, который заключается в анализе генома новых ростков или даже семян и отборе лучших гибридов задолго до того, как они превратятся во взрослые растения. Теперь растение уже не нужно обрабатывать патогеном, чтобы понять, насколько оно к нему устойчиво, достаточно найти нужный ген в семечке. Основной недостаток такой селекции – ее высокая стоимость, поскольку скрининг ДНК – вещь недешевая.
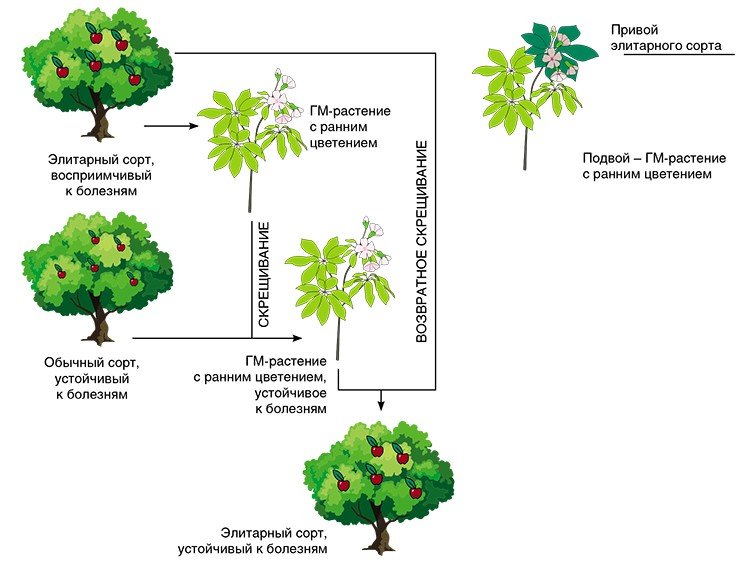
 Чтобы растение быстрее повзрослело, селекционеры иногда хитрят. Например, искусственно активируют гены, отвечающие за запуск механизма размножения, после чего начинает цвести и приносить плоды совсем молодое растение. Иногда в геном дерева вводят дополнительные гены, которые ускоряют процессы цветения и плодоношения, и время ожидания первого цветения саженцев сокращается до 1 года. При сочетании методик ускоренного и возвратного (когда гибрид скрещивают с одним из родителей) скрещиваний ген быстрого цветения можно сначала ввести в исходный сорт, а на последнем этапе селекции удалить его путем скрещивания генетически измененного гибрида с родительским растением.
Чтобы растение быстрее повзрослело, селекционеры иногда хитрят. Например, искусственно активируют гены, отвечающие за запуск механизма размножения, после чего начинает цвести и приносить плоды совсем молодое растение. Иногда в геном дерева вводят дополнительные гены, которые ускоряют процессы цветения и плодоношения, и время ожидания первого цветения саженцев сокращается до 1 года. При сочетании методик ускоренного и возвратного (когда гибрид скрещивают с одним из родителей) скрещиваний ген быстрого цветения можно сначала ввести в исходный сорт, а на последнем этапе селекции удалить его путем скрещивания генетически измененного гибрида с родительским растением.
Ускоренное скрещивание осуществляют также путем прививания на ГМ-подвой. Секрет в этом случае кроется в генетически измененном корневище, в котором активно работают гены, отвечающие за цветение. В результате из корневища к листьям поступают специфические белки, запускающие механизм взросления, и привой начинает цвести.
Таким образом, современные методы прививки и ускоренного скрещивания растений за внешней традиционностью таят в себе много настоящих генетических секретов. В то же время ученые, сталкиваясь с общественным мнением и жестким регулированием распространения ГМО, все чаще пытаются избежать внесения изменений непосредственно в растительную ДНК. И здесь мы вплотную подходим к самой загадочной группе современных методов селекции.
Эпигенетика: чуть-чуть не считается
Одними из самых молодых и суперсовременных альтернатив для селекционеров стали подходы эпигенетики – науки о наследуемых механизмах управления экспрессией генов (Marjori, 2015). Как работает наш генетический код, общеизвестно, но вот тонкости его надстройки (эпи- означает «над»), своего рода «дирижера», управляющего работой генома, во многом остаются загадкой.
Начало производства белков в клетке регулируется множеством факторов. У клетки также имеются приемы, заставляющие «замолчать» тот или иной ген, чтобы предотвратить производство уже ненужного белка: это и разрушение еще незрелых молекул РНК, считанных с генетической «матрицы», и создание «механических» препятствий для самого считывания ДНК (Marjori, 2014). В общем, эпигенетических сигналов в клетке очень много, они не до конца изучены, однако некоторые из них уже используются для селекции растений, которые попадают к нам на стол каждый день.

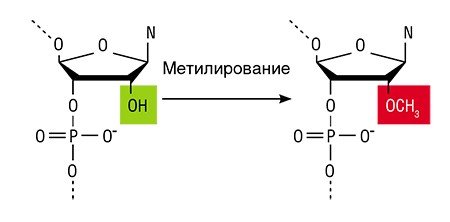
Подавить работу генов в клетке можно с помощью природного механизма – РНК-зависимого ДНК-метилирования, суть которого состоит в присоединении метильной группы (СН3) к нуклеотиду цитозину, стоящему в определенном положении. В результате блокируется процесс считывания информации с ДНК на молекулу РНК (Zhang, 2013).
Метилирование ДНК у растений и животных осуществляется ферментами ДНК-метилтрансферазами. Сами по себе эти ферменты метилировать ДНК не могут: им нужны специальные некодирующие РНК, которые направляют метилтрансферазы к конкретным участкам ДНК. Более того, считается, что в метилировании ДНК участвуют еще два вида РНК: малые интерферирующие РНК и микроРНК. Все вместе эти молекулы и определяют, какой именно участок ДНК цепи нужно метилировать. Сегодня такие РНК можно ввести в растение с помощью разных методик, например, посредством вирусов растений или с помощью техник генной инженерии (Deng, 2014).
Интересно, что если ученый изменяет признак растения с помощью ДНК-метилирования и при этом не вносит в геном никаких мутаций, то такое растение не считается ГМО. Если же некодирующие РНК не вводятся извне, а производятся самим растением благодаря геномному редактированию, то оно уже относится к генно-модифицированному.

Но и тут можно схитрить. Дело в том, что у растений метилирование определенных областей ДНК может наследоваться, т. е. передаваться от родителей к следующим поколениям (Jones, 2001). Благодаря ряду скрещиваний ГМ-растения с его природной формой можно получить гибрид, у которого нет измененной ДНК, но метилирование сохраняется. Такой гибрид уже не будет считаться генетически модифицированным.
Насколько метилирование безопасно? Достаточно, ведь метильные группы присоединяются к ДНК совсем не в случайных местах. Поэтому, в отличие от традиционных методов селекции, результаты такого воздействия предсказуемы: мы можем заранее выбрать ген, кодирующий определенный белок, и просто заставить его замолчать. Но делать это нужно аккуратно, так как механизмы метилирования ДНК довольно сложны. Иначе в результате мы можем получить растение, подверженное болезням или преждевременному старению.
Иногда ДНК-метилирование, наоборот, является обязательным условием для начала работы гена. Ученые и это научились использовать: с помощью изменения метилирования ДНК можно увеличить активность генов, отвечающих за производство растением запасных белков. Например, регулируя метилирование, можно повысить содержание белков в зерне пшеницы, а путем обработки риса ингибитором метилирования (5-азацитидином) – получить растения с наследуемым признаком карликовости (Ванюшин, 2013).
Молчание РНК как заслон от аллергии
Успешное считывание гена на матричную РНК вовсе не означает, что кодируемый им белок будет построен: эта мРНК может быть разрушена в цитоплазме клетки. Такое явление, названное посттранскрипционным молчанием, часто наблюдается при внесении дополнительных генов в ДНК растений. Впервые оно было описано еще в 1990 г., когда при введении в геном петунии дополнительных копий гена, отвечающего за красную окраску цветков, количество красного пигмента не только не возросло, но и значительно снизилось (Napoli et al., 1990).
Механизм «замолкания РНК» снижает эффективность работы генных инженеров. С другой стороны, его можно использовать для создания растений, устойчивых к растительным вирусам, так как он может способствовать разрушению не только их собственных матричных РНК, но и соответствующих РНК вирусов, которым удалось проникнуть в клетки растений.

Судя по всему, механизмов посттранскрипционного молчания существует несколько, и ученые пока не вполне понимают, как они работают и как связаны между собой, белые пятна в этой области только начинают заполняться (Плотников, 2007). Есть предположение, что отдельные молекулы мРНК активно деградируют при достижении определенного порога своей численности (Abler, 1996). Другая теория основана на изменениях в регуляции работы генома, связанных с метилированием ДНК, в результате чего среди нормальных РНК синтезируется некоторое количество «ненормальных», которые и запускают распад мРНК в цитоплазме (Hoofvan, 1997).
Одним из хорошо описанных механизмов посттранскрипционного молчания является РНК-интерференция. Этот метод базируется на способности молекул двухцепочечных РНК эффективно подавлять активность сходных с ними по строению генов. В последние годы РНК-интерференцию используют в прикладных исследованиях, направленных на получение нокаутных (содержащих «молчащие» гены) клеток, тканей и организмов. Ведь если грамотно использовать этот механизм, то теоретически можно «выключить» в клетке производство любого белка.
Среди успешных примеров применения этого метода – получение двух сортов кофейного дерева, содержащих в плодах пониженный на 30—50 % алкалоид кофеина. Схожий эксперимент был проведен и с табаком с целью понизить в растении содержание никотина (Рябушкина, 2009).
Другая возможность использования этого подхода – подавление синтеза аллергенов. И это уже не сказка: генетикам из испанского Института сельского хозяйства в Кордове почти полностью удалось освободить зерна пшеницы от глиадина – одного из составляющих глютена. Именно из-за глиадина группа запасающих белков пшеницы вызывает у многих людей иммунную реакцию. Правда, и без использования системы редактирования генома CRISPR/Cas9 тут не обошлось (Sanchez-Leon et al., 2017).

Конечно, в этом направлении ученым еще работать и работать, но уже есть надежда, что совсем скоро можно будет смело есть арахисовое масло без боязни умереть от анафилактического шока! Важно отметить, что подобное вмешательство генной инженерии в метаболизм растений отличается от традиционного: в геном не встраивается чужеродный ген, а значит, не происходит и синтеза чужеродного белка. Из-за этого РНК-интерференцию можно назвать генным вмешательством со сниженным экологическим риском. Более того, даже формально такое вмешательство не несет на себе печати «ГМО».
Каков же итог нашей экскурсии по современным методам селекции? Шанс сделать выбор в пользу «натуральных» злаков, овощей и фруктов мы давно упустили. Прогресс, в том числе и в создании новых видов растений, остановить невозможно, но осознавать и правильно оценивать риски распространения и употребления генетически модифицированных продуктов необходимо.
Сегодня, когда общество проявляет большую озабоченность безопасностью пищевых продуктов, селекционеры находятся в ситуации, вынуждающей их использовать альтернативные пути получения новых сортов растений. В силу тех или иных причин эти методы не относятся к запрещенным, но в ряде случаев являются не менее рискованными, чем традиционные методики получения ГМО.
Также не стоит забывать, что грамотный подход к селекции растений с использованием техник редактирования генома позволяет минимизировать использование пестицидов и удобрений – что это означает для экологии, нет нужды объяснять. В любом случае, какие продукты мы будем есть завтра, в огромной степени зависит уже не от природы, а от нас самих.
Литература
Закиян С. М., Власов В. В., Медведев С. П. «Редакторы геномов»: от «цинковых пальцев» до CRISPR // НАУКА из первых рук. 2014. Т. 56. № 2. С. 44—53.
Шумный В. К. Природа была первым генным инженером // НАУКА из первых рук. 2004. Т. 2. № 3. С. 32—39.
Cong L., Ran F. A., Cox D. et al. Multiplex Genome Engineering Using CRISPR/Cas Systems // Science. 2013. V. 339. P. 819—823.
From plant to crop: the past, present and future of plant breeding. 2016. VIB’s fact series, 44 p.
Philp J. C., Ritchie R. J., Allan J. E. Synthetic biology, the bioeconomy, and a societal quandary // Trends in Biotechnology. 2013. V. 31. P. 269—272.
Moghaddassi S., Eyestone W., Bishop C. E. TALEN-Mediated Modification of the Bovine Genome for Large-Scale Production of Human Serum Albumin. 2014, PLoS ONE. 9, e89631.
Matzke M. A., Kanno T., Matzke A. J. M. RNA-Directed DNA Methylation: The Evolution of a Complex Epigenetic Pathway in Flowering Plants // Annu. Rev. Plant Biol. 2015. V. 66. P. 243—267.
Публикация подготовлена на основе статьи, которая участвовала в научно-популярном конкурсе «био/мол/текст»-2017 портала «Биомолекула» (biomolecula.ru)