Родиться баобабом
Зависть, возможно, это наимощнейший фактор биологической и социальной эволюции человека. Присядет он в тени, к примеру, баобаба и думу думает: «Когда наше племя пришло сюда, этот старый баобаб стоял, под ним сидел мой прапрадед, и прадед сидел, и дед, и отец. Вот теперь сижу я, и сын будет сидеть, и внук, и правнук. Потом все умрут, или племя уйдет, а дерево все будет жить? Обидно, да!». Завистливый интерес человечества к видам долгоживущим совершенно понятен: вдруг удастся узнать нечто, что позволит и нам жить дольше, как тот же баобаб. Именно поэтому большое внимание ученых привлекает огромное количество природных моделей как замедленного, так и ускоренного старения. И, как при изучении многих других биологических феноменов, чем дальше эти «модели» отстоят от привычных лабораторных животных, тем более удивительные способы решения проблемы старения они используют
Чаще всего термин старение применяется для многоклеточных организмов. Считается, что большинство одноклеточных потенциально бессмертны, так как при размножении они делятся симметрично на два организма, идентичных родительскому. Однако в последнее время даже у некоторых бактерий были открыты процессы неравного деления. Так, обитатель пресноводных водоемов бактерия Caulobacter crescentus делится асимметрично, формируя одну крупную клетку, прикрепленную к субстрату, и мелкую, свободно плавающую в среде. Со временем первая «материнская» клетка замедляет процесс деления, выказывая признаки старения (Ackermann et al., 2003).
При размножении у пекарских дрожжей от крупной материнской клетки отпочковываются мелкие дочерние, причем сама материнская клетка, претерпев определенное число делений, погибает. Признаками старения дрожжевой клетки служат увеличение размера, потеря тургора (внутриклеточного давления), удлинение клеточного цикла, ослабление синтеза белка, накопление внехромосомной ДНК и др. (Clay and Barral, 2013). Интересно, что материнские клетки избирательно отдают своим «дочерям» более эффективные митохондрии (органеллы, ответственные за производство энергии в клетке).
У другого вида дрожжей – пивных – клетки делятся симметрично и потенциально бессмертны, но лишь в благоприятных условиях. При тепловом или окислительном стрессе в одну из дочерних клеток собираются все крупные нефункциональные агрегаты белков – такая клетка в последующем погибает (Coelho et al., 2013). Так что даже одноклеточные организмы могут служить важными природными моделями для исследования процессов старения.
У многоклеточных также есть потенциально бессмертные клетки – половые, а вот соматические клетки запрограммированы на смерть. Одной из важных черт старения у этих организмов является постепенная утрата стволовых клеток, которые способны к самообновлению и в ходе дифференцировки могут превращаться во все другие виды соматических клеток. Поэтому утрата стволовых клеток очень замедляет или делает невозможным обновление различных тканей.
Как стареет клетка
В настоящее время исследователи все больше задаются вопросом, как происходит старение на уровне одной клетки. Рассмотрим несколько важнейших механизмов, вовлеченных в этот процесс.
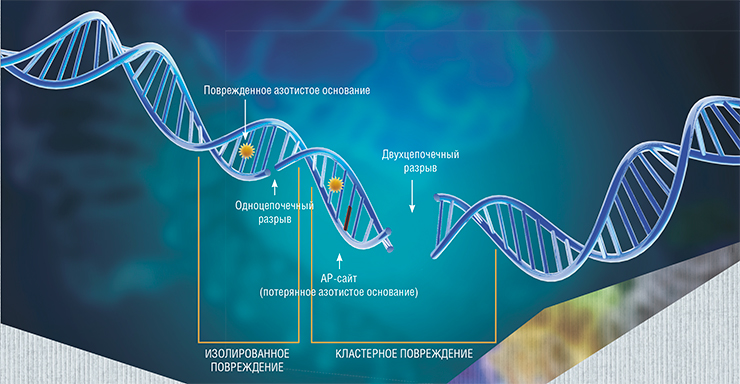
Во-первых, это нарушения первичной структуры и эпигенетического (не затрагивающего структуру) статуса геномной ДНК. Огромное количество как внешних, так и внутренних факторов влияют на геном, вызывая множество мутаций ДНК: точечные замены отдельных нуклеотидов, двухцепочечные разрывы, хромосомные перестройки (например, инверсии – поворот участка хромосомы на 180°), укорочение концевых (теломерных) районов хромосом и т. д.
Системы репарации (ремонта ДНК) позволяют успешно справляться со многими такими нарушениями – от надежности их работы зависит способность организма противостоять естественным повреждениям генома. Ослабление систем репарации неизменно ведет к сокращению продолжительности жизни. Особенно чувствительна к мутагенным процессам ДНК митохондрий, так как процессы репарации в этих клеточных органеллах ослаблены, к тому же для них характерны высокие концентрации активных форм кислорода и других опасных метаболитов.
В последнее время довольно большая роль в клеточном старении отводится таким эпигенетическим процессам, как модификация гистонов – обширного класса белков клеточного ядра, участвующих, в том числе, в упаковке нитей ДНК, а также метилирование (присоединение метильной группы (–CH3) без изменения нуклеотидной последовательности) ДНК (Han and Brunet, 2012).
Вторым важным механизмом старения является накопление белков с неправильной структурой. Агрегация неправильно свернутых белков с образованием амилоидов связана с развитием возрастных прогрессирующих нейродегенеративных расстройств, таких как болезни Альцгеймера и Паркинсона.
В-третьих, при клеточном старении изменяются сигнальные пути – молекулярные механизмы, обеспечивающие передачу сигналов внутри клетки. Например, так называемого каскада инсулина / инсулиноподобного фактора роста, который влияет на множество клеточных процессов, таких как энергетический обмен, ответ на стресс и др. Этот путь вовлечен в процессы клеточного старения у широкого круга организмов, включая кишечнополостных, круглых червей, насекомых и млекопитающих.
Что касается окислительного стресса, который, как показано в ряде работ, вносит значительный вклад в процессы старения, то здесь ситуация неоднозначна. Имеются экспериментальные данные, что небольшие «порции» окислительного стресса, получаемые в результате физических упражнений или импульсного голодания, напротив, тренируют антиоксидантные защитные механизмы. И, соответственно, ведут к увеличению продолжительности жизни.
Многоклеточные «кощеи»
Все многоклеточные организмы относятся к так называемым эукариотам – организмам с оформленным клеточным ядром. И даже среди этих высших организмов мы сталкиваемся с феноменом полного потенциального бессмертия, характерного для прокариотов (бактерий и архей).
Такие «кощеи бессмертные» встречаются у некоторых типов беспозвоночных животных, лишенных билатеральной симметрии. Например, у гидроидных полипов/медуз из рода Turritopsis. Представители вида Turritopsis dohrnii считаются бессмертными, потому что не проявляют признаков старения, связанных с возрастом. На «юношеской» стадии они представляют собой неподвижную форму – полип, а на следующей стадии полового размножения – свободно плавающую медузу. Самое удивительное, что после размножения эти организмы не умирают, а превращаются обратно в незрелых полипов. И такой цикл может повторяться многократно.

У этих многоклеточных животных всегда имеются стволовые клетки, способные дифференцироваться в клетки различных тканей и участвовать в регенерации любых органов. Вероятно, именно это и дает им бессмертие. Однако в процессе эволюции у более сложноорганизованных форм эта способность была утрачена, что, скорей всего, было связано с необходимостью бороться со злокачественным перерождением клеток в раковые.
При этом между сложностью организации и продолжительностью жизни прямых связей не обнаруживается. Так, если губки, одни из наиболее примитивных многоклеточных животных, живут до 15 тыс. лет, а киты, относящиеся к млекопитающим, лишь до 200 лет, то не слишком сложно устроенный круглый червь Caenorhabditis elegans вообще не имеет стволовых клеток и живет всего пару недель.

Вообще среди многоклеточных организмов встречаются самые разные, порой причудливые варианты. Например, членистоногие, самая многочисленная группа животных, со всеми их метаморфозами, личинками, куколками, гусеницами и имаго. Там много всего и разного, в том числе и в продолжительности жизни на каждой стадии развития. Или растения с их особой биологией. Именно деревья, многие из которых живут сотни и тысячи лет, дали название нашей статье в перефразе известной песни Владимира Высоцкого.
Но сегодня речь пойдет не о них. Ниже мы рассмотрим некоторые примеры из многообразия продолжительности жизни у позвоночных животных, к которым относится человек. Многие из этих видов уже стали или могут стать живыми «моделями» для детального изучения феномена старения, полезными применительно к долгожительству у нас с вами.
Коротко- и долгожители
Среди позвоночных особым долгожительством отличаются рыбы. Чемпион среди них – гренландская полярная акула, суперхищник, который может дожить до 400 лет. Да и половозрелости представители этого вида достигают лишь к возрасту 150 лет. До 150 и более лет доживают приполярные морские окуни. Интересно, что все эти рыбы – живородящие. Сравнительно долго живут и многие другие виды акул, а также осетровые и сомы (50—150 лет). В то же время среди рыб есть виды, живущие лишь несколько месяцев, например, представители семейства нотобранхиевых и бычки.

Несколько лет назад было обнаружено, что у слонов имеется несколько десятков копий гена, кодирующего белок p53 (у человека их всего две). Этот белок не дает делиться клеткам с «неотремонтированными» повреждениями ДНК, запускает процесс клеточного самоубийства (апоптоза). Оказалось, что в ответ на повреждения ДНК, вызванные ионизирующей радиацией, процесс апоптоза у слонов действительно идет более интенсивно, чем у человека.
Недавно при анализе геномов 53 видов млекопитающих ученые обратили внимание еще на один ген – LIF, кодирующий белковый фактор, ингибирующий развитие лейкемии (Abegglen, Caulin, Chan et al., 2015). Выяснилось, что, хотя у подавляющего большинства исследованных организмов имеется только одна пара этих генов, в геноме африканского слона, американского ламантина и капского дамана число дополнительных копий этого гена достигает десятка.
Накопление копий того или иного гена – широко распространенное явление. Такие копии часто несут ошибки и нефункциональны, поэтому их называют псевдогенами, или даже «мертвыми генами». Однако у предков слонов один из этих псевдогенов каким-то образом «ожил», за что и получил прозвище гена-«зомби».
В нормальных условиях ген LIF6 практически не работает, но белок p53 активирует его, когда «принимает решение» убить клетку. Белок, кодируемый LIF6, вызывает нарушения работы митохондрий – клеточных «энергостанций», тем самым запуская процесс апоптоза, правда, по не до конца понятному механизму. Таким образом, белок LIF6 совместно с p53 уничтожают потенциально раковые клетки слонов задолго до того, как они начинают представлять собой реальную опасность.
Похоже, что ген-«зомби» LIF6 вновь заработал у предков современных слонов примерно 25–30 млн лет назад, когда размеры этих животных были не так велики. Не исключено, что именно формирование этого нового, дополнительного метода защиты от рака стало ключевым элементом, позволившим слонам стать самыми крупными сухопутными и к тому же долгоживущими млекопитающими
Среди амфибий дольше всех (более 100 лет) живет протей – слепое хвостатое существо, обитающее лишь в холодных озерах и реках пещер на Балканах. Долгожителями среди рептилий являются черепахи (галапагосская черепаха достигает возраста 170 лет), крокодилы, продолжительность жизни которых более полувека, и комодский варан.
Относительно долго живет и большая часть видов птиц. Рекордсмены среди них – обитатель Австралии какаду инка, живущий более 80 лет, а также андский кондор (79 лет).

Среди уникального отряда яйцекладущих млекопитающих обращает на себя внимание ехидна, которая живет полвека – вдвое дольше утконосов. У сумчатых рекордсмены по долгожительству – вомбат и гигантский кенгуру, которые живут по 25—30 лет.
Среди афротерий – особого надотряда плацентарных млекопитающих, независимо сформировавшихся в Афро-Аравии, дольше всех живут виды, приспособившиеся к водному образу жизни (ламантины и дюгони), а также слоны, доживающие до 65 лет (к тому же число врагов у этих животных, в силу их размеров, также ограничено). Обращает на себя внимание и такая особенность слонов и сирен, как постоянная смена зубов на новые, т. е. сохранение высокой потенции клеток соответствующих тканей.
В эту группу входят также тенреки, небольшие, похожие на ежей животные, большинство которых изолированно обитают на Мадагаскаре еще с мелового периода. Было бы крайне интересно сравнить геномы, особенности клеточной дифференцировки и другие характеристики у этих видов, так как продолжительность жизни у них различается в шесть раз.

Среди неполнозубых достаточно долго живут ленивцы – более 40 лет. Большую часть жизни они проводят на деревьях, почти не двигаясь, а в случае надобности передвигаются со скоростью 1–3 м в минуту. Мозг у них без извилин, а пищеварительная система и мочевой пузырь устроены так, что потребность в удовлетворении естественных надобностей возникает лишь раз в неделю. Даже оцелоты и орлы-гарпии, способные добыть ленивцев на деревьях, нападают на них достаточно редко. Не жизнь, а именины сердца, мечта Диогена. А вот жизнь более активных наземных неполнозубых, муравьедов и броненосцев, почти вдвое короче.
Относительно недавно выяснилось, что киты суть парнокопытные животные, поменявшие опасную жизнь на суше на более комфортное и, следовательно, более долгое существование в морях и океанах. Именно среди китообразных мы отмечаем такой вид, как гренландский кит – рекордсмен по долгожительству среди млекопитающих (Moskalev et al., 2017).
ХОЧЕШЬ ЖИТЬ ДОЛГО? РЕМОНТИРУЙ СВОЮ ДНК Факт первый, пессимистичный: в клетках нашего тела постоянно возникает множество повреждений ДНК – наследственного материала, который управляет сложнейшими процессами жизнедеятельности. Факт второй, оптимистичный: свое самое сокровенное клетки умеют защищать с помощью специальных систем репарации («ремонта») ДНК. Но с возрастом их эффективность снижается, что приводит к накоплению в клетках геномных перестроек и других патологических изменений.Ученые давно предположили, что репарация ДНК играет важную роль в процессах, обеспечивающих долголетие организма. Известно, что мутации в генах, кодирующих ферменты репарации, вызывают ускоренное старение не только у лабораторных животных, но и у людей. А у долгоживущих животных обнаружена более высокая устойчивость к генотоксическому стрессу. Однако требуется получить прямые доказательства связи эффективности репарации ДНК и продолжительности жизни, а также разобраться в молекулярных механизмах, которые эту связь опосредуют.
Дело это непростое, так как в работе систем репарации участвует много белков: как тех, что непосредственно осуществляют «ремонт», так и косвенно участвующих в этом процессе. При этом попытки повысить эффективность репарации, усиливая активность соответствующих ферментов, оказались в основном неудачными. Единственным исключением стал ген SIRT6, кодирующий белок сиртуин‑6: увеличение активности этого гена повышало эффективность репарации двухцепочечных разрывов ДНК, не вызывая негативных побочных эффектов. Ген SIRT6 еще часто называют «геном долголетия», потому что лабораторные мыши с «выключенным» SIRT6 живут меньше, а со сверхактивным – дольше, чем обычные особи.
Недавно ученые проанализировали эффективность работы систем репарации у 18 видов грызунов (Tian, Firsanov, Zhang, 2019). Эта группа млекопитающих служит удобной моделью для проведения сравнительных исследований процессов старения, так как при большой эволюционной близости грызуны отличаются чрезвычайным разнообразием продолжительности жизни: от 3 (мыши) до 32 лет (голые землекопы и бобры). Исследователи уделили внимание не только репарации двухцепочечных разрывов ДНК, но и эксцизионной репарации нуклеотидов, с помощью которой удаляются объемные повреждения, искажающие структуру двойной спирали ДНК.
Выяснилось, что эффективность работы эксцизионной репарации не связана явным образом с продолжительностью жизни. Но эти данные нельзя считать окончательными, так как исследователи сравнивали виды, ведущие разный образ жизни. А основная причина объемных повреждений ДНК – солнечный ультрафиолет, поэтому на вектор отбора мог повлиять ночной или дневной характер активности животных.
Что касается репарации двухцепочечных разрывов ДНК, то они влекут за собой такие серьезнейшие последствия, как остановка клеточного деления и даже гибель клетки. Если разрывы неправильно отремонтировать, могут произойти перестройки не только последовательности отдельных генов, но и самой структуры хроматина, основы хромосом. Итог – глобальные нарушения работы генов и, как следствие, дисфункция тканей и органов, что несовместимо с долгой жизнью.
Ученые выяснили, что белок сиртуин‑6, участвующий в репарации двухцепочечных разрывов ДНК, действительно работает более эффективно у долгоживущих грызунов. Проанализировав структуру этого белка у мыши и бобра, они определили, что разница обеспечивается всего пятью звеньями-аминокислотами!
С помощью методов генной инженерии исследователи вставили в клетки человека с «выключенным» геном SIRT6 соответствующие гены бобра или мыши и получили ожидаемый эффект: клетки с «бобровым» геном эффективнее боролись с повреждением ДНК по сравнению с клетками, содержавшими «мышиный» SIRT6. А на плодовых мушках (дрозофилах), любимом экспериментальном объекте генетиков, ученые доказали, что «бобровый» ген не только лучше справляется с повреждениями ДНК в культуре клеток, но и увеличивает продолжительность жизни целостного организма. В дальнейшем ученые планируют изучить SIRT6 у видов, которые живут дольше человека, таких как гренландский кит
Долго живут и бегемоты, ближайшие условно наземные родственники китов. Следует отметить, что они самые опасные для человека звери Африки. Именно при столкновении с бегемотами погибает гораздо больше людей, чем от зубов и когтей других видов. Недавно было обнаружено, что они способны полакомиться свежей (и тухлой) крокодилятиной, антилопятиной и львятиной. А уж потом мирно щипать травку по берегам болот и рек. Губами, так как зубы используют исключительно для кровавых драк и нападения на других животных.
Довольно долго живут непарнокопытные – лошади, носороги и тапиры, и лошадь, достигающая возраста под 60 лет, среди них лидирует.

Среди хищников долго живут ластоногие, сменившие опасную жизнь на суше на более комфортную в морях и океанах. А среди ластоногих дольше всех живет байкальская нерпа, сумевшая далеко уйти не только от наземных, но и морских хищников. Долго живут медведи, ну да и кто сможет возразить белому медведю в его желании пожить до сорока с хвостиком? Кошачьи в целом живут дольше собачьих.
Летучие мыши – группа, резко сменившая среду обитания и сказавшая «до свидания» всем наземным агрессорам. Рекордсмен по долгожительству – сибирская ночница Брандта, летучее существо весом меньше 10 г, которое может жить 40 лет. Но и большинство других видов рукокрылых живут много дольше, чем их насекомоядные предки и родственники.
А вот жизнь истинных насекомоядных насыщена (круглосуточный секс и еда), но очень коротка. В три раза дольше землероек (до 12 лет) жили ядовитые кубинский и гаитянский щелезубы, пока на острова их обитания не завезли кошек, собак и мангустов, истребивших этих животных практически полностью. Почти столько же могут прожить и ежи, к тому же имеющие хорошо известную естественную и эффективную защиту от нападений хищников.
Среди зайцеобразных вдвое дольше (аж до 18 лет!) по сравнению с пищухами и кроликами живут именно зайцы, в частности, заяц-беляк.
СЕКРЕТ ДОЛГОЛЕТИЯ РУКОКРЫЛЫХ? Среди изученных на сегодняшний день рукокрылых особенным долголетием отличаются представители рода ночниц, или короткоухих летучих мышей. Эти небольшие (весом от 2 до 45 г) животные живут более 20–30 лет.Большой научный коллектив более 60 лет занимался изучением четырех видов таких рукокрылых долгожителей, взяв пробы тканей от почти полутысячи меченых особей (Foley, Hughes, Huang et al., 2019). Исследователей особенно интересовала длина теломер – защитных структур на концах хромосом. В клетках человека и большинства млекопитающих теломеры уменьшаются с каждым клеточным делением. Когда они становятся достаточно короткими, клетка стареет и умирает. Исключение – стволовые и раковые клетки, в которых фермент теломераза постоянно наращивает укорачивающиеся теломерные участки ДНК. В нормальных же клетках теломераза неактивна.
Оказалось, что у длинноухой и, особенно, большой ночницы теломеры с возрастом не уменьшаются, а теломераза никак не участвует в поддержании их длины. Укорочение теломер принято рассматривать как один из механизмов защиты от злокачественного перерождения клеток, однако представители этих видов редко болеют раком.
Чтобы выяснить механизм поддержания длины теломер у летучих мышей, ученые провели сравнительный анализ генома большой ночницы и полусотни других млекопитающих, а также уровня активации более двухсот генов, связанных с функционированием теломер. Оказалось, что своими длинными теломерами малая ночница обязана работе двух десятков генов. Среди них – ген SETX, кодирующий фермент хеликазу, разделяющую цепи двойной спирали ДНК. А также ген ATM, который кодирует протеинкиназу: при двунитчатых разрывах ДНК этот фермент активирует белки, участвующие в остановке клеточного цикла и запуске репарации ДНК или апоптоза.
Кстати, у человека дефекты этих двух генов ведут к развитию атаксий – нейродегенеративных заболеваний, механизм развития которых связан с ускоренным укорочением теломер. Поэтому вполне вероятно, что кодируемые ими белки действительно способствуют сохранению стабильности теломер у долгоживущих летучих мышей
Рекордсмен среди грызунов – голый землекоп, со всеми его уникальными и многократно описанными особенностями активации множества генов, систем репарации и т. д. Однако следует помнить и то, что землекопы имеют особую форму «социальной защиты» своих колоний, с кастовым подразделением особей. Жизнь многих «колонистов» может быть короткой, окончившись в желудке змей, что, однако, дает другим особям возможность жить экстремально долго – свыше 30 лет, что является рекордом для мелких грызунов. Было бы крайне интересным в каждом исследовании особенностей организации и функционирования геномов и клеток голого землекопа сравнивать этот вид не только с мышью, но и с животными, гораздо более ему близкими. Например, с пескороями, жизнь которых существенно короче (около 11–15 лет).
Долго живут дикобразы с их колючками, белки, забравшиеся на деревья, и бобры, освоившие водную среду. И очень мало (2–4 года) живут виды самой многочисленной группы среди млекопитающих – мышевидных грызунов.
Как же обстоят дела с нами? Тупайи, близкие к древнейшим предкам приматов, и полуобезьяны живут заметно меньше, чем настоящие обезьяны. Максимальный возраст последних – около 40 лет. Человекообразные обезьяны, включая гиббонов, живут уже достаточно долго, около 60 лет. Очевидно, это и есть максимальный биологический возрастной ресурс для человека, при этом по последним оценкам средняя продолжительность жизни для нашего вида близка к 38 годам (Mayne et al., 2019). Последующие 60 лет нашей жизни, до достижения максимального зафиксированного возраста в 120 лет, очевидно, имеют «надбиологический» характер и опосредуются изменениями социальной структуры общества, достижениями медицины и т. д.

1900 г. человек уничтожил более 40 % видов амфибий, треть видов «бессмертных» кораллов, более трети видов морских млекопитающих. Только начиная с XVI в. мы стали причиной исчезновения 680 видов позвоночных, в том числе 10 % одомашненных пород млекопитающих, используемых ранее для производства продовольствия. Как минимум тысяча пород животных находится сейчас под угрозой исчезновения.
Таким образом, сведя число естественных врагов практически к нулю, человек приобрел одного нового могучего врага в лице самого себя. Похоже, пришло время договариваться, в том числе и о том, есть ли хоть какой-то смысл в увеличении нашей собственной «продолжительности жизни» сверх отпущенной нам природой
Является ли последнее благом, вопрос очень спорный. Природа поставила могучие барьеры для бесполезного, с биологической точки зрения, долгожительства. Прежде всего это онкология. Этот барьер существенно ограничивает и любые попытки «омоложения» и «улучшения» генома. Встроил стволовые клетки туда, где свои ткани исчерпали свой потенциал, либо отредактировал работу каких-либо генов – природа ответит тебе ростом раковых заболеваний. Не лезь в работающий механизм с кувалдой, не ломай то, что не ты построил.
Но и ограничивать человеческое любопытство и жажду деятельности бессмысленно. Мы не такие. Медузы – бессмертные, говорите? А что если затопить в месте их обитания баржу с хлором, а на поверхности разлить сырую нефть?
 Но пока человечество оставило его ученой биологической части объекты для исследования и сравнения, напрашиваются следующие выводы, по крайней мере для позвоночных животных. Долгожительство суть попытки определенных видов и групп резко уменьшить число своих врагов. С этой целью сухопутные предки китов, сирен и ластоногих отправились жить в океан; птицы и летучие мыши поднялись в воздух. Многие виды сами стали суперопасными существами (акулы, медведи, бегемоты) или резко увеличили свои размеры (например, слон), либо залезли на деревья, как приматы и белки. Или скрылись в недоступных пещерах и норах, как протей и голый землекоп, либо вообще «притворились ветошью», как ленивец. Отсюда понятно, что увеличение продолжительности жизни – одна из стратегий выживания видов. Но, очевидно, не лучшая.
Но пока человечество оставило его ученой биологической части объекты для исследования и сравнения, напрашиваются следующие выводы, по крайней мере для позвоночных животных. Долгожительство суть попытки определенных видов и групп резко уменьшить число своих врагов. С этой целью сухопутные предки китов, сирен и ластоногих отправились жить в океан; птицы и летучие мыши поднялись в воздух. Многие виды сами стали суперопасными существами (акулы, медведи, бегемоты) или резко увеличили свои размеры (например, слон), либо залезли на деревья, как приматы и белки. Или скрылись в недоступных пещерах и норах, как протей и голый землекоп, либо вообще «притворились ветошью», как ленивец. Отсюда понятно, что увеличение продолжительности жизни – одна из стратегий выживания видов. Но, очевидно, не лучшая.
Самая многочисленная группа среди млекопитающих, по сути «завоевавшая мир», это мышевидные грызуны, жизнь которых весьма коротка. Для того чтобы понять суть эволюционного успеха, достаточно сравнить количество и распространенность домовой мыши, уязвимой, подверженной всем возможным типам рака, очень недолго живущей, и распространенность и количество живущих особей у голого землекопа. Человек – единственный вид среди позвоночных, пытающийся реализовать обе стратегии выживания: быть одновременно и многочисленной мышью, и малочисленным «бессмертным» землекопом.
Литература
Ackermann M., Stearns S. C., Jenal U. Senescence in a bacterium with asymmetric division // Science. 2003. V. 300. N. 5627. P. 1920.
Clay L. and Barral Y. New approaches to an age-old problem // Curr. Opin. Biotechnol. 2013. V. 24. P. 784–789.
Coelho M., Dereli A., Haese A. et al. Fission yeast does not age under favorable conditions, but does so after stress // Curr. Biol. 2013. V. 23(19). P. 1844–1852.
Evdokimov A. N., Kutuzov M. M., Petruseva I. O. et al. Naked mole rat cells display more efficient excision repair than mouse cells // Aging-US. 2018. V. 10. N. 6. P. 1454–1473.
Han S., Brunet A. Histone methylation makes its mark on longevity // Trends Cell Biol. 2012. V. 22(1). P. 42–49.
Lewin H. A., Robinson G. E., Kress W. J. et al. Earth BioGenome Project: Sequencing life for the future of life // PNAS. 2018. V. 115. P. 4325–4333.
Lind A., Lai Y. Y., Mostovoy Y. et al. A high-resolution, chromosome-assigned Komodo dragon genome reveals adaptations in the cardiovascular, muscular, and chemosensory systems of monitor lizards // Nat. Ecol. Evol. 2019. V. 3(8). P. 1241–1252.
Moskalev A. А., Kudryavtseva A. V., Graphodatsky A. S. et al. De novo assembling and primary analysis of genome and transcriptome of gray whale Eschrichtiusrobustus //BMC Evol. Biol. 2017. V. 17(258). DOI: 10.1186/s12862-017-1103-z.













