В помощь структурному биологу
Рентгеноструктурный анализ прочно вошел в жизнь биологов с середины прошлого века. Именно тогда Дж. Кендрю из знаменитой лаборатории молекулярной биологии в Кембридже удалось после многолетней работы впервые установить структуру белка, которым стал миоглобин кашалота, который помогает киту запасать в мышцах кислород при нырянии. А его коллега М. Перуц, с которым Кендрю вскоре разделил Нобелевскую премию, в те же годы определил структуру всем известного белка гемоглобина, переносящего кислород в крови. Добавим, что Перуц, начавший эту работу в возрасте 25 лет, завершил ее только через 22 года!
На сегодня рентгеноструктурный анализ является одним из двух методов, позволяющих с атомарной точностью определить строение таких сложнейших молекул, как белки (второй метод – спектроскопия ядерного магнитного резонанса). В идеальном случае с его помощью можно получить координаты каждого атома в молекуле, кроме атомов водорода.

Метод отличается исключительной трудоемкостью, хотя и метод ЯМР в этом смысле ему не уступает. Даже после всех усовершенствований, сделанных со времен Перуца и Кендрю, существует три узких места, ограничивающих его «пропускную способность». Во-первых, для рентгеноструктурного анализа необходим белковый кристалл достаточно больших размеров, который позволит получить качественную картину дифракции рентгеновских лучей на атомах белковых молекул, упорядоченных в кристалл. Сама же кристаллизация белков во многом сродни черной магии – осуществить ее удается далеко не для всех белков, да и получившийся дифракционный узор не всегда бывает четким.
Во-вторых, даже в случае хорошего кристалла для его анализа требуется достаточно яркий (т. е. мощный) пучок рентгеновского излучения. В наши дни пучки получают на больших синхротронах при помощи специальной аппаратуры, и очередь на работу на таких станциях расписана на месяцы и даже на годы вперед.
 Третий ограничитель – время, необходимое на расшифровку белковой структуры по дифракционной картине расшифровать структуру – с повышением вычислительных мощностей и усовершенствованием алгоритмов стал менее актуальным, но первые два до недавнего времени оставались серьезными препятствиями. Награда же за их преодоление дорога: например, зная структуру белка, вовлеченного в патологические процессы, можно создавать лекарства, которые принесут миллиардные прибыли. Недаром представители фармацевтических компаний буквально днюют и ночуют на установках при синхротронах, платя за это немалые деньги.
Третий ограничитель – время, необходимое на расшифровку белковой структуры по дифракционной картине расшифровать структуру – с повышением вычислительных мощностей и усовершенствованием алгоритмов стал менее актуальным, но первые два до недавнего времени оставались серьезными препятствиями. Награда же за их преодоление дорога: например, зная структуру белка, вовлеченного в патологические процессы, можно создавать лекарства, которые принесут миллиардные прибыли. Недаром представители фармацевтических компаний буквально днюют и ночуют на установках при синхротронах, платя за это немалые деньги.
Долгое время совершенствование рентгеноструктурного анализа проходило под девизом «Меньше, ярче, быстрее»: кристалл меньших размеров легче вырастить, а более яркие источники излучения позволяют быстрее получать данные. И прорыв года, о котором сообщено в журнале «Science», поднял планку в этих соревнованиях очень высоко.
Сверхмощный рентгеновский лазер на линейном ускорителе SLAC в Калифорнии «стреляет» импульсами продолжительностью в 40 фемтосекунд (т. е. 40 квадриллионных долей секунды – свет за такое время пройдет расстояние всего в 12 мкм!). Яркость излучения такова, что позволяет использовать кристаллы размером в 10–100 раз меньше, чем обычно требуется. Импульс лазера буквально испаряет кристалл, но при этом дифракционная картина успевает зафиксироваться. Несколько сотен тысяч таких «моментальных фотографий» дают картину, не уступающую по качеству обычной, но получаются они за время, измеряемое миллиардными долями секунды.
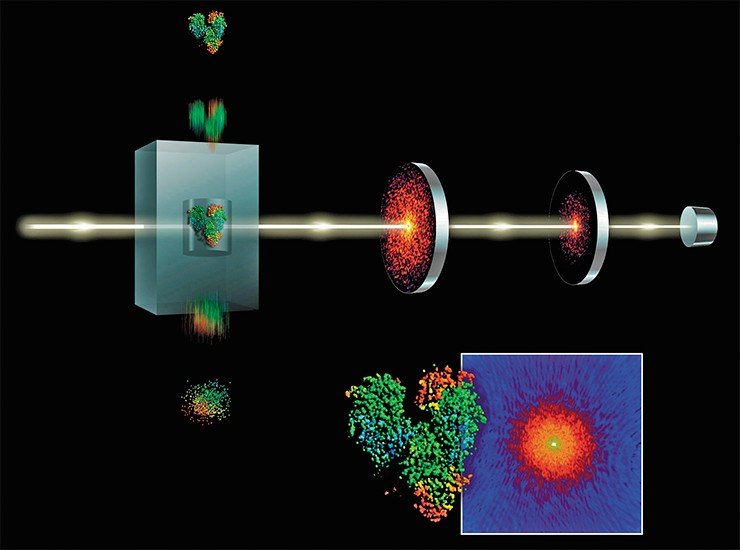
Пока что на счету уникального лазера только одна определенная структура белка. Этим белком стал катепсин D, важный компонент клеток паразита трипаносомы (Trypanosoma brucei) – возбудителя сонной болезни. Структурные же биологи задумываются: имеют ли рентгеновские лазеры будущее в этой области? Ведь несмотря на поразительные результаты, такая установка гораздо сложнее и дороже, чем привычные станции на синхротронах, которых в мире уже не один десяток.
Но есть надежда, что именно рентгеновский лазер позволит осуществить давнюю мечту биологов – получить дифракционную картину с отдельных молекул белка, вообще не прибегая к его кристаллизации. Это откроет перед исследователями такие перспективы, которые сейчас даже трудно представить.