Тразодон восстанавливает синтез белка и останавливает развитие нейродегенерации
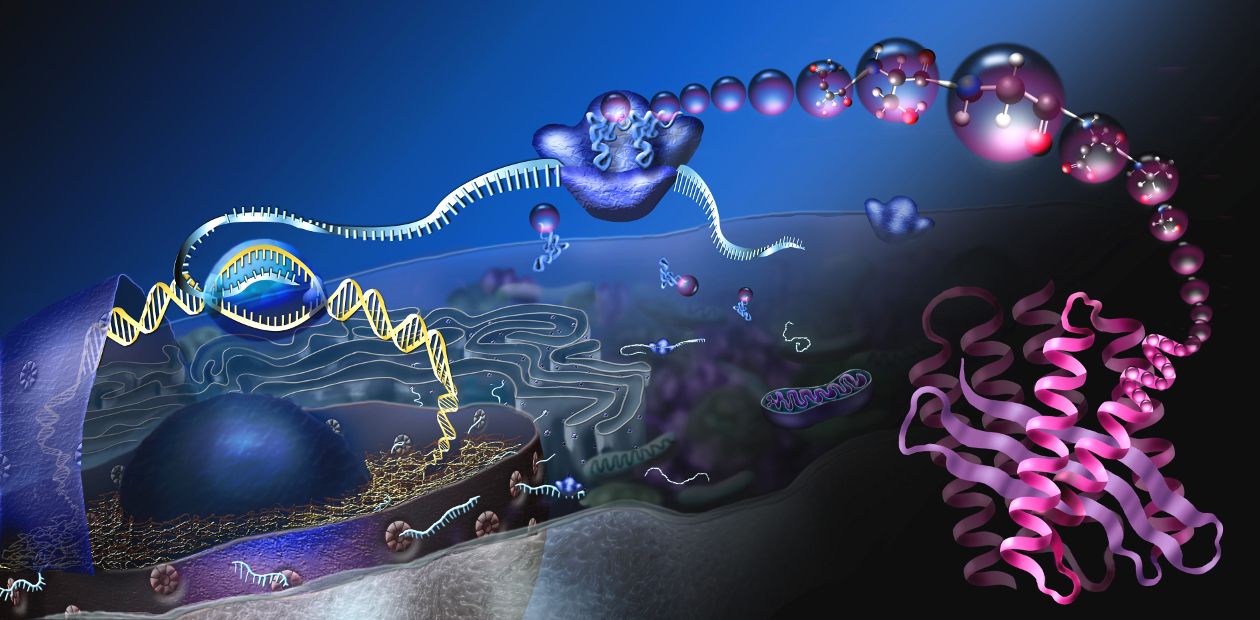
Считается, что основным патогенетическим звеном развития деменции при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера или прионные болезни, является накопление в мозге патологических, неправильно свернутых белковых молекул. Несколько лет назад было показано, что накопление таких белков у мышей, инфицированных прионами, вызывает гиперактивацию одного из механизмов ответа на так называемый стресс эндоплазматического ретикулума – клеточной структуры, обеспечивающей синтез и транспорт белков. В результате «перегрузки» этой структуры неправильно свернутыми белками активируется фермент PERK-киназа, которая фосфорилирует фактор трансляции eIF2, что приводит к «выключению» трансляции (синтеза белка) в клетках мозга на начальных этапах этого процесса. В итоге в клетках уменьшается количество белков, в том числе жизненно важных, и, в конце концов, нейроны гибнут.
Когда ученые ввели мышам экспериментальный препарат – ингибитор PERK-киназы, в их нейронах восстановился синтез белка, остановился процесс нейродегенерации, уменьшились клинические проявления прионной болезни. Но препарат оказался слишком токсичным (страдала поджелудочная железа) и поэтому не подходил для испытаний на людях.
Тогда ученые в поисках нужного эффекта протестировали более тысячи соединений из коллекции Национального института неврологических заболеваний и инсульта NIH (National Institute of Neurological Disorders and Stroke), три четверти из которых уже одобрены FDA для лечения тех или иных патологий. Сначала провели первичный скрининг на червях-нематодах Caenorhabditis elegans, которые считаются хорошей моделью для скрининга соединений, действующих на нервную систему, а затем на клетках млекопитающих.
В результате удалось выявить два кандидатных препарата, которые протестировали на мышах, зараженных прионами, и на мышах, у которых смоделировали лобно-височную деменцию человека: они несли мутацию, способствующую накоплению в нейронах патологического тау-белка. Оба вещества предотвратили появление признаков повреждения мозга у большинства мышей, зараженных прионами, и восстанавливали память мышей с лобно-височной деменцией.
Один из препаратов – дибензоилметан (dibenzoylmethane), который исследуют как потенциальное противораковое средство, а второй – уже использующийся в клинике антидепрессант тразодон (trazodone hydrochloride). По словам ученых, тразодон применяют в терапии поздних стадий деменции, поэтому точно известно, что он безопасен не только вообще для человека, но и конкретно для пациентов с деменцией. Это позволит сильно сократить время проведения клинических испытаний: их можно начинать уже сейчас, и всего через 2-3 года станет понятно, будет ли тразодон давать у больных людей тот же эффект, что у больных мышей, то есть, как минимум, замедлять прогрессирование нейродегенеративных заболеваний.
Фото: https://commons.wikimedia.org Credit: National Science Foundation
Подготовила Мария Перепечаева