Архитекторы молекул
Сегодня ученые всерьез озабочены поиском способов, которые бы позволили человеку полностью использовать отмеренный ему природой срок существования. При этом само по себе долголетие не может быть самоцелью – все мы хотим пройти по жизни активными, в здравом уме и твердой памяти. Однако по мере роста средней продолжительности жизни человечеству приходится бороться не только с наследственными и инфекционными болезнями, но и с целым букетом «болезней старения», связаным с метаболическими поломками в организме. Шансов найти в ближайшем будущем заветный «философский камень» немного, поэтому сегодня нам нужно делать акцент на улучшение качества жизни. Среди глобальных задач, стоящих перед наукой, – создание универсальных вакцин нового поколения для борьбы с потенциально смертельными инфекциями, подобными лихорадке Эбола; разработка персонализированных средств иммунотерапии рака и раскрытие механизмов возрастных нейродегенеративных заболеваний, таких как болезнь Альцгеймера… Во всех этих случаях на помощь приходят технологии структурной биоинформатики и компьютерного моделирования, ставшие мощным аналитическим и предсказательным инструментом современной молекулярной биологии
Структурная биоинформатика, как это ясно из названия, подразумевает разработку алгоритмов и программ для предсказания и анализа пространственной структуры биополимеров, таких как белки, ДНК и РНК. Подобные работы в приложении к белкам начались еще в 1970-е гг., когда были выявлены тесные взаимосвязи между аминокислотной последовательностью белков и особенностями их трехмерной структуры.
Дело в том, что каждый белок характеризуется не только уникальной последовательностью аминокислот, но и уникальным способом укладки этой аминокислотной «цепочки» в пространстве. При этом трехмерных белковых структур на сегодня изучено на несколько порядков меньше, чем белковых последовательностей. Это и неудивительно, так как в отличие от рутинного секвенирования экспериментальное определение формы белковой молекулы является намного более сложной и затратной процедурой. И здесь на помощь приходит биоинформатика, позволяющая без каких-либо экспериментальных процедур с высокой точностью ответить на вопрос, как в действительности выглядит белковая молекула.
К настоящему времени структурная биоинформатика располагает множеством различных программ для предсказания формы белковых молекул. Проводится даже чемпионат мира, где эти программы реально соревнуются. Созданы они на основе разных подходов. Среди популярных – сравнительный подход, когда программа делает предсказания, исходя из допущения, что «родственные» по составу белки сворачиваются в одну и ту же структуру, а также статистический, когда программа «выстраивает» пространственную структуру целого белка из небольших отдельных фрагментов, зная, какую форму обычно приобретают те или иные аминокислотные последовательности.

Но почему нам так важно знать пространственную организацию тех же белков? Оставив в стороне фундаментальные исследования, отметим, что действие большинства современных лекарств основано на образовании комплексов с белками и блокировке их действия. И, к примеру, определение стратегически важных участков какого-нибудь белкового фермента репарации («ремонта») ДНК и выяснение механизма его работы на молекулярном уровне может помочь в создании лекарства для повышения эффекта химиотерапии при раке. Не менее важным является изучение механизма образования и структуры таких белков как антитела к ВИЧ, способных нейтрализовать этот вирус, которые встречаются у некоторых инфицированных и могут послужить основой для создания вакцины.
Изменения пространственной организации некоторых белков могут спровоцировать развитие целого ряда тяжелейших заболеваний, таких как болезнь Альцгеймера, для которой до сих пор нет эффективного лечения. Для решения этих серьезных проблем здравоохранения необходимо изучать структурные и динамические свойства таких белков, в том числе методами молекулярного моделирования.
Форма имеет значение
Молекулы некоторых белков, в норме имеющих глобулярную (сферическую) форму, могут разворачиваться и слипаться в длинную нить, образуя структуру в виде амилоидных фибрилл. Белки с такой нестандартной укладкой могут негативно влиять на процессы жизнедеятельности живой клетки и стать причиной развития многих практически не поддающихся лечению заболеваний, от болезней Альцгеймера, Паркинсона и диабета второго типа до бокового амиотрофического склероза и болезни Крейтцфельда-Якоба (коровьего бешенства).
На сегодня амилоидные фибриллы изучены плохо. Методы, которыми изучают «нормальные» глобулярные белки, для фибриллярных не подходят. Известно только, что образование патологических белков аналогично процессу кристаллизации. В обычном растворе белка они могут не появляться в течение пары дней (это большой срок по меркам молекулярной биологии), но если туда добавить уже сформированные фибриллы из другой пробирки в качестве затравки, то процесс идет лавинообразно. Более того, оказалось, что затравка может состоять не только из того же самого белка, но и из других белков, например, вирусных или бактериальных.
Что следует из этого факта? Представьте, что в организме человека идет вялотекущее, скрытое воспаление или просто имеется небольшое число патологических агентов, которые «давятся» иммунитетом. Сами по себе неопасные для здоровья, они могут сыграть роль затравки в процессе роста амилоидных фибрилл. Недавно выяснилось, что и болезнь Альцгеймера может в принципе передаваться от человека к человеку аналогично коровьему бешенству (Jaunmuktane et al., 2015). И хотя это было показано в довольно нетипичной ситуации (все заболевшие получали инъекции мозгового соматотропина трупного происхождения), а каннибализм в современных человеческих популяциях не практикуется, эти исследования наталкивают на мысль о возможности существования «заразного» пути развития болезни Альцгеймера. К примеру, через медицинские инструменты: как известно, те же амилоидные фибриллы устойчивы к обычной термообработке.
Очевидно, в организме человека имеется какой-то защитный механизм, который в норме не дает белкам образовывать фибриллы, иначе все мы с малых лет поголовно бы страдали болезнью Альцгеймера. С возрастом этот механизм ломается, и эти поломки, по-видимому, накапливаются постепенно.
ArchCandy не гадает по руке
Перед структурной биоинформатикой и молекулярной биологией стоит задача понять, какие белки могут образовывать амилоидные фибриллы, научиться предсказывать этот процесс, а затем и препятствовать ему.
Кстати сказать, среди амилоидных белков есть и приятные исключения: некоторые из них несут полезные функции, хотя для человека таких «хороших» белков известно совсем немного в отличие от бактерий, грибов и членистоногих. Благодаря своей способности образовывать длинные нити, такие белки играют роль прочных структурных компонентов, к примеру, в оболочке яйца насекомых. Так что, если удастся разобраться в механизме формирования фибриллярной белковой структуры, его можно будет использовать в биотехнологиях для создания прочных материалов по типу нанотрубок.
 Как уже говорилось выше, к настоящему времени структурная биоинформатика располагает разными программами для предсказания формы белковых молекул. Некоторые из них основаны на машинном обучении, когда компьютер «обучается» отличать «нормальные» белки от белков, образующих фибриллы, используя уже известные примеры. Есть программы, которые используют результаты экспериментов по агрегации в фибриллоподобные структуры небольших пептидов, однако в таком, более «мелком» масштабе, действуют немного иные механизмы.
Как уже говорилось выше, к настоящему времени структурная биоинформатика располагает разными программами для предсказания формы белковых молекул. Некоторые из них основаны на машинном обучении, когда компьютер «обучается» отличать «нормальные» белки от белков, образующих фибриллы, используя уже известные примеры. Есть программы, которые используют результаты экспериментов по агрегации в фибриллоподобные структуры небольших пептидов, однако в таком, более «мелком» масштабе, действуют немного иные механизмы.
Достоинство программы, разработанной научным руководителем лаборатории структурной биоинформатики и молекулярного моделирования НГУ к. б. н. А. В. Каява, в том, что ее автор одним из первых понял, как формируется структура амилоидных фибрилл, не имея в то время прямых экспериментальных подтверждений своей догадке. В результате предсказания созданной на основе этих представлений программы ArchCandy базируются не на принципе «по образу и подобию», как описано выше, а на ряде эмпирических закономерностей, установленных Каява и его коллегами на основе анализа уже изученных пространственных структур и аминокислотных последовательностей
Если говорить конкретно, то в каждом случае ArchCandy пытается по определенным «правилам» сконструировать пространственную фибриллярную структуру de novo из имеющихся элементов (аминокислотных остатков), составляющих последовательность тестируемого белка. Если попытка окажется неуспешной (например, какие-то атомы будут «мешать» друг другу), это будет означать, что вероятность сформировать фибриллу для этого белка очень мала.
Так как на сегодня известно всего лишь несколько десятков белков, способных образовывать фибриллы, ни одна из этих программ не способна давать предсказания с точностью 100 %. Для полной уверенности в работе подобного инструментария его нужно «обкатать» на более масштабной выборке. Поэтому лаборатория структурной биоинформатики и молекулярной биологии НГУ представила проект, который позволит отработать механизм предсказания пространственной организации белковых структур с использованием искусственных, т. е. не существующих в природе белков.
Эту работу будет выполнять большая команда. Структурные биоинформатики станут заниматься, соответственно, теоретической частью, а синтезом виртуально «сконструированных» белков, т.е. непосредственно синтетической биологией, – специалисты из лаборатории геномной и белковой инженерии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск).
Успешное завершение этой работы позволит «отшлифовать» программу предсказания, что открывает широкие перспективы для ее использования не только в научных, но и в медицинских целях. Например, на основе одной лишь базы мутаций, вызывающих наследственные заболевания человека, можно будет выяснить, в каких случаях при этом образуются белки с патологической фибриллярной структурой. А можно анализировать известные бактериальные геномы, чтобы найти последовательности, потенциально способные провоцировать возникновение болезни Альцгеймера.
В поисках универсальных вакцин
Вероятность возникновения эпидемии, от которой погибнет все население Земли, очевидно, так же мала, как и вероятность уничтожения планеты метеоритом. Тем не менее, сегодня серьезно обсуждаются планы создания глобальной противометеоритной системы. Разработка платформ для оперативного получения вакцины против любого вируса – безусловно, не менее актуальная задача, стоящая перед человечеством. И, к примеру, российские ученые сегодня работают над созданием вакцины против лихорадки Эбола несмотря на отсутствие прямой угрозы эпидемии в нашей стране.
При стандартном способе получения вакцин вирус размножают в искусственных условиях, а затем убивают. В ответ на введение такой вакцины в организме человека вырабатываются специфические антитела, которые в случае заражения распознают живой вирус и нейтрализуют его. Те части вируса, которые вызывают выработку антител, называются антигенами. Обычно при появлении новой модификации того или иного вируса, для него можно достаточно быстро сделать и новую вакцину.
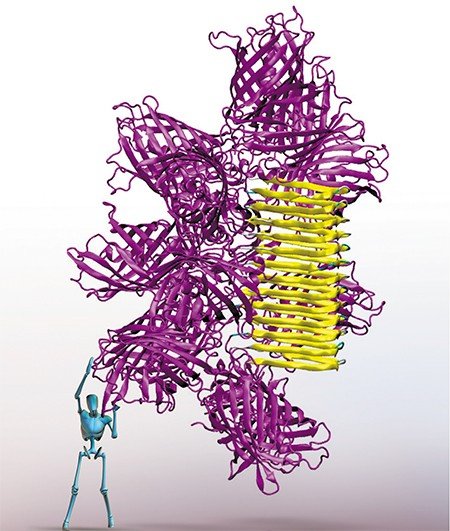
Сегодня в мире проходят испытания около десятка вакцин против лихорадки Эбола, в том числе разработанных российскими учеными. Одна из вакцин, созданная в ГНЦ ВБ «Вектор», уже успешно прошла первую фазу клинических испытаний на людях. Однако вирусы эволюционируют: к примеру, патоген, вызвавший эпидемию Эбола в 2014 г., отличается от вируса, обнаруженного в Африке в 1976 г. Поэтому неизвестно, какая из ныне существующих вакцин окажется более эффективной при появлении в очередной раз мутировавшего вируса. Однако с помощью биоинформатического подхода можно проанализировать эволюцию вируса и с учетом этих данных модифицировать вакцину
Однако многочисленные попытки создать стандартным способом вакцину против того же вируса Эбола не увенчались успехом. Поэтому пришлось использовать другой подход: создавать «гибридные» неопасные вирусы или вирусоподобные частицы, которые несут на своей оболочке поверхностные антигены вируса Эбола. В случае необходимости эти поверхностные белки можно поменять, к примеру, на белки вируса Марбург – ближайшего родственника Эболы из того же семейства филовирусов. То есть эта конструкция, по существу, может служить достаточно универсальной платформой для создания разных вакцин.
Важно, что подобная технология безопасна, так как работы ведутся без использования живых патогенов. Лишь на этапе доклинических исследований, когда вакцины проверяют на лабораторных животных, исследователи вынуждены будут работать с соблюдением всех мер безопасности, в специальных «скафандрах».
Для разных типов вирусов, отличающихся, к примеру, по способу «упаковки» поверхностных молекул-антигенов, требуются свои «платформы» (носители). Очень важный момент – скорость получения нужной вакцины. Сейчас каждая потенциально смертельная инфекция вызывает не всегда обоснованную панику, у которой есть свои «побочные эффекты»: неправильное, нерациональное поведение как пациентов, так и врачей. Но если будет известно, что вакцина появится быстро, паники будет меньше. Хотя, конечно, даже в этом случае вакцина не поможет тем, кто уже заболел – для того, чтобы выработался иммунитет, требуется время.
На вызов – ответим!
Создавать вакцины нового поколения помогает биоинформационный подход. Например, с его помощью можно модифицировать поверхностные белки-антигены, чтобы добиться большей эффективности защитных антител, которые будут вырабатываться организмом в ответ на вакцинацию.
Сегодня существует множество бесплатных компьютерных программ для моделирования белков, однако для получения прорывных результатов требуются новые, нестандартные методы. К примеру, известно, что фрагмент белка патогена, произвольным образом выбранный в качестве основы (антигена) для вакцины, в растворе может принимать совсем другую форму. Это означает, что в организме такая вакцина работать не будет. Преодолеть проблему удалось А. В. Каява: разработанный им метод позволяет выбрать именно тот фрагмент белка, который сохранит в растворе свою первоначальную пространственную структуру. При этом нам необязательно даже знать о том, какую роль играют те или иные белки в жизни данного патогена и в развитии болезни: мы с высокой вероятностью можем определить, куда будет направлен иммунный ответ.
 Использовав в качестве объекта исследований возбудителей малярии – простейших из рода Plasmodium, Каява выбрал из генома малярийного плазмодия несколько подходящих генных фрагментов. Оказалось, что у переболевших малярией антитела вырабатываются как раз на соответствующие аминокислотные последовательности. Из этого набора антигенов были выбраны самые перспективные, на основе которых в настоящее время разрабатывается противомалярийная вакцина нового поколения.
Использовав в качестве объекта исследований возбудителей малярии – простейших из рода Plasmodium, Каява выбрал из генома малярийного плазмодия несколько подходящих генных фрагментов. Оказалось, что у переболевших малярией антитела вырабатываются как раз на соответствующие аминокислотные последовательности. Из этого набора антигенов были выбраны самые перспективные, на основе которых в настоящее время разрабатывается противомалярийная вакцина нового поколения.
Эту методику планируется применить для создания вакцины против вируса ящура в совместной работе с монгольскими учеными. Для сибирских исследователей это быстрый способ показать высокую эффективность метода без многолетних клинических испытаний, что поможет заинтересовать таких серьезных партнеров, как Государственный научный центр вирусологии и биотехнологии «Вектор» (Новосибирская обл., Кольцово). «Вектор» – одна из немногих организаций в России, способная провести самостоятельно всю работу по созданию вакцины от начала до конца, включая производство. Благодаря такому сотрудничеству удалось бы применить биоинформационный подход к выбору белковых антигенов к платформам для универсальных вакцин, созданных в центре.
Когда новый метод будет полностью автоматизирован и программа будет сама предлагать варианты потенциальных антигенов, весь процесс должен выглядеть следующим образом. При появлении нового инфекционного агента его «ловят» и расшифровывают геном. Программа анализирует последовательности генов и выбирает фрагмент ДНК, который нужно синтезировать и внести в плазмиду – кольцевой самовоспроизводящийся генетический элемент. Плазмиды, в свою очередь, вносят в клеточную культуру, клетки которой производят вакцину в виде псевдовирусных частиц, на поверхности которых «сидят» выбранные антигены. Весь процесс идет аналогично выработке обычных вирусов зараженной клеткой, только в данном случае получившийся продукт будет неопасен для человека.
Подобные технологии смогут сделать реальностью фантастические сценарии, часто встречающиеся в фильмах, когда ученые создают вакцину от новой неизвестной болезни буквально за считанные дни.
Вакцины против рака
Систему для создания эффективных вакцин на основе универсальных платформ можно будет использовать для борьбы не только с инфекционными болезнями. Ведь в борьбе со злокачественными опухолями также очень важно активировать гуморальный иммунный ответ (т. е. B-лимфоциты, вырабатывающие антитела), а также T-клеточный противоопухолевый иммунитет.
Сегодня уже известно, какие белки-антигены характерны для опухолевых клеток при тех или иных видах рака. Если секвенировать совокупность РНК клеток любой опухоли, можно обнаружить синтез белков, которых в норме там быть не должно. Используя те же самые алгоритмы, что и в случае инфекций, можно выбрать антигены, характерные для опухолевых клеток конкретного пациента, и создать на их основе терапевтическую персонализированную вакцину против рака.
Определить правильную мишень сегодня позволяют технологии «анализа генных сетей», хотя стоимость секвенирования всех РНК опухолевых клеток высока. Но если это направление будет развиваться, то и цена снизится. В лаборатории структурной биоинформатики и молекулярного моделирования НГУ сегодня занимаются теоретической частью – предлагают белковые конструкции, которые можно использовать при создании противораковой вакцины, а сотрудники Института клинической иммунологии СО РАМН (Новосибирск) работают над тем, как эти конструкции внести в клетки иммунной системы для усиления работы иммунитета.
Известно, что раковая опухоль выживает в организме лишь потому, что она научилась обманывать и подавлять систему иммунитета с помощью специальных молекул-супрессоров. Но можно выделить иммунные клетки из крови и «обучить» их бороться с конкретной опухолью, а потом ввести их обратно больному.
Успешный пример такой иммунотерапии демонстрируют работы С. Риддела и его коллег из Онкологического научного центра Фреда Хатчинсона (Сиэтл, США), которым недавно удалось добиться ремиссии у безнадежных онкобольных, включая пациентов с острым лимфобластным лейкозом и хроническим лимфолейкозом. Эти исследователи работают над активацией Т-клеточного иммунитета, и в данном случае Т-лимфоциты были генно-модифицированы с помощью искусственной генетической конструкции, в результате чего у них появились так называемые химерные рецепторы антигенов, составленные из белковых фрагментов разного происхождения. Благодаря такой модификации Т-лимфоциты получили способность распознавать и активно атаковать опухолевые клетки.
Общая схема подобной иммунотерапии давно известна, новизна же разработки заключается в удачной структуре молекулы химерного белка. Однако молекул, регулирующих иммунитет, очень много, и всегда есть шанс найти еще более удачную комбинацию, поэтому работы в этом направлении будут развиваться и дальше.
Однако у этого подхода есть и свои проблемы. Во-первых, даже когда на снимках мы видим полное исчезновение опухоли, это не означает, что рак полностью побежден – могут остаться микроскопические метастазы. Еще одна проблема – очень высокая стоимость лечения, в десятки раз больше стандартного, которое и так недешево. Есть надежда, что стоимость удастся понизить за счет удешевления технологий, но это произойдет лишь в случае, если метод получит широкое распространение.
Тем не менее, каждый такой результат – это еще один шаг в борьбе с тяжелейшим заболеванием, и широкое внедрение иммунотерапии повысит шансы на жизнь у раковых больных. Но нужно отдавать отчет, что пока речь не идет о панацее. Возможно, в будущем такое лечение рака станет полностью автоматизированным процессом, а саму процедуру введения больному его собственных «обученных» иммунных клеток придется повторять неоднократно, может быть, на протяжении всей жизни. Но в любом случае она увеличит продолжительность и качество этой жизни. Сложно сказать, когда это будущее наступит, но нужные для этого технологии уже создаются.
В 2016 г., на следующий год после создания лаборатории структурной биоинформатики и молекулярного моделирования НГУ, в университете заработала программа магистратуры по этому направлению. В число преподавателей вошли, естественно, и сотрудники лаборатории.
Идеальный структурный биоинформатик – это тот, кто одинаково хорошо разбирается и в молекулярной биологии, и в информационных технологиях. В Новосибирском научном центре пока таких людей мало, а задач для них хватает. Поэтому создание подобной магистратуры можно сравнить с долгожданной покупкой нового научного прибора, которым сможет пользоваться не один академический институт.
Одно из направлений, которое будет развиваться в рамках этой магистерской программы, связано с экспериментальным определением структуры белка. У студентов появится возможность не только моделировать белки, но и экспериментально работать с этими белками. Так как в Новосибирске не занимаются белковой кристаллографией, предполагается наладить сотрудничество с зарубежными лабораториями, чтобы отправлять студентов на стажировку в Европу.
Помимо решения собственных задач, о которых говорилось выше, лаборатория структурной биоинформатики и молекулярного моделирования НГУ много занимается консультированием в формате сервисной лаборатории. Так, без всякого эксперимента удалось разрешить вопрос о возможности применения одного из препаратов от гепатита С для лечения клещевого энцефалита: для этого потребовалось проанализировать потенциальные места его связывания с белковой мишенью. А врачи-генетики приходят к нам проконсультироваться, как именно мутации, обнаруженные у пациентов, могут влиять на работу белков в их организме.
Еще один вид помощи, которую лаборатория может оказывать исследователям, – генерировать «красивые» картинки. И они не просто «красивые». Ведь далеко не каждый молекулярный биолог может представить себе трехмерную структуру белка. Но если перед ним будет реальная модель, которую можно «покрутить», это позволит гораздо эффективнее планировать эксперимент и анализировать результаты.
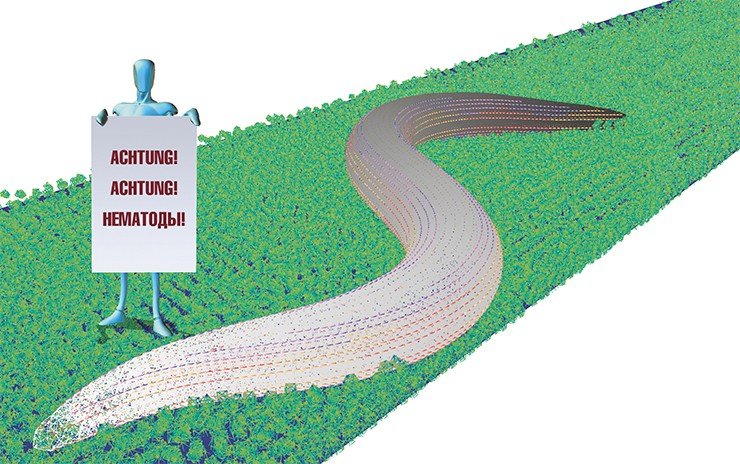
Что касается нестандартных исследований, то лаборатория участвует в международном проекте OpenWorm, посвященном созданию компьютерной модели круглого червя Caenorhabditis elegans. Эта крошечная, просто устроенная свободноживущая нематода является одним из самых изученных организмов на Земле, а теперь должна стать и первым «оцифрованным» высшим организмом. То есть речь идет о моделировании уже не просто отдельных белковых молекул, но целых систем! Кстати сказать, сама идея проекта была также выдвинута новосибирцами – сотрудниками лаборатории моделирования сложных систем Института систем информатики им. А. П. Ершова СО РАН.
Сейчас в лаборатории НГУ создается трехмерная модель нервной системы нематоды, и эту работу можно с полным правом считать первой ступенькой к моделированию структуры человеческого мозга.
Литература
Sennikov S. V., Shevchenko J. A., Kurilin V. V., et al. Induction of an antitumor response using dendritic cells transfected with DNA constructs encoding the HLA-A*02:01-restricted epitopes of tumor-associated antigens in culture of mononuclear cells of breast cancer patients // Immunol. Res. 2016. N. 64(1). P. 171—180
Shcherbakova N. S., Shcherbakov D. N., Bakulina A. Y., et al. Artificial polyepitope HIV-1 immunogen containing mimotope of 2F5 epitope // Protein Pept Lett. 2016. N. 23(2). P. 159—168.
Céspedes N., Habel C., Lopez-Perez M., et al. Plasmodium vivax antigen discovery based on alpha-helical coiled coil protein motif // PLoS One. 2014. N. 9(6). e100440.
Dearborn A. D., Wall J. S., Cheng N. α-Synuclein Amyloid Fibrils with Two Entwined, Asymmetrically Associated Protofibrils // J Biol. Chem. 2016. N. 291(5). P. 2308—2310