Неспособность производить «правильную» слизь увеличивает патогенность кишечных бактерий
Кишечная палочка – одна из наших «домашних» кишечных бактерий. Она участвует в синтезе витаминов и нашем обмене веществ, предотвращает развитие патогенной микрофлоры, при этом некоторые ее штаммы сами могут вызывать тяжелые заболевания и часто оказываются устойчивы к антибиотикам. Недавно при изучении кишечной палочки ученым удалось открыть по крайней мере один из механизмов, ответственных за патогенность бактерий
Кишечная палочка (Escherichia coli) – широко распространенный вид бактерий. Большинство ее штаммов безвредны и составляют значительную часть нормальной микрофлоры кишечника человека и теплокровных животных. Но есть и исключения: к примеру, патогенный штамм ST95 ассоциирован с такими тяжелыми болезнями, как острый пиелонефрит, сепсис и неонатальный менингит.
Кишечная палочка – и самый распространенный из патогенов, способных формировать устойчивость к антибиотикам. Так, в 2019 г. 800 тыс. из почти 5 млн смертей в мире, обусловленных лекарственной устойчивостью патогенов, были вызваны E. coli. Угроза «супербактерий», устойчивых ко всем доступным антибиотикам, неуклонно растет, и поиск способов борьбы с ней крайне важен, включая изучение механизмов устойчивости и высокой патогенности.
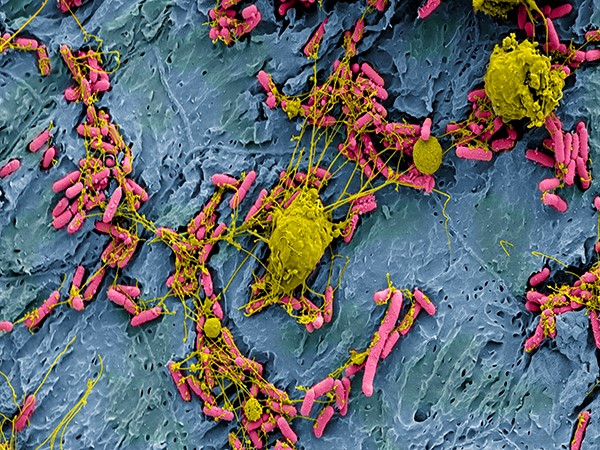
Исследователи из Университета Квинсленда (Австралия) изучили несколько сотен геномов E. coli штамма ST95 и выяснили, что в 55% случаев они несут мутации, которые нарушают производство так называемой бактериальной целлюлозы. Этот полимер в норме участвует в образовании внеклеточного матрикса («слизи») и формировании биопленок – поверхностного конгломерата прикрепленных друг к другу бактериальных клеток.
Все дело в том, что целлюлоза образует матрикс совместно с curli-белком – амилоидным бактериальным белком, который способен провоцировать воспалительные процессы в макроорганизме. В отсутствие целлюлозы curli-белок проявляет свои патогенные свойства в полную силу, индуцируя иммунные реакции и стимулируя аутоиммунный ответ. Практически это означает, что, если на поверхности клеток кишечной палочки не будет целлюлозы, в кишечнике разовьется воспалительный процесс и нарушится кишечный барьер. В этом случае бактерии могут попасть в кровоток и распространиться по организму, поражая внутренние органы.
Весь этот сценарий ученые наблюдали на двух моделях инфекции у животных. В случае неонатального менингита у крыс неспособность штамма ST95 производить целлюлозу привела к нарушению целостности кишечного барьера у новорожденных крысят и распространению инфекции в печень, селезенку и мозг. А в мышиной модели инфекции мочевыводящих путей результатом заражения стал дисбаланс работы иммунитета и выработки молекул цитокинов, связанных с воспалением.
Ученые подтвердили свои выводы, «исправив» у кишечной палочки ST95 одну из наиболее распространенных мутаций, нарушающих производство целлюлозы, – так им удалось понизить вирулентность штамма. Исследователи также обнаружили аналогичные мутации, нарушающие выработку целлюлозы, у других вирулентных штаммов E. coli, а также у особо опасных штаммов других кишечных бактерий – шигелл и сальмонелл.
Похоже, ученым удалось найти механизм повышения вирулентности, широко распространенный среди целого спектра бактериальных патогенов. И это открытие должно помочь в борьбе с вирулентными штаммами этой группы.
Публикации по теме:
Как управлять микробами, когда они управляют нами. Фекотрансплантация как способ терапии
Наука в руках школьника: сибирские «охотники за микробами»