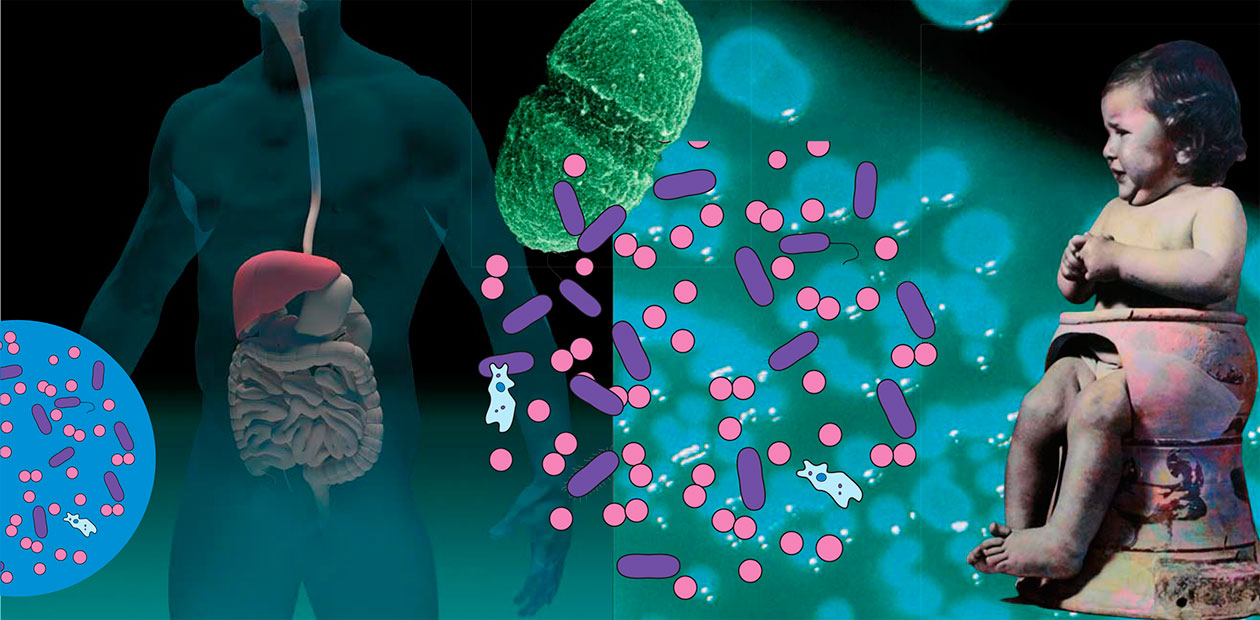
Как управлять микробами, когда они управляют нами
Фекотрансплантация как способ терапии
Тело человека населяет множество микроорганизмов, играющих важнейшую роль в обеспечении его здоровья. Специфические сообщества бактерий живут на нашей коже и в различных полостях тела, в первую очередь в кишечнике. С давних времен люди догадывались, что расстройства пищеварения являются следствием нарушений состава содержимого кишечника, и пытались внести в него фекальный материал от здорового человека. В последние годы во всем мире широкое распространение получила технология коррекции микробиома человека путем введения пациентам кишечной микрофлоры здоровых доноров.
Метод оказался крайне эффективным для лечения не только желудочно-кишечных заболеваний, но и целого ряда других патологий, на первый взгляд совсем не связанных с пищеварительным трактом. В новой публикации наших постоянных авторов читатель познакомится с результатами недавних исследований о влиянии сообщества кишечных микробов на организм человека и с перспективами развития фекотрансплантации как действенного терапевтического метода
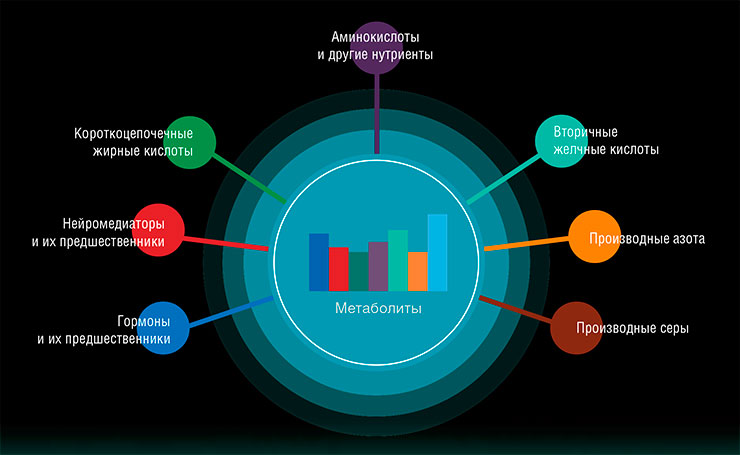
Вес микроорганизмов, живущих в кишечнике человека, достигает 1,5 кг, а число их клеток – 50 трлн, что превышает суммарную численность собственных клеток взрослого организма. Бактерии, археи, вирусы и грибки кишечника образуют гармоничное сообщество (микробиом), где микроорганизмы снабжают друг друга полезными веществами и общаются между собой с помощью сигнальных молекул.
Микробиом кишечника можно смело назвать настоящим симбиотическим органом человека. Кишечная микрофлора не только активно участвует в усвоении пищи, но и оказывает выраженное влияние на всю жизнедеятельность нашего организма, включая работу иммунной системы и головного мозга. Она служит источником множества полезных веществ: от аминокислот до витаминов и «энергетических» молекул, а также препятствует заселению в кишечник «чужих» патогенных бактерий (к примеру, наша обычная кишечная палочка блокирует колонизацию пищеварительного тракта сальмонеллами).
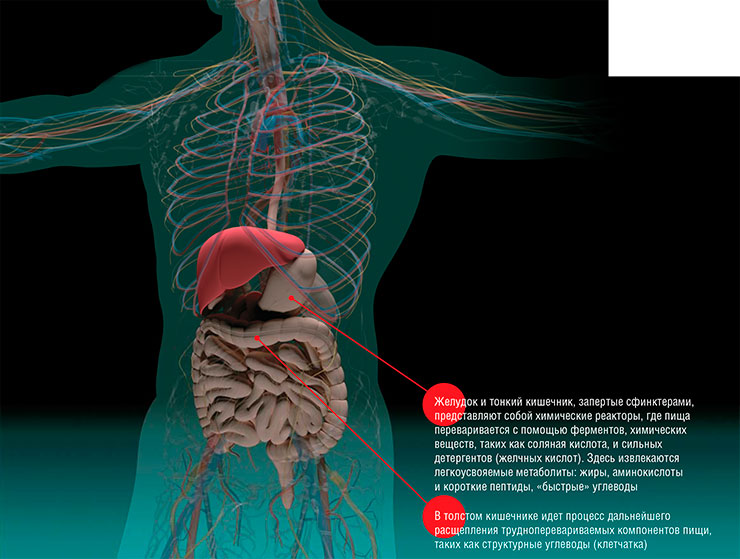
Нарушения в составе кишечной микрофлоры (дисбиоз) в результате неправильного питания, инфекций или приема химических препаратов могут приводить к тяжелым заболеваниям, поэтому коррекция состава микробиома является важной медицинской задачей. Сейчас разрабатываются подходы к регуляции микробиома ротовой полости, кожи, влагалища, но наиболее широко ведутся работы по разработке способов воздействия на кишечную микрофлору. Среди этих способов – медикаментозные средства и специальные продукты питания, однако наиболее эффективным подходом является трансплантация фекальной микробиоты (ТФМ) – введение в кишечник материала от здоровых доноров, содержащего живые микроорганизмы.
Лечим воспаления кишечника
Еще в глубокой древности в Китае и Египте для лечения пациентов, страдающих расстройством пищеварения, применяли различные продукты из фекалий здорового человека. С давних пор аналогичным способом исцеляли и животных. Так, в ветеринарии стандартным приемом лечения у коров расстройства пищеварения, вызванного нарушением состава микробиома в рубце (главной части желудка коровы), является процедура трансфаунации. Она заключается в переносе содержимого рубца от здоровой коровы-донора больной. Животные и сами часто употребляют для лечения желудочно-кишечных расстройств продукты, богатые кишечными микробами. Так, известно, что собаки для этой цели поедают фекалии лошадей и других сельскохозяйственных животных.
Новая история ТФМ началась уже в наши дни с проблемы лечения больных, инфицированных бактериями Clostridium difficile, устойчивыми к антибиотикам. В здоровом кишечнике клостридии обычно не поселяются, но легко колонизируют людей, кишечная микрофлора которых нарушена в результате приема антибиотиков. Как известно, эти лекарства, несмотря на свою несомненную пользу, далеко не идеальные: убивая вредоносные бактерии, они поражают и полезные нам микроорганизмы. А поврежденный антибиотикотерапией, неполноценный микробиом может не справиться с нашествием «чужих» бактерий, таких как клостридии.
Клостридиальная инфекция сопровождается неудержимой диареей и болями в области толстой кишки, при этом с некоторого времени лечение антибиотиками перестало быть эффективным из-за повсеместного распространения лекарственно-устойчивых штаммов C. difficile. В результате эта болезнь стала смертельной угрозой, особенно для госпитализированных пациентов. Так, в 2011 г. она была зарегистрирована более чем в 450 тыс. больничных случаев в США и явилась причиной смерти около 30 тыс. человек!
В поисках решения проблемы вспомнили о методе ТФМ, который и дал поразительные результаты: после этой процедуры 85–90 % пациентов практически немедленно излечивались. ТФМ стала приобретать популярность: пересадку фекального микробиома начали применять для лечения и других заболеваний кишечника воспалительной природы, хотя причинами их развития может быть целый ряд факторов, включая проблемы с иммунной системой, а не только патогенная флора.
Так, ТФМ показала хорошие результаты в случае язвенного колита: на лечение отвечало около 70 % пациентов, при этом успех во многом зависел от донора микробиоты. При синдроме раздраженного кишечника, особенно в случаях тяжелых форм заболевания, около 65 % реципиентов ТФМ испытывали, по крайней мере, временное облегчение. При этом уменьшение симптомов наблюдалось только через 3 месяца после начала лечения, а улучшение состояния больных длилось не более года. Что касается болезни Крона, то клинические исследования использования ТФМ не дали однозначных результатов (Caldeira, Borba, Tonin et al., 2020; Huang, Mei, Lou et al., 2022).
Итоги экспериментов с применением ТФМ свидетельствуют, что этот метод можно широко использовать для коррекции кишечного микробиома пациентов, получивших интенсивные курсы антибиотикотерапии, а также людей, перенесших вирусные и бактериальные заболевания.
Вирусные инфекции, наряду с терапией антибиотиками, – наиболее частые причины угнетения кишечной микрофлоры. Так, коронавирусная инфекция может протекать с поражением пищеварительного тракта (одного из мест размножения вируса) и часто сопровождается бактериальной инфекцией, что требует применения антибиотиков. В результате у 20–30 % таких ковидных больных наблюдается инфицирование клостридиями.
Неудивительно, что после COVID‑19 пациенты восстанавливаются очень долго, при этом хорошо известный «постковидный синдром» можно объяснить, по крайней мере, отчасти дисбактериозом. Детальное исследование влияния ТФМ на восстановление пациентов после коронавирусной инфекции было проведено в Китае. Оказалось, что после такой процедуры происходит быстрое восстановление кишечной микрофлоры и улучшаются показатели иммунной системы (Liu, Ye, Zhu et al., 2021).
ТФМ и иммунная система
Удивительно, но сфера использования ТФМ не ограничилась лечением заболеваний кишечника. Оказалось, что этот метод может иметь гораздо более широкие применения, поскольку здоровый кишечный микробиом – необходимое условие эффективного функционирования основных защитных систем организма, т. е. его иммунной системы.
Так, ряд соединений, продуцируемых бактериями, может воздействовать на дифференцировку иммунных клеток и воспалительные процессы. К примеру, короткоцепочечные жирные кислоты, особенно бутират, способствуют продукции противовоспалительных цитокинов и снижают синтез белков, провоцирующих воспаление. Бутират и ацетат стимулируют секрецию эпителиальными клетками муцинов – гликопротеидов гелеобразной консистенции, которые смазывают кишечные стенки, снижая их проницаемость и препятствуя воспалению.
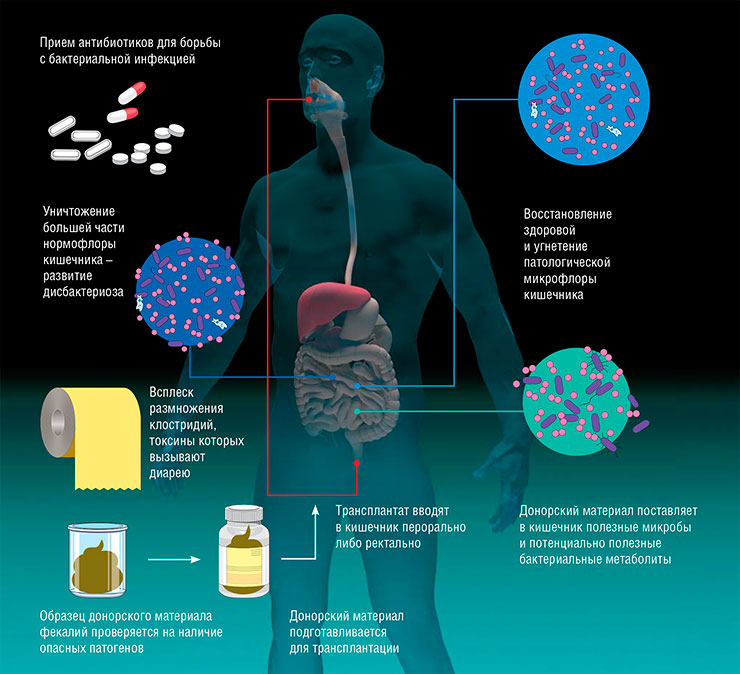
Еще один вариант ТФМ – прием внутрь капсул с замороженным и высушенным препаратом фекальной микробиоты. Они изготавливаются из материала, устойчивого к кислой среде желудка, поэтому растворяются только в кишечнике. Проблема этого метода в том, что капсулы довольно объемные и не каждый пациент способен проглотить необходимое их количество
Кишечные микроорганизмы непосредственно взаимодействуют с иммунными клетками на внутренней поверхности кишечника, где эпителиальные клетки формируют плотный слой, не позволяющий микробам проникать в кровоток. На этом слое эпителия и располагаются различные иммунные антигенпрезентирующие клетки: дендритные клетки, макрофаги, В-лимфоциты, которые экспонируют чужеродные вещества-антигены.
Бактерии кишечного микробиома не только поддерживают иммунный гомеостаз кишечника, но и влияют на иммунный ответ в других слизистых оболочках. Так, в опытах на стерильных мышах выяснилось, что состав кишечной микробиоты сказывается на способности вируса гриппа размножаться в дыхательных путях. Мыши, лишенные нормального микробиома, быстро заболевали и погибали от инфекции. Оказалось, что вырабатываемый бактериями дезаминотирозин влияет на продукцию легочным эпителием интерферона – белка врожденной системы иммунитета, препятствующего размножению вирусов. Мыши, получавшие до заражения соответствующие бактерии или чистый дезаминотирозин, переносили заболевание легче, чем контрольные животные (Steed, Christophi, Kaiko et al., 2017).
Вероятно, именно бактериальная стимуляция синтеза интерферона объясняет случаи положительного влияния ТФМ на течение COVID‑19. Так, когда двум пожилым пациентам (один с пневмонией, второй с иммунодефицитом) с тяжелым поражением клостридиями провели ТФМ, не подозревая, что они уже были инфицированы коронавирусом, то, к большому удивлению врачей, вирусное заболевание у этих крайне ослабленных больных прошло в очень мягкой форме (Bilinski, Winter, Jasinski et al., 2021).
 ТФМ сегодня успешно используют и при лечении онкологических заболеваний. Как известно, при лейкемии и других гематологических заболеваниях широко применяется пересадка клеток костного мозга, однако у 25–50 % пациентов этот метод вызывает опасную иммунную реакцию «трансплантат против хозяина», которая часто приводит к смерти.
ТФМ сегодня успешно используют и при лечении онкологических заболеваний. Как известно, при лейкемии и других гематологических заболеваниях широко применяется пересадка клеток костного мозга, однако у 25–50 % пациентов этот метод вызывает опасную иммунную реакцию «трансплантат против хозяина», которая часто приводит к смерти.
В этом случае поражаются разные органы, но в первую очередь – кишечник. Дело в том, что перед трансплантацией пациент подвергается воздействию облучения, цитостатиков и антибиотиков, уничтожающих клетки его собственной иммунной системы. Как результат – нарушение состава микробиоты и повреждение кишечного эпителия.
Патологический процесс запускается в результате возникновения порочного круга. Первый фактор его развития – повреждение проницаемости кишечной стенки, что позволяет бактериям выходить в кровоток. Это приводит к высвобождению провоспалительных цитокинов, играющих роль сигналов опасности для иммунной системы. Следующий фактор – введение пациенту донорских клеток костного мозга, которые содержат Т-клетки, готовые атаковать клетки другого организма как чужеродные. Последующая гиперактивация донорских Т-клеток провоспалительными цитокинами хозяина приводит к массивному повреждению тканей пациента, которые начинают генерировать все больше сигналов иммунной опасности. Круг замыкается. Но можно ли его порвать?
Как выяснилось, на вероятность развития патологической реакции и тяжесть заболевания влияет состав кишечной микрофлоры. Оказалось, что у тяжелых пациентов в кишечнике понижена численность бактерий, продуцирующих бутират, способствующий укреплению стенки кишечника.
В клинических исследованиях было показано, что применение ТФМ для восстановления разнообразия кишечной микробиоты приводит к остановке патологической реакции более чем у половины больных. Не помогает эта процедура пациентам с несостоятельной иммунной системой и тем, у кого не прижилась донорская микрофлора (Pession, Zama, Muratore et al., 2021; Bilinski, Jasinski, Basak, 2022).
ТФМ и иммунотерапия рака
ТФМ оказалась полезной и при лечении онкологических больных с помощью препаратов антител – так называемых ингибиторов контрольных точек иммунитета. Эти препараты удалось создать, когда ученые разобрались, почему иммунная система не всегда способна сама уничтожить возникшие раковые клетки.
Все дело в том, что мутировавшие клетки опухли приобретают способность «прятаться» от иммунной системы. Как известно, опасные чужие и свои мутировавшие клетки распознаются Т-клетками иммунной системы и уничтожаются. Но механизмы иммунного ответа нужно регулировать, чтобы не навредить собственным клеткам организма. Некоторые из механизмов такой регуляции активности действия иммунных клеток хорошо изучены.
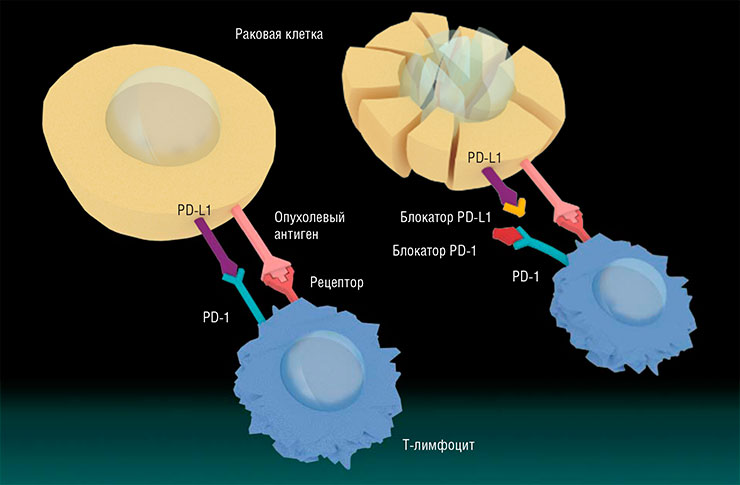
Так, T-клетки несут на своей поверхности рецептор PD1, взаимодействие которого со специальными белками-лигандами (PD-L1, PD-L2) предотвращает развитие чрезмерно сильного иммунного ответа. Опухолевые клетки научились использовать этот сигнальный путь: они производят большое количество белков PD-L1, которые связываются с рецепторами Т-клеток и «выключают» иммунную систему. Известен еще один регуляторный механизм, в котором регулятором иммунной системы является белок CTLA‑4 на поверхности цитотоксических лимфоцитов, но опухоли научились «выключать» и его.
Чтобы не позволить опухоли дезактивировать иммунную систему, было предложено с помощью специальных антител блокировать либо сами опухолевые белки PD-L, либо их рецепторы PD1. Такие моноклональные антитела сейчас широко применяются в терапии рака. Однако оказалось, что помогают они не всем и употребление антибиотиков снижает эффективность терапии.
В опытах на лабораторных мышах было подтверждено, что антибиотикотерапия полностью снимает противоопухолевый эффект антител. В дальнейших исследованиях стерильным мышам с имплантированными опухолевыми клетками пересадили кишечную микрофлору от пациентов, восприимчивых и невосприимчивых к иммунотерапии. Когда животных стали лечить антителами-блокаторами PD‑1, то мыши из первой группы отреагировали на лечение намного лучше, чем их собратья из второй. Другими словами, все дело было в «правильной» кишечной микрофлоре (Modica, Gargari, Regondi et al., 2021).
Эти знания были использованы при лечении больных с метастатической меланомой. Пациентам, у которых иммунотерапия не сработала, была проведена пересадка микробиоты от больных, у которых блокаторы PD‑1 дали хороший эффект. При повторном курсе иммунотерапии треть таких пациентов хорошо отреагировали на лечение, причем у некоторых исчезли все опухолевые очаги. Метод сработал не во всех случаях, вероятно, вследствие несостоятельности иммунной системы пациента либо неудачи в приживлении микробного трансплантата, что иногда случается на практике (Matson, Fessler, Bao et al., 2018).
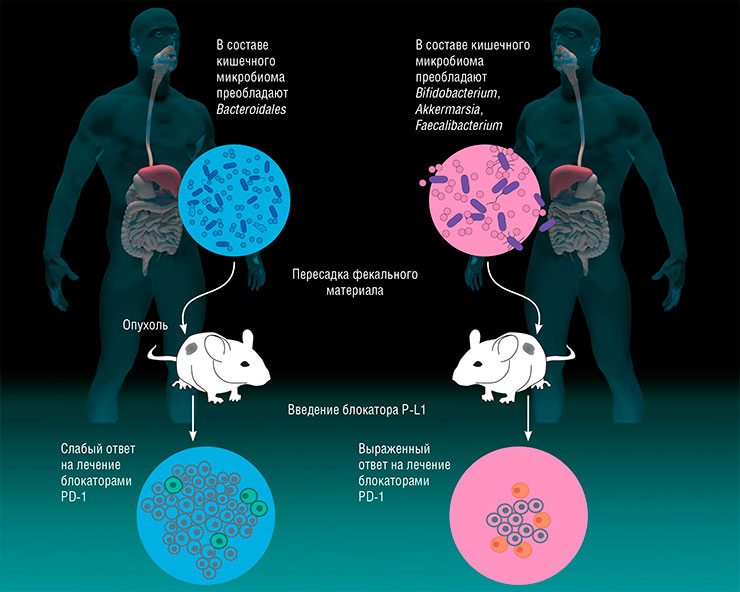
Сегодня ингибиторы контрольных точек используются для терапии разных видов рака (легкого, почек), и ТФМ может найти в этой области широкое применение.
Правда, механизм воздействия микробиома на работу антител пока не совсем ясен. Похоже, на эффективность антител влияют конкретные бактерии, и уже есть некоторые данные о том, какие именно. Так, обнаружены бактерии, стимулирующие образование важных для борьбы с опухолью цитотоксических подтипов Т-клеток (CD8+ IFN-γ+ T cells). У обычных мышей такие клетки имеются в кишечнике, а у мышей, получавших антибиотики, их нет (Sadrekarimi, Gardanova, Bakhshesh et al., 2022).
Выяснилось, что бактерии увеличивают содержание цитотоксических клеток не только в кишечнике, но и в самой опухоли, причем не за счет миграции клеток из кишечника. Самих бактерий в опухоли также не обнаружено. Очевидно, что все дело в бактериальных метаболитах, которые распространяются в организме и повсеместно стимулируют противоопухолевый иммунитет.
У иммунотерапии есть еще она важная проблема, связанная с тем, что антитела-ингибиторы полностью отключают регуляторные механизмы, ограничивающие силу иммунного ответа. В результате иммунная система начинает нападать на собственные клетки организма – ситуация, аналогичная реакции «трансплантат против хозяина». Развиваются аутоиммунные процессы, в том числе самые опасные – повреждения эпителия кишечника, что нарушает его барьерные функции и открывает «ворота» в кровоток для бактерий и их токсинов. Коррекция микробиоты с помощью ТФМ препятствует развитию этих осложнений, в чем и заключается еще один положительный эффект этой процедуры при лечении рака с помощью ингибиторов контрольных точек иммунитета.
Лечим ожирение и мозги?
Вдохновленные результатами применения ТФМ, врачи смело взялись за лечение таких заболеваний, где участие кишечной микрофлоры в развитии патологии было неочевидным, а также болезней с совсем неясной этиологией – а вдруг повезет… Некоторые подобные исследования дали интересные результаты, другие итоги выглядят не вполне убедительными и требуют проверки.
Изучение влияния ТФМ на ожирение началось с сообщения о случайном эксперименте на человеке. Пациентке с тяжелым течением болезни Крона, которая до этого отличалась стройностью, пересадили микробиом ее дочери. Лечение основного заболевания прошло успешно, но женщина начала стремительно полнеть и обнаружила изменения в пищевых предпочтениях: как и ее дочь, она полюбила сладости и булочки, хотя ранее была равнодушна к выпечке (Alang and Kelly, 2015). Этот неожиданный факт вдохновил ученых на детальные исследования (Lee, Sears, Maruthur, 2020).
В экспериментах на лабораторных мышах было обнаружено, что перенос стерильным животным микробиоты от особей с ожирением способствует развитию этой же патологии у мышей-реципиентов. К аналогичному результату привела трансплантация стерильным мышам кишечной микрофлоры от людей с разным телосложением. Мыши, получившие «микробиоту ожирения» (которая, кстати, отличается пониженным разнообразием), за несколько дней ускоренно набирали вес, а те, кому была пересажена микрофлора от доноров с нормальной массой тела, не полнели.
Интересно, что в одном из исследований была проверена возможность «заразности ожирения». Мышей, получивших трансплантацию двух видов микробиоты, разместили в общей клетке, и, поскольку эти грызуны являются копрофагами (поедателями фекалий), так они смогли естественным образом обмениваться кишечными микробами. Обследование, проведенное через несколько дней, показало, что ожиревшие после ТФМ мыши стали худеть, а «худощавые» такими и остались. Оказалось, что у мышей, изначально получивших «дефектную микробиоту», ее разнообразие увеличилось. Другими словами, мыши не «заразились» ожирением от сожителей, а перенос здоровой микробиоты к животным с ожирением нормализовал их вес.
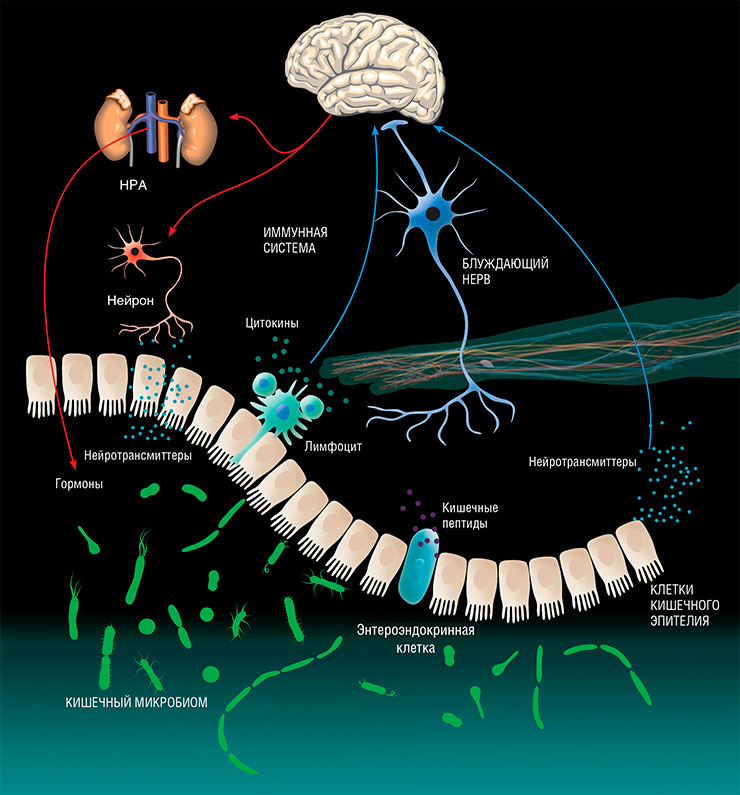
Мозг посылает сигналы для модуляции физиологии кишечника, а сигналы из кишечника, в свою очередь, влияют на настроение и рефлексы. Если понижается содержание глюкозы в крови, мозг включает чувство голода. В здоровом кишечнике бактерии активно синтезируют гормоны, вызывающие хорошее настроение.
Сигналы направляются не только в виде химических веществ, но и через нервную систему. Основная часть «оси кишечник–мозг» – блуждающий нерв, прямо соединяющий центральную нервную систему с внутренними органами и спинным мозгом. Его отростки иннервируют мышечную и эпителиальную часть желудочно-кишечного тракта, влияя на процессы пищеварения и воспаления. Именно через этот нерв идут от кишечника в мозг сигналы насыщения, стресса и т. п. Для этого в эпителии кишечника имеются специальные сенсорные клетки, связанные с блуждающим нервом, которые воспринимают химические сигналы. В соответствии с ними в организме происходит регуляция и такого важного физиологического процесса, как кишечная перистальтика. Энтероэндокринные клетки также несут рецепторные белки, детектирующие бактериальные продукты и при обнаружении опасности активирующие иммунный ответ
К сожалению, результаты клинических исследований на людях оказались не такими многообещающими. У людей с диагнозом «ожирение» после ТФМ менялся микробиом кишечника и улучшалась чувствительность к инсулину, но вес не убывал.
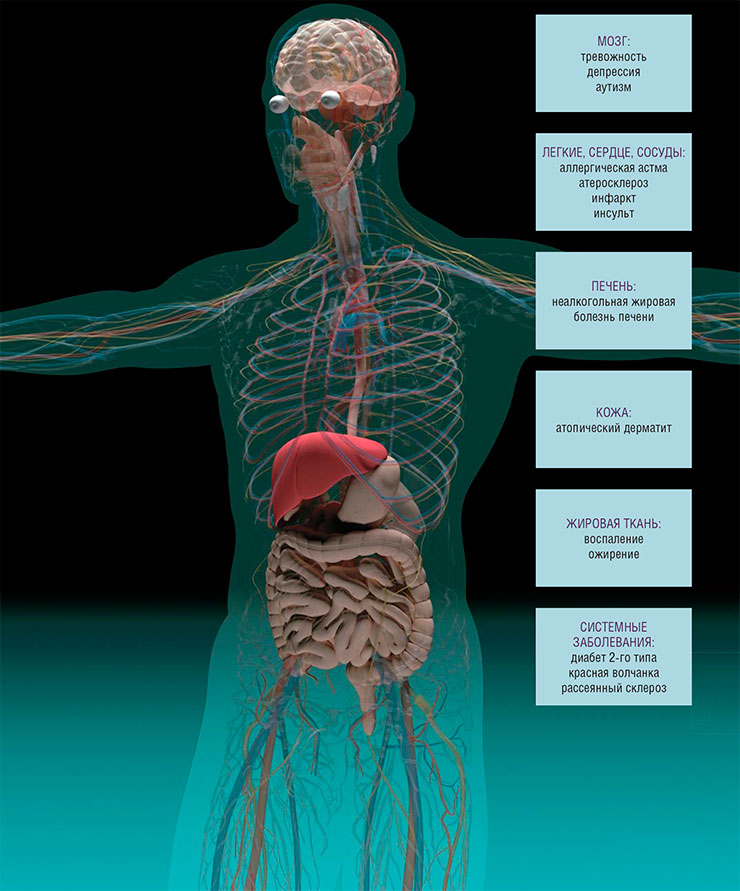
Многочисленные исследования были направлены на изучение возможности ТФМ для лечения заболеваний, связанных с высшей нервной деятельностью. Известно, что при неврологических расстройствах, психиатрических и нейродегенеративных болезнях у пациентов часто наблюдаются и проблемы с кишечником, и аномалии состава кишечной микрофлоры (сниженное разнообразие). Но могут ли подобные нарушения отражаться на функционировании головного мозга?
Известно, что бактерии продуцируют ряд метаболитов, важных для нормального функционирования мозга, таких как гамма-аминомасляная кислота, серотонин, нейропротекторные соединения (например, пропионат, защищающий ткани мозга от воспаления). При дисбиозе уровень этих соединений падает. Дисбиоз и связанные с ним нарушения проницаемости кишечной стенки приводят к поступлению в кровоток бактериальных компонентов и токсических метаболитов, что также способствует развитию воспалительных процессов. Известно, к примеру, что липосахариды клеточной стенки бактерий при введении в кровоток и спинномозговую жидкость оказывают значимый нейровоспалительный эффект.
А иногда в кишечнике поселяются даже такие бактерии, которые продуцируют соединения, напрямую воздействующие на поведение человека. Известны случаи, когда подобные кишечные микроорганизмы перерабатывают углеводы пищи в этиловый спирт, и их носитель, поев картошки или макарон, становится пьяным (синдром автопивоварни, или ферментации кишечника).
Роль микробиома при нарушениях функций нервной системы (психиатрические заболевания, аутизм, депрессия) и возможности коррекции болезненных состояний с помощью ТФМ были изучены на животных моделях и в клинических исследованиях. В результате в лабораторных экспериментах было показано, что коррекция микробиома действительно благотворно сказывается на состоянии мозга, а результаты исследований на людях также вселяют определенные надежды.
К примеру, было известно, что депрессивные состояния развиваются при неправильно работающей системе производства гормона дофамина. Оказалось, что, в отличие от жизнерадостных людей, у страдающих депрессией в кишечнике отсутствуют бактерии родов Coprococcus и Dialister, причастные к метаболизму дофамина. Кроме того, у них увеличено число бактерий, ассоциированных с воспалением кишечника, из-за чего опасные метаболиты могут поступать в мозг, а ведь воспалительные процессы в мозге считают одной из причин развития депрессии (Bastiaanssen, Cussotto, Claesson et al., 2020).
Эти данные были подтверждены с помощью ТФМ в экспериментах на лабораторных мышах. Когда стерильные грызуны получили микробиом от депрессивных пациентов, то также стали демонстрировать явные признаки депрессивного поведения.
Одна из больших медицинских проблем современности – рост больных аутизмом, при том что точная причина расстройств аутистического спектра до сих пор не установлена. Эти неврологические нарушения характеризуются проблемами в общении с другими людьми, ограниченностью интересов, плохой адаптацией к меняющимся условиям, повышенной возбудимостью.
Эксперименты на мышах, являющихся моделями аутизма, показали, что если таким животным перенести микробиоту от нормальных мышей, то у них уменьшается ряд особенностей аутичного поведения, они становятся более коммуникативными.
В других экспериментах нормальным мышам переносили микрофлору от детей с аутистическими расстройствами. В результате у подопытных животных в мозге и тонком кишечнике повышался уровень ряда провоспалительных факторов (IL‑1β, IL‑6, COX‑1, TNF-α), и такие мыши демонстрировали необычное поведение в стандартных поведенческих тестах.
И в этом случае ТФМ может оказать положительное действие. Двухлетние наблюдения над группой пациентов с аутизмом, получающих кишечную микробиоту от здоровых доноров, показало, что за этот период у половины больных тяжесть заболевания заметно снизилась (Li, Chen, Cheng et al., 2021).
Имеются сообщения и об обнадеживающих результатах применения ТФМ для лечения биполярного расстройства. В одном случае пациентке, страдающей тяжелой формой болезни, трансплантировали микробиоту ее здорового мужа. В течение последующих лет она не только смогла отказаться от приема лекарств, но и похудела на 33 кг. ТФМ помогла и молодому человеку, который с юношеских лет болел тяжелой формой биполярного расстройства. В результате симптомы болезни постепенно ослабли, понизилась тревожность и гиперактивность (Parker, Romano, Ansorge et al., 2022).
Еще одно распространенное и пока неизлечимое заболевание, причина развития которого точно не установлена, – болезнь Альцгеймера. Она характеризуется прогрессивным развитием когнитивных и двигательных расстройств и накоплением в мозге специфических патологических белковых комплексов. Считается, что в патогенезе болезни Альцгеймера важную роль играет нейровоспаление, связанное с повышенным уровнем провоспалительных цитокинов. У пациентов с болезнью Альцгеймера также было обнаружено уменьшение разнообразия микробиоты и продукции бутирата, защищающего от воспалительных процессов.
Для исследования возможности применения ТФМ при лечении болезни Альцгеймера генетически модифицированным мышам, служащим моделью этой болезни, пересадили микрофлору от здоровых. В результате у больных мышей улучшились когнитивные способности, уменьшились воспалительные процессы и даже отложения патологических белков в мозге! Есть и сообщения об отдельных случаях, когда у пожилых пациентов, которые получали ТФМ для лечения клостридиальной инфекции, впоследствии отмечалось значительное улучшение умственной активности и памяти (Sun, Xu, Ling et al., 2019).
На мышиных моделях был показан хороший эффект коррекции кишечного микробиома при еще одном нейродегенеративном заболевании – болезни Паркинсона, при котором нарушенная микрофлора также не обеспечивает синтез нужного количества короткоцепочечных жирных кислот для поддержания нормальной проницаемости кишечной стенки и уровня противовоспалительных цитокинов.
ТФМ для побед в спорте и над старостью
И конечно, исследователи не могли обойти проблему долгожительства. На роль кишечной микрофлоры в старении указывал еще сам великий русский и французский биолог И. И. Мечников (1903), который в рассуждениях о взаимоотношениях человека и его микробов писал, что болезни и старение вызываются накапливающимися в кишечнике токсинами и что «усилить сопротивление благородных клеток и превратить дикую кишечную среду в культивируемую – таковы достижимые средства для продления жизни человеческой».
Известно, что состав кишечного микробиома при старении меняется. Когда ученые пересаживали фекальную микробиоту молодых (3–4 месяца) мышей старым (19–20 месяцев) и наоборот, то у старых животных улучшались способности к обучению и они становились более общительными, что может отражать снижение уровня тревожности.

Исследователи также утверждают, что, судя по данным анализа функций ряда генов, пересадка «молодой» микробиоты старым мышам замедлила изменения, связанные со старением иммунной системы, а также мозга. И напротив: перенос молодым мышам «старого» микробиома негативно отразился на слизистой оболочке их кишечника; у них также наблюдалось развитие воспалительных явлений в мозге, а в глазах повысился уровень белков, связанных со старческой дегенерацией сетчатки. Перенос же микробиоты от обычных молодых мышей животным, служащим моделями быстрого старения, заметно (на 13 %) удлинял их жизнь (Barcena, Valdes-Mas, Mayoral et al., 2019; Parker, Romano, Ansorge et al., 2022).
Недавние исследования выявили интересную особенность микробиома у людей-долгожителей, которые перешли столетний рубеж. Известно, что важным продуктом деятельности бактерий являются «вторичные» желчные кислоты, которые бактерии производят из желчных кислот, поступающих в кишечник. Оказалось, что у всех обследованных долгожителей в кишечнике повышено содержание изолитихоловой кислоты (iso-LCA) и некоторых других желчных кислот, производимых бактериями из семейства Odoribacteraceae. Такие желчные кислоты способны эффективно убивать токсические бактерии: возможно, именно эти соединения, защищая организм человека, обеспечивают ему более комфортное существование и долголетие (Rimal and Patterson, 2021).
Характеристики микробиома могут определять не только наше старение, но и физическую форму. Но когда специалисты по спортивной медицине исследовали влияние интенсивных физических нагрузок на состав микробиома спортсменов в надежде найти особенности, способствующие высоким результатам, то не обнаружили микробного «допинга». При этом выяснилось, что у спортсменов высокого класса разнообразие кишечной микрофлоры больше, чем у начинающих (Liang, Zhang, Peng et al., 2019). Впрочем, такие различия могли быть обусловлены не физическими нагрузками, а различиями в питании.
Более интересные результаты получены при изучении влияния состава микробиома кишечника на силовые характеристики мышц. Дело в том, что исследование пожилых людей показало, что их физическая сила коррелирует с содержанием определенных микробов в кишечнике. Ученые провели стерильным мышам трансплантацию микробиома от пожилых силачей и слабосильных стариков (Fielding, Ravi, Jasuja et al., 2019). Через месяц после пересадки у животных проверили силу хвата: мыши цеплялись за решетку, прикрепленную к прибору, а экспериментаторы тянули их за хвост, пока те могли держаться; измерялась сила, с которой приходилось тянуть мышь. На дорожке животных заставляли бежать с разной скоростью, замеряли время, за которое они могут продолжать бег. Оказалось, что мыши с микробиомом от сильных доноров хватались на 6,4 % сильнее тех, которым трансплантировали микрофлору от слабых. Выяснилось, что все дело в бактериях, синтезирующих короткоцепочечные жирные кислоты, такие как бутират. Эти вещества с противовоспалительным действием при введении в рацион животных способствуют и наращиванию мышечной массы.

Установлено, что при очень длительных сильных нагрузках у супермарафонцев в их микробиоме снижается количество бактерий-продуцентов бутирата, что, вероятно, и служит причиной нарушения иммунитета и роста заболеваемости у этих спортсменов (Sato and Suzuki, 2022). Чтобы помочь им восстановиться, специалисты ФМБА России предложили после тяжелых нагрузок пересаживать спортсменам их собственную микрофлору, собранную перед соревнованиями.
Есть сведения и об экспериментах по применению ТФМ для лечения алкоголизма. Сначала их объектами были лабораторные грызуны: оказалось, что пересадка микробиоты от обычных животных снижает тягу к спиртному у алкогольно-зависимых и наоборот. Также было установлено, что склонность к алкогольным напиткам у человека действительно связана со специфическими изменениями кишечного микробиома, такими как высокая численность актинобактерий (Segovia-Rodriguez, Echeverry-Alzate, Rincon-Pérez, 2022).
Вдохновленные полученными результатами, специалисты начали пересаживать алкоголикам фекальную микрофлору непьющих сограждан. В одном из таких клинических испытаний все его участники с тяжелым алкогольным расстройством и циррозом печени, которых никакими способами не удавалось отлучить от спиртного, сообщили о снижении влечения к выпивке. ТФМ благотворно подействовала и на общее состояние здоровья пациентов, и на их когнитивные способности. В контрольной группе из получавших «плацебо» меньше стали выпивать лишь 30 % (Bajaj, Gavis, Fagan et al., 2021). Правда, антиалкогольный эффект от ТФМ сохранялся недолго, но, поскольку эта терапия абсолютно безопасна, ее можно повторять в любой момент при появлении первых признаков тяги в спиртному.
Лекарство или биопродукт?
Первоначально процедура ТФМ проводилась в клиниках США и других стран без ограничений со стороны регуляторов, поскольку ее риски незначительны и крайне редки. Однако в какой-то момент чиновники Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) объявили, что фекальная микробиота – это лекарство, потому она должна пройти полный цикл испытаний, полагающийся для терапевтического препарата.
Идея чиновников вызвала протесты как медицинского сообщества, так и пациентов, так как была абсурдна. Во‑первых, микробиота фекалий не имеет постоянного состава и в этом смысле в принципе не соответствует критериям определения терапевтического препарата. Во-вторых, ограничение на применение эффективного метода лечения заболевания, от которого ежегодно умирают тысячи людей, является неприемлемым из гуманистических соображений. В-третьих, контролировать использование ТФМ практически невозможно, поскольку сама процедура не очень сложна и может проводиться в любой клинике, пожелавшей игнорировать запреты FDA.
В результате чиновники отступили, и с 2013 г. FDA разрешила применять ТФМ для лечения рецидивирующей клостридиальной инфекции без оформления каких-либо специальных документов. Центры, планирующие ТФМ в случае других заболеваний, обязали получать разрешение на применение этого метода как на экспериментальное лечение.
ДОНОРСТВО: ИНДИВИДУАЛЬНЫЙ ПОДХОД Один из ключевых компонентов технологии ТФМ – выбор доноров. Конечно, их следует искать среди здоровых людей, кишечная микробиота которых не содержит опасных микроорганизмов.Дело в том, что еще в ходе экспериментальных исследований было несколько случаев заражения пациентов при проведении ТФМ опасными бактериями, два человека умерли. Это произошло из-за того, что доноры не были должным образом обследованы, а пациенты страдали тяжелыми заболеваниями и их иммунная система была подавлена.
Поскольку ТФМ бывает успешной не всегда, высказывались соображения о возможности существования «супердоноров», микробиом которых способен оказывать наибольший терапевтический эффект. Однако никаких существенных различий в составе микробиоты между обычными здоровыми донорами обнаружить не удалось.
Также обсуждался вопрос о том, не следует ли готовить комбинированные препараты микробиоты, объединяя материал разных доноров, чтобы добиться наибольшего разнообразия кишечной микробиоты. Однако эксперименты не выявили особых преимуществ подобных препаратов.
Тем не менее исследователи пришли к выводу, что при ТФМ не работает подход «одна композиция микробов подходит всем». У разных людей сформированы свои сообщества микробов, и они взаимодействуют с иммунной системой. Микробиомы донора и реципиента могут быть совместимыми и формировать устойчивое сообщество, но иногда этого не происходит. В последнем случае возникают проблемы во взаимодействиях между разными бактериями или нового микробного сообщества и иммунной системы реципиента. Важны и рационы питания реципиента и донора, оказывающие большое влияние на структуру кишечной микрофлоры.
Здесь необходим персонализированный подход: донор и реципиент, очевидно, должны соответствовать по каким-то определенным параметрам друг другу, однако на настоящий момент не хватает фундаментальных знаний, чтобы дать достоверный прогноз в конкретном случае
Окончательно вопрос о статусе ТФМ американским регулятором пока не решен. Эксперты настаивают на том, что кишечная микробиота не имеет постоянного состава, является продуктом человеческого организма и не может рассматриваться как лекарство. Они считают, что FDA должна регулировать применение микрофлоры аналогично тому, как это делается в случае с человеческими органами и тканями.
Многие другие страны последовали примеру США. В европейских странах и Австралии ТФМ используется как инновационная терапия кишечных заболеваний. В израильском Медицинском центре Хадасса ТФМ применяется для лечения пациентов, страдающих от синдрома раздраженного кишечника, неспецифического язвенного колита, болезни Крона, псевдомембранозного энтероколита и других заболеваний, вызванных нарушением работы кишечных бактерий.
В этой клинике и в другом крупнейшем медицинском центре Израиля – Клинике Шиба – ТФМ практикуется в терапии онкологических больных. Микробиом пациентов, отвечающих на лечение ингибиторами контрольных точек, о которых говорилось выше, вводят пациентам, которым эти антитела не помогли.
В России в настоящее время ТФМ может применяться для коррекции состава микробиома пациентов, если другие методы лечения не работают и медицинский совет клиники уверен, что проблема пациента заключается в дисбиозе.
От клизмы – к нанотехнологиям
В настоящее время ТФМ проводится с помощью цельного донорского материала, включающего все компоненты микробиома. Состав этого материала нестабилен и, очевидно, содержит много лишнего. Однако врачи не могут ждать, пока ученые разберутся в сложностях микрофлоры и создадут охарактеризованные микробные биотехнологические препараты, и ТФМ применяется все шире с использованием доступных технологий и донорского материала.
 В 2013 г. в США был учрежден первый банк кишечной микробиоты OpenBiome, который уже поставил в американские больницы сотни тысяч образцов микробиоты для лечения рецидивирующей клостридиальной инфекции. Но это лишь начало истории.
В 2013 г. в США был учрежден первый банк кишечной микробиоты OpenBiome, который уже поставил в американские больницы сотни тысяч образцов микробиоты для лечения рецидивирующей клостридиальной инфекции. Но это лишь начало истории.
Так, сейчас американские компании Finch Therapeutics и Rebiotix работают над созданием на основе донорского материала высокотехнологичных средств для лечения клостридиальной инфекции, язвенного колита, болезни Крона и аутизма. А компания Seres Therapeutics уже разработала продукт SER‑109 в виде капсул для перорального приема для лечения клостридиальной инфекции. В капсулах содержится консорциум бактерий, выделенных из донорского материала, в котором обработкой этанолом убито большинство патогенных микроорганизмов, но сохранены жизнеспособные споры бактерий преимущественно типа Firmicutes, конкурирующих с клостридиями. Другой продукт этой же компании, SER‑155, также созданный на основе донорского материала, предназначен для борьбы с развитием реакции «трансплантат против хозяина» у больных, получивших пересадку клеток костного мозга.
Американская компания Vedanta Biosciences также разрабатывает на основе фекальной микробиоты средства для лечения клостридиальной инфекции, и для увеличения эффективности иммунотерапии при меланоме, раке желудка и толстой и прямой кишки. Специалисты этой компании пытаются создать искусственные терапевтические сообщества микробов, чтобы уйти от использования донорского материала.
Бактерии кишечника способны защищать организм от радиационного поражения, как показали эксперименты по облучению мышей. При этом погибает большинство животных, но не все. Пересадка фекальной микробиоты особей, выживших после облучения, другим продемонстрировала, что лучше всего защищают от радиации бактерии семейства Lachnospiraceae, а также Enterococcus faecalis и Lactobacillus rhamnosus, интенсивно производящие короткоцепочечные жирные кислоты (бутират, ацетат и пропионат), важные для поддержания кишечного эпителия и функционирования иммунной системы. Введение животным таких штаммов бактерий доказало их высокое радиопротективное действие. Результаты этого исследования важны для лучевой терапии опухолевых заболеваний (Guo, Chou, Lai et al., 2020)Будущее – за искусственными консорциумами микроорганизмов, которые можно нарабатывать в условиях чистого производства в контролируемых условиях. Один из препаратов этого класса, VE800, который разрабатывается Vedanta Biosciences, состоит из 11 штаммов бактерий и предназначен для применения в схеме иммунотерапии рака. А другой, VE707, будет препятствовать колонизации кишечника патогенными лекарственно-устойчивыми бактериями.
Огромные перспективы использования кишечных микроорганизмов в медицине очевидны, и неудивительно, что в исследования кишечной микробиоты вложились такие известные предприниматели-миллиардеры, как Билл Гейтс и Марк Цукерберг.
Один из проектов компании Vedanta Biosciences, финансируемых Фондом Билла и Мелинды Гейтс, направлен на разработку препарата на основе кишечной микрофлоры, который можно использовать при борьбе с недоеданием у детей в развивающихся странах. Как выяснилось, у истощенных детей разрушенная кишечная микрофлора не обеспечивает эффективного усвоения питательных веществ, и их часто не удается спасти, даже когда они начинают полноценно питаться. Специалисты считают, что правильно подобранные штаммы бактерий помогут решить эту проблему.
И все-таки для того, чтобы конструировать эффективные бактериальные лекарства на основе определенных штаммов бактерий, фундаментальных знаний пока не хватает. Ведь даже для простейшего случая – бактериального лечения клостридиальной инфекции – конкретные механизмы терапевтического действия донорской микрофлоры еще не установлены.
До сих пор не вполне изучены и все компоненты кишечного микробиома, ведь лечебный эффект могут оказывать не только бактерии. При ТФМ пациенту переносят сложную смесь живых бактерий, архей, грибов и вирусов, а также готовые продукты их жизнедеятельности, и каждый из этих компонентов может быть терапевтически эффективным. К примеру, исследования вирома (вирусной составляющей микробиома – совокупности вирусов, включая бактериофаги, вирусы бактерий) кишечника здоровых людей показали его невероятное разнообразие и существенные индивидуальные особенности (Fujimoto, Kimura, Allegretti et al., 2021). Также выяснилось, что даже не содержащие живых бактерий фильтраты кишечного содержимого, в которых могут находиться бактериофаги и бактериальные метаболиты, в некоторых случаях оказывают терапевтическое действие на больных с клостридиальной инфекцией.
Эффективность ТФМ для конкретного пациента, очевидно, также зависит и от его иммунной системы, которая у каждого человека уникальна. Есть данные, что в успешных случаях терапии клостридиальной инфекции с помощью ТФМ в кишечнике пациентов повышается уровень интерлейкина IL‑25, контролирующего иммунные реакции организма и уменьшающего воспалительное повреждение тканей.
Несмотря на заметные успехи в изучении кишечной микробиоты человека, некоторые важные фундаментальные вопросы до сих пор остаются не вполне разрешенными. Одним из них является степень устойчивости и наследуемости микробиоты, т. е. зависимость ее состава и структуры от генов индивида и «среды»: диеты, образа жизни, принимаемых лекарств.
Известно, что кишечный микробиом индивида мало меняется со временем и даже способен переживать удары, наносимые инфекциями или приемом антибиотиков. Отсюда первоначально был сделан вывод, что микробиом определяется преимущественно генетическими факторами и, сформировавшись сразу после рождения, остается неизменным в течение всей жизни человека. Однако в детальных исследованиях было показано, что зависимость характеристик микробиоты от генов индивида если и существует, то невелика по сравнению с влиянием средовых факторов.
Чем же тогда обеспечивается относительная стабильность микробиома? Вероятно, его состав действительно формируется на базе исходной композиции микроорганизмов, полученных при рождении, в условиях взаимодействия с иммунной системой и под влиянием диеты, которой придерживается человек.
ТФМ В РОССИИ В России впервые трансплантация фекальной микрофлоры была проведена в 2014 г. в Новосибирске, в Центре новых медицинских технологий Института химической биологии и фундаментальной медицины СО РАН. Технология показала хорошие результаты при лечении язвенного колита, псевдомембранозного колита, рецидивирующей клостридиальной инфекции, синдрома раздраженной кишки, метаболического синдрома, антибиотик-ассоциированной диареи.В 2017 г. в клинической больнице № 123 (Федеральный научно-клинический центр физико-химической медицины ФМБА России, Москва) была начата исследовательская программа по лечению воспалительных заболеваний кишечника и антибиотик-ассоциированной диареи с помощью ТФМ. В НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой (Санкт-Петербург) ТФМ применяется в схеме лечения онкологических пациентов для предотвращения развития реакции «трансплантат против хозяина»
В таком сложном микрокосме связанных между собой организмов каждая из функций осуществляется несколькими взаимозависимыми участниками. Очевидно, что такой консорциум будет иметь определенную устойчивость к внешним воздействиям.
Отсюда вытекает несколько следствий. Например, трудно ожидать, что попавшая в кишечник «случайная» бактерия имеет высокие шансы стать членом микробиома. Все нужные функции там и так успешно выполняются, а новый сосед, если ему не удастся установить взаимовыгодные связи с другими обитателями, просто не сможет выжить в недружественном окружении. Именно это происходит с бактериями «живых» йогуртов и пробиотиками: входящие в их состав микроорганизмы «съедаются» дружным коллективом кишечного микробиома.
Также понятно, почему так трудно перестроить организм на питание, существенно отличающееся от привычного. Для усвоения новых продуктов нужны новые микробы, способные их утилизировать, и при этом они должны быть дружественны «аборигенам». Можно предположить, что такая ситуация возникает при принципиальной смене диеты, например, когда спортсмены переходят с обычной углеводной диеты на кетогенную. У счастливчиков, у которых уже есть эффективная комбинация микроорганизмов для переработки жиров, смена диеты проходит гладко. А вот остальным приходится довольно долго испытывать проблемы со здоровьем. Все налаживается к тому времени, когда, очевидно, поступающие извне микроорганизмы собираются в нужную комбинацию, которая сможет ужиться с хозяйским микробиомом.
Мощным методом, позволяющим быстро вносить изменения в микробиом кишечника, является ТФМ. Ведь при этой процедуре пациенту вносится не отдельный микроорганизм, имеющий малые шансы на приживление, а готовый микробиологический консорциум, включающий в себя хорошо сработавшиеся подмножества микроорганизмов со своими функциями. «Здоровый» микробиом может полностью заменить дефектный, либо в составе последнего приживутся микробные сообщества, способные выполнять работу, с которой не справлялся исходный хозяйский микробиом.
Очевидно, пересадка фекальной микрофлоры будет применяться все шире как для лечения заболеваний, так и для повышения качества жизни людей. За этим простым и эффективным методом большое будущее.
Литература
Говорун В. М. Мы и наши микробы // НАУКА из первых рук. 2020. № 2 (87). С. 22–35.
Fielding R. A., Reeves A. R., Jasuja R. et al. Muscle strength is increased in mice that are colonized with microbiota from high-functioning older adults // Exp. Gerontology. 2019. V. 127. 110722.
Guglielmi G. How gut microbes are joining the fight against cancer // Nat. 2018. V. 557. P. 482–484.
Lee C. J., Sears C. L., Maruthur N. Gut microbiome and its role in obesity and insulin resistance // Ann. N. Y. Acad. Sci. Special Issue: Year Diabetes Obesity. 2020. V. 1461, N. 1. P. 37–52.
Matson V., Fessler J., Bao R. et al. The commensal microbiome is associated with anti–PD-1 efficacy in metastatic melanoma patients // Sci. 2018. V. 359. N. 6371. P. 104–108.
Steed A. L., Christophi G. P., Kaiko G. E. et al. The microbial metabolite desaminotyrosine protects from influenza through type I interferon // Sci. 2017. V. 357 (6350). P. 498–502.