Нобелевская премия по химии 2017. Разработка криоэлектронной микроскопии
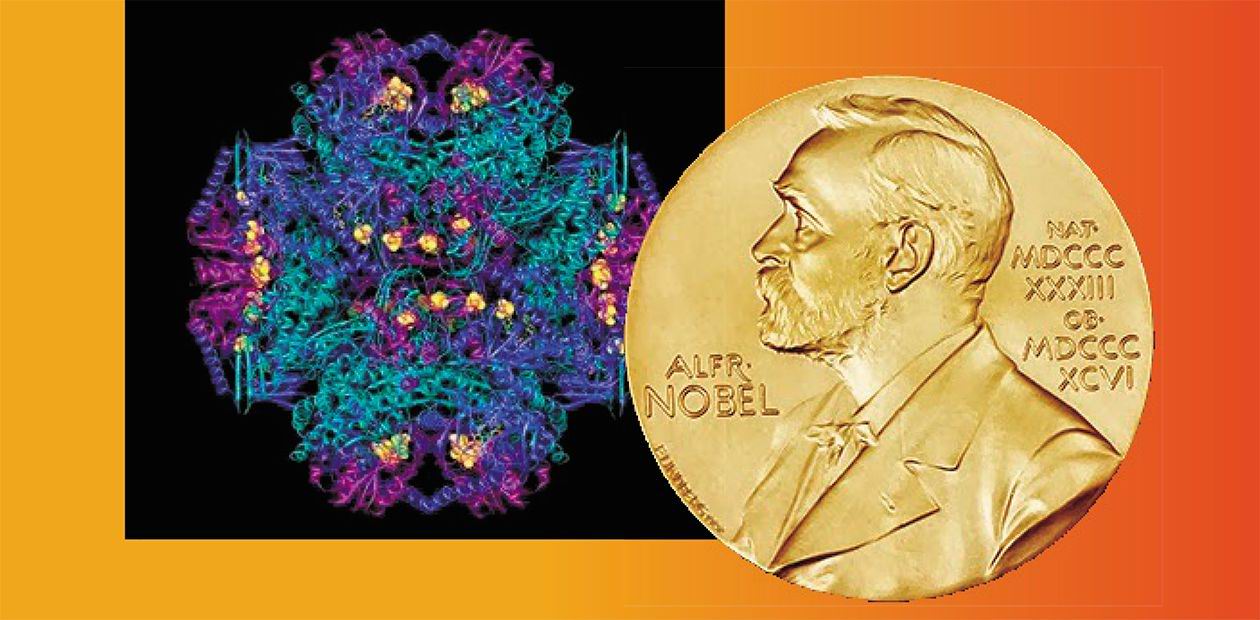
Нобелевскую премию по химии в этом году получили Жак Дюбоше, Иоким Франк и Ричард Хендерсон за разработку криоэлектронной микроскопии для определения структуры молекул с высоким разрешением в растворе. Это событие прокомментировала доктор биологических наук, руководитель группы микроскопических исследований Института химической биологии и фундаментальной медицины СО РАН, профессор Елена Ивановна Рябчикова
Нобелевский комитет по химии утверждает, что «метод криоэлектронной микроскопии перевел биохимию в новую эру» – это цитата с церемонии. Бесспорно, этот метод открыл для ученых новые возможности, он мощный и прорывной. Для многих решение Нобелевского комитета по химии выглядит несколько странным, все-таки химия – наука о веществах и их применении. С другой стороны, неплохо отметить развитие метода, который, действительно позволяет исследовать структуру макромолекул и других биологических объектов в нативном состоянии. Не нужно думать, что криоэлектронная микроскопия – только микроскоп. Прежде всего, это – комплекс сложных и дорогостоящих процедур подготовки образцов, требующий высокой квалификации исследователя. Три нобелевских лауреата, Жак Дюбоше, Иоким Франк и Ричард Хендерсон внесли свой вклад в совершенствование метода.
Человечество всегда стремилось разглядеть окружающий мир лучше. Вся микроскопия базируется на линзах Левенгука и оптической системе микроскопов Гука, созданных в XVII в. Микроскоп Левенгука позволил ему открыть мир микроорганизмов, а микроскоп Гука – клетки. Позже появилась световая микроскопия, где объекты освещались при помощи лампы, и относительно недавно – электронная микроскопия.Электронная микроскопия стала необходимым инструментом ученых, работающих в разных областях, в том числе биологов. Но в электронном микроскопе нельзя изучать клетки и другие объекты без предварительной обработки, поскольку образец подвергается действию пучка электронов, вакуума и высоких температур. Предварительная обработка, несомненно, влияет на тонкую структуру, и перед исследователями стояла задача разработать метод изучения объектов в нативном состоянии. Метод замороженных срезов, используемый в световой микроскопии, был одной из основ разработки аналогичного метода для электронной микроскопии. Суть криоэлектронной микроскопии – изучение в электронном микроскопе замороженных образцов. Воздействие высокой температуры в криоэлектронном микроскопе нивелировали охлаждением образца жидким азотом, а вот проблема кристаллизации воды при замораживании потребовала отдельного решения.
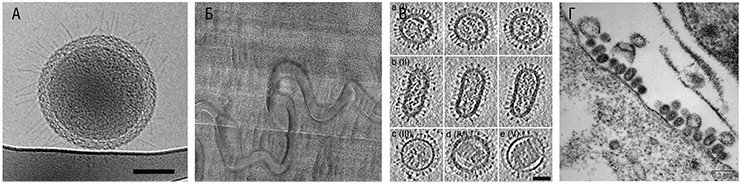
Кристаллы воды повреждали структуру образца, и Жак Дюбоше в 80-х годах предложил использовать быстрое охлаждение воды, чтобы она, минуя фазу кристаллизации, переходила в стеклообразное (витрифицированное) состояние. Такая вода не только предохраняет образец от разрушения в вакууме, но и не рассеивает электроны.
Второй лауреат, Иоахим Франк, в 1980-х г. разработал метод построения трехмерных структур изучаемых объектов на основе обработки полученных с помощью электронного микроскопа двумерных изображений – электронно-микроскопическую томографию. Этот метод применяется не только для анализа биологических объектов, но и в других областях науки.
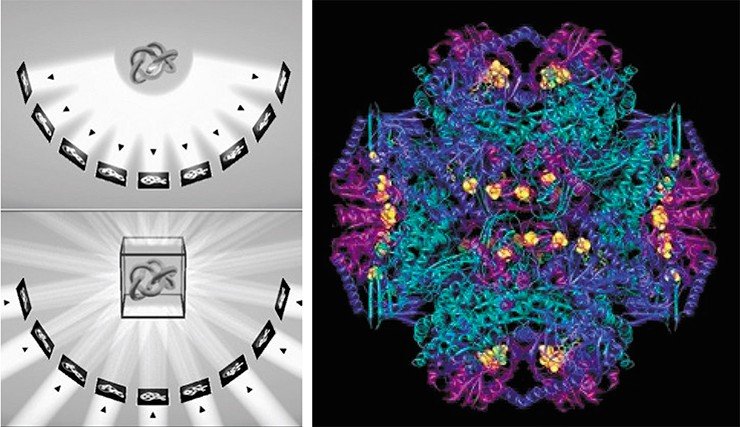
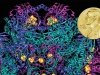
Третий лауреат, Ричард Хендерсон, в 1990 г. первым получил с помощью криоэлектронного микроскопа трехмерное изображение белка родопсина с разрешением на атомарном уровне. Для того времени – большое достижение, в настоящее время опубликованы реконструкции множества белков. Особую ценность криэлектронная томография имеет для понимания строения белков сложной формы, в первую очередь – мембранных, которые нельзя изучать методом рентгеноструктурного анализа.
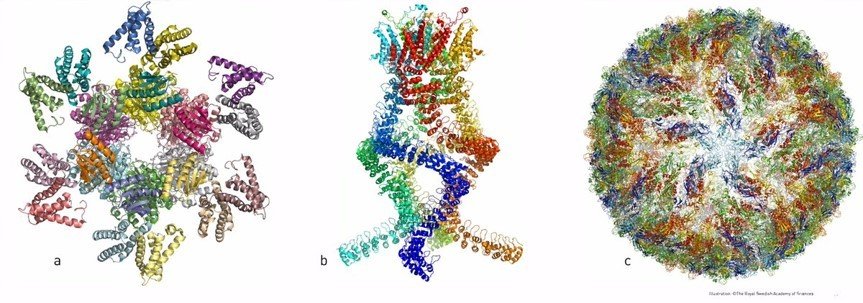
Криоэлектронная микроскопия отражает комплекс технических и теоретических разработок и, несомненно, является одним из самых передовых методов клеточной и молекулярной биологии. Приборная база этого метода совершенствуется и требует высокой квалификации исследователей, а также постановки адекватных задач.
Подготовила Татьяна Морозова