Биорегуляторы регенерации – работают в малых дозах
Как известно, способности человека к восстановлению травмированных тканей и органов по сравнению с нашими меньшими братьями весьма ограничены. Ведь даже среди холоднокровных позвоночных встречаются такие «асы регенерации», как тритоны, легко восстанавливающие утерянный хвост или конечность. Шансов отрастить оторванный палец у человека нет, но тем не менее многие наши ткани, такие как соединительная, эпителиальная и костная, успешно восстанавливаются при повреждении. Клеточными источниками регенерации служат либо еще недифференцированные стволовые клетки, либо клетки, которые «теряют» свою специализацию и превращаются в другие клеточные типы. Однако механизмы этих процессов до сих во многом остаются неясными.
Коллективу московских биологов и химиков удалось выделить из тканей различных высших организмов (растений, таких как подорожник и столетник, а также грибов и животных) группу регуляторов белковой природы, которые при применении их в сверхмалых дозах способны запускать регенеративные процессы в месте повреждения. На их основе были разработаны терапевтические препараты, часть из которых уже успешно применяется в медицинской практике при повреждениях роговицы глаза и суставного хряща, обеспечивая восстановление полноценной здоровой ткани.
У позвоночных животных имеется два клеточных источника регенерации, благодаря которым в поврежденных тканях восстанавливается полный набор дифференцированных клеток. Во-первых, это так называемые мультипотентные стволовые клетки, т. е. недифференцированные клетки, способные превращаться в любые специализированные клетки тканей и органов; во-вторых, уже дифференцированные клетки, которые «теряют» свою специализацию и редифференцируются, т. е. превращаются в другие, востребованные на данный момент клеточные типы (Карлсон, 1986; Stocum, 1995, 2006).
Но хотя механизмы подобной дифференцировки в настоящее время активно изучаются, вопросы о природе и путях прохождения сигналов, поступающих к клеточным источникам регенерации, остаются во многом неясными. Однако доказано, что во всех этих механизмах регенерации важную роль играют биорегуляторы белковой природы.
В результате многолетней работы группе исследователей из московских Института биологии развития им. Н. К. Кольцова РАН и Института элементоорганических соединений им. А. Н. Несмеянова РАН под руководством профессоров В. П. Ямсковой и И. А. Ямскова удалось выделить из тканей различных высших организмов новую группу биорегуляторов, которые запускают регенеративные процессы в поврежденной ткани при применении их в сверхмалых дозах («рабочий» диапазон их концентраций – 10–7—10–15 мг белка/мл) (Ямсков и др., 2009; Ямскова и др., 2009, 2012).
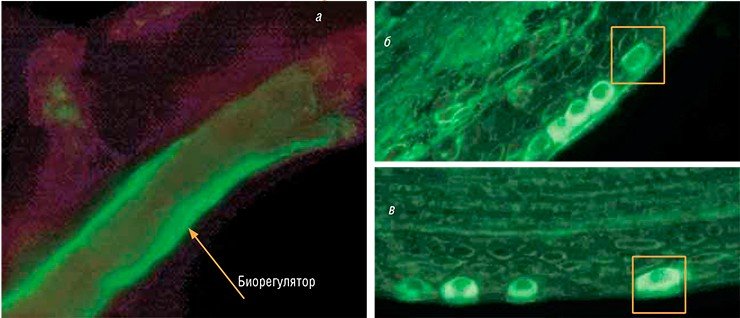
Такие низкие концентрации сразу вызывают ассоциации с гомеопатическими препаратами, однако это ложное представление. Принцип гомеопатии – лечить подобное подобным: гомеопатическое вещество в большой концентрации вызывает патологию, в сверхмалой же дозе эту патологию лечит. Механизм действия новых биорегуляторов, представляющих собой пептидно-белковые комплексы, совершенно иной и определяется их своеобразными физико-химическими свойствами, в том числе достаточно неупорядоченной вторичной структурой фрагментов белковых цепей (Ямскова и др., 2010, 2012).
Комплексы образуют в растворах удивительно большие частицы размером 50—300 нм, что не способен делать ни один из известных белков. К примеру, даже довольно «крупный» гликопротеид фибронектин, состоящий из двух полипептидов, формирует в растворе частицы размером всего около 9 нм. Такие большие супрамолекулярные образования оказываются более устойчивыми к действию различных физических и химических факторов, поэтому и способны «работать» в сверхмалых дозах. При разрушении этих частиц до составных компонентов регуляторы теряют свою биологическую активность (Ямскова и др., 2009).
Не дать шанса рубцу
Для того чтобы понять действие биорегуляторов, рассмотрим процессы, происходящие в ткани при повреждении. Помимо массовой гибели клеток в этом случае происходит нарушение макромолекулярных структур межклеточного пространства, межклеточных взаимодействий и развитие воспаления из-за накопления продуктов тканевого распада. Регенерация может пойти двумя путями: либо с образованием соединительнотканного рубца, либо с полным восстановлением морфологической структуры ткани. Обычно, и особенно при повреждениях глубоких слоев ткани, события развиваются по первому варианту; второй не успевает реализоваться потому, что процессы, приводящие к образованию дифференцированных клеток, идут намного медленнее.
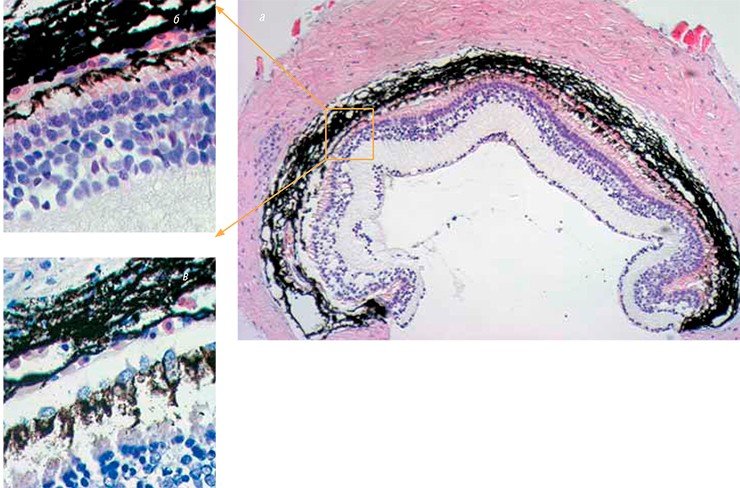
Для того чтобы в области дефекта произошла полная регенерация структуры без образования фиброзного рубца, необходимо удалить погибший клеточный материал и купировать воспаление. В регуляции следующего этапа восстановления ключевыми моментами являются, с одной стороны, контроль над пролиферацией соединительнотканных элементов, которые стремятся быстро заполнить образовавшийся дефект, с другой – стимуляция деления и дифференцировки клеток, необходимых для восстановления полноценной тканевой структуры (Ямскова и др., 2010).
Экспериментальные исследования показали, что при любых повреждениях ткани, независимо от природы повреждающего агента, увеличивается секреция биорегуляторов, которые начинают стимулировать все клеточные источники регенерации, начиная с мультипотентных стволовых клеток. Они также могут направлять дальнейшую дифференцировку коммитированных клеток, которые уже «продвинулись» на пути превращения в определенный клеточный тип, а также воздействовать на уже дифференцированные клетки, заставляя их увеличивать выработку белков, необходимых для восстановления межклеточного матрикса. Биорегуляторы поддерживают и жизнеспособность уцелевших зрелых клеток, например, через блокировку негативных сигналов, вызывающих апоптоз (клеточное «самоубийство») (Ямскова и др., 2012).
В реальной ситуации действие биорегуляторов может нивелироваться из-за развития воспалительного процесса, но если обеспечить постоянный внешний приток подобных веществ и не дать развиться воспалению, можно добиться полного восстановления структуры ткани. Нужно добавить, что процесс заживления в присутствии биорегуляторов происходит в те же сроки, что и без него, поскольку они влияют в основном не на скорость, а на качество этого процесса.
Почему подорожник лечит?
Оказалось, что пептидно-белковые регуляторные комплексы – довольно консервативная группа веществ, которые присутствуют практически во всех высших организмах. Они были выделены из различных тканей животных, растений и грибов. Кстати сказать, подобные работы на растениях начались с попытки ответить на вопрос, за счет чего давно любимый в народной медицине подорожник обладает ранозаживляющим действием.
И действительно, из подорожника обыкновенного (как и из не менее известного растения-целителя столетника – алоэ древовидного) были выделены белковые вещества с биорегуляторной активностью. В экспериментах нанесение фракций таких биорегуляторов на раны лабораторных мышей приводило к очень хорошим результатам – активной эпителизации раневой поверхности и восстановлению потовых желез в подкожно-жировой клетчатке. Правда, при этом сильно разрасталась жировая ткань, и не образовывались волосяные фолликулы (Краснов и др., 2011). Что и неудивительно – разве кто-нибудь когда-нибудь видел «волосатые» растения?
Если же говорить серьезно, то результаты этих опытов свидетельствуют об относительной универсальности действия биорегуляторов, способных «работать» в организмах из разных таксономических групп.
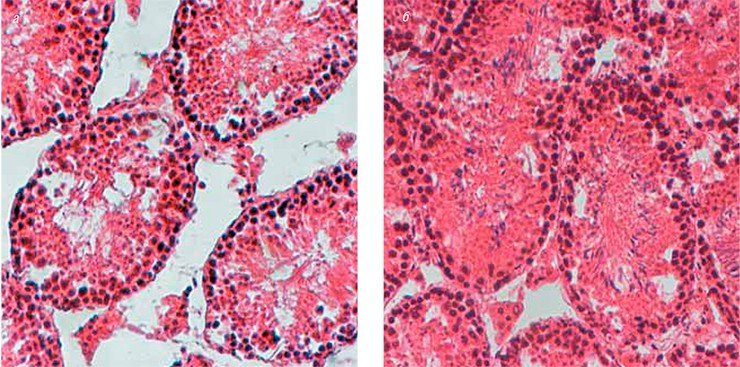
Регуляторные же пептиды, полученные из тканей животных, имеют близкие молекулярные массы, но одновременно обладают высокой тканевой специфичностью. Это означает, что биорегулятор, выделенный, к примеру, из сетчатки глаза, будет способствовать регенерации только этого органа и не будет действовать на печень, и наоборот. С другой стороны, биорегулятор из сетчатки будет оказывать влияние на ткань мозга, поскольку и тот и другой орган относятся к нейральной ткани и происходят из одного зародышевого листка. В последнем случае эффекты биорегуляторов из разных органов могут немного перекрываться. Кстати сказать, таксономический ранг испытуемого животного также не играет особой роли: к примеру, биорегулятор из сетчатки быка будет способствовать регенерации поврежденной сетчатки тритона.
В любом случае биорегуляторы не оказывают отрицательного воздействия на ткань, в том числе и на «чужую». Единственный вариант, при котором наблюдалось небольшое ухудшение регенерации – это одновременное воздействие двумя биорегуляторами, полученными из разных тканей.
Такой опыт был проведен при лечении экспериментальной травмы роговицы у кролика. На поврежденный участок наносили биорегулятор, полученный из роговицы, который способствует эпителизации, а также биорегулятор из сыворотки крови, стимулирующий восстановление эндотелия – слоя клеток, выстилающих заднюю поверхность роговицы.

Оказалось, что оба эти препарата становятся абсолютно неэффективными, если использовать их совместно в одном растворе. Причина этого, вероятно, связана с образованием «неправильных» частиц. Но при последовательном применении обоих препаратов с интервалом в 15—20 мин. был достигнут хороший результат – лучший, чем при использовании известного препарата Баларпан, широко применяемого для лечения роговицы (Константиновский и др., 2012).
С минимальными затратами
В состав регуляторных белково-пептидных комплексов, как видно из названия, входят регуляторные пептиды и белки модуляторы. Происхождение пептидов пока точно не установлено, но, предположительно, они являются продуктом ферментативного разложения различных белков, присутствующих в межклеточном пространстве. На сегодняшний день обнаружено структурное сходство между белком цГМФ-фосфодиэстераза из сетчатки быка и регуляторными пептидами пигментного эпителия глаза, адгезивным белком P-кадгерином и сывороточным регуляторным пептидом, а также между сигнальным G0 белком и пептидом из мозговой ткани быка (Ильина и др., 2013).
Однако для остальных регуляторных пептидов пока известна только молекулярная масса, первичная же аминокислотная последовательность не расшифрована. Подобно белкам адгезии, представленным повторяющимися консервативными участками, в случае регуляторных пептидов в их структуре, очевидно, повторяются одни и те же аминокислотные фрагменты, которые в разных тканях просто «собираются» в разные белковые структуры. Что и неудивительно: зачем создавать что-то заново, если можно обойтись комбинациями уже имеющегося материала?
Механизмы регуляции действия пептидно-белковых комплексов также только начинают изучаться. Но уже известно, как работают белки-модуляторы, которые представляют собой разные изоформы известного белка – сывороточного альбумина, которые немного различаются между собой по аминокислотному составу.
Кстати сказать, обнаружение этих соединений само по себе является удивительным и новым фактом: раньше считалось, что альбумин присутствует в организме только в сыворотке крови. Сейчас мы знаем, что он также имеется во всех межклеточных пространствах, хотя альбумины из разных тканей и различаются между собой. Расшифровка части аминокислотной последовательности одной из изоформ альбумина «межклеточного» происхождения подтвердило ее отличие от коммерческого препарата альбумина, получаемого из бычьей сыворотки. Последний оказался не способен образовывать комплексы с регуляторными пептидами.
Эксперименты показали, что сами по себе модуляторы не проявляют биологической активности, а пептиды начинают самостоятельно «работать» только в высоких концентрациях. Функция биорегулятора восстанавливалась лишь тогда, когда две эти фракции объединялись. Таким образом, роль белков-модуляторов заключается, скорее всего, именно в формировании высокоактивного комплекса с пептидами. Если же концентрация белка-модулятора будет слишком велика, он будет подавлять активность пептидов (Ямскова и др., 2012).
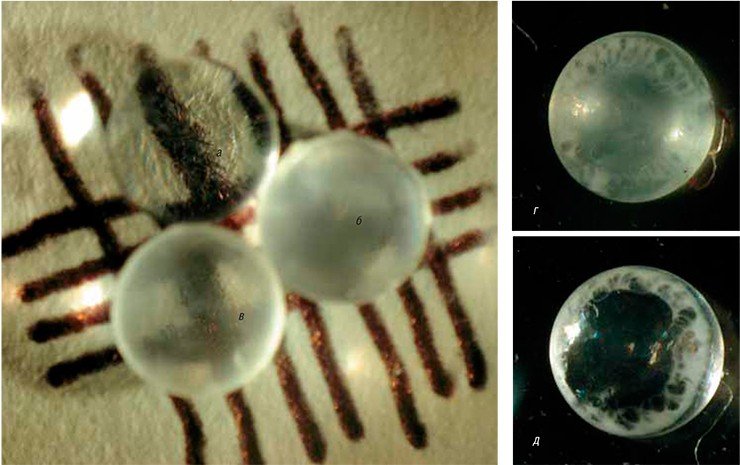
Как упоминалось выше, биорегуляторы становятся активными только в низкой концентрации. Исключение составляет биорегулятор, получаемый из сыворотки крови. Как было обнаружено в экспериментах по регенерации конечностей у амфибий, в высоких концентрациях он обладает морфогенетическим действием (Тучкова и др., 1992). Так, у тритонов, у которых поврежденные конечности полностью восстанавливаются даже у взрослых особей, добавление этого биорегулятора не оказывало видимого влияния на процесс регенерации. Однако у лягушек, особи которых после метаморфоза теряют способность к нормальной регенерации, добавление сывороточного биорегулятора в высоких концентрациях способствовало отрастанию настоящих конечностей с пальцами, хотя и не полноценных (Краснов и др., 2009).
Лекарства для глаз и суставов
На основе результатов исследований биорегуляторов ведется разработка перспективных терапевтических препаратов. В современном регистре лекарственных средств России уже появились препараты «Адгелон – глазные капли», использующиеся при повреждениях роговицы любой этиологии, и «Адгелон – раствор для инъекций», предназначенный для лечения повреждений суставного хряща.
Клинические исследования глазных капель «Адгелон» показали, что у больных с ожогом роговицы быстрее купировались болевые ощущения, воспалительная реакция и чувство инородного тела в глазу, возрастала интенсивность эпителизации, уменьшались изъязвления и перфорации роговицы (Ченцова и др., 2008).
Хорошие результаты были получены и при лечении «Адгелоном» больных с посттравматической рецидивирующей эрозией роговицы, у которых он оказывал стимулирующее действие уже в ранние (через 2–4 дня применения) сроки. У 83 % таких пациентов через две недели лечения происходило полное восстановление эпителия, в том числе его прозрачности. Через три месяца состояние таких больных оставалось по-прежнему хорошим, тогда как в контрольной группе у половины наблюдались дефекты эпителия.
Особо следует упомянуть действие глазного «Адгелона» при пересадке роговицы. При использовании этого препарата процесс эпителизации и формирование полноценного рубца без излишнего разрастания соединительной ткани и воспаления шло в полтора-два раза быстрее обычного. В результате у прооперированных пациентов в конечном итоге повышалась степень прозрачности трансплантата и острота зрения.
Суммируя все эти клинические наблюдения, препарат «Адгелон» можно охарактеризовать как достаточно эффективное лекарственное средство, оказывающее выраженную стимуляцию восстановительных процессов при различных травматических поражениях роговицы (Гундорова и др., 1997). Он положительно влияет на весь комплекс патологических симптомов, снижая выраженность воспалительной реакции, степень помутнения роговицы и способствуя формированию тонкого и нежного рубца.
Не менее эффективным оказался и препарат «Адгелон – раствор для инъекций». Инъекции этого препарата непосредственно в сустав при повреждении суставного хряща и надколенника способствовали восстановлению поврежденной ткани после купирования острой фазы воспаления. В результате на месте повреждения формировался плотный гиалиновый хрящ, соответствующий здоровой ткани. Кроме того, препарат способствует снижению содержания лизосомальных ферментов в синовиальной жидкости, т. е. является своего рода хондропротектором, а также обеспечивает стойкое купирование болевого синдрома и, соответственно более быстрое восстановлене функций конечности (Неверкович и др., 1995, 1996, 1997).
За три десятилетия исследования биорегуляторов регенерации удалось не только изучить состав, физико-химические свойства и сферу действия пептидно-белковых комплексов из разных тканей, но и разработать терапевтические препараты на их основе. К настоящему времени сам исследовательский коллектив утратил права на два официально зарегистрированных препарата, но благодаря усовершенствованию технологии производства ему удалось разработать более эффективные аналоги этих продуктов.
К сожалению, перед исследователями, как и для всей отечественной науки, встают финансовые проблемы, связанные с регистрацией и клинической апробацией новых препаратов. Тем не менее, до первой стадии клинических испытаний на людях уже удалось довести четыре препарата на основе биорегуляторов, выделенных из сетчатки, пигментного эпителия, хрусталика и склеры глаза быка. Эти средства предназначены для лечения наиболее распространенных глазных патологий, таких как катаракта, миопия и макулодистрофия, связанная с нарушением центрального зрения.
Литература
Краснов М. С., Ямскова В. П., Маргасюк Д. В. и др. Изучение новой группы биорегуляторов, выделенных из подорожника большого // Прикладная биохимия и микробиология. 2011. Т. 47. № 2. С. 146—153.
Краснов М. С., Рыбакова Е. Ю., Тихонов В. Е и др. Противоожоговое действие композиции, содержащей хитозановый гель и биорегулятор сыворотки крови // Клеточные технологии в биологии и медицине. 2012. № 2. С. 79—83.
Краснов М. С. Ямскова В. П., Березин Б. Б. и др. Исследование биорегулятора, выделенного из семенников крыс, на модели роллерного органотипического культивирования семенников мыши in vitro // Клеточные технологии в биологии и медицине. 2014. № 1. С. 63—67.
Рыбакова Е. Ю., Краснов М. С, Ямскова В. П и др. Физико-химические свойства биологически активных в микродозах регуляторных белков, выделенных из различных тканей млекопитающих // Изв. РАН. Сер. хим. 2009. № 3. С. 623—628.
Ямскова В. П., Краснов М. С., Ямсков И. А. Наноразмерные биорегуляторы тканей глаза млекопитающих как основа для фармакологических препаратов нового поколения. М.: Макс Пресс, 2009. 84 с.
Ямскова В. П. Скрипникова B. C., Молявка А. А и др. Структурно-функциональные особенности нового биорегулятора, выделенного из ткани пигментного эпителия глаза быка // Биохимия. 2009. Т. 74. № 9. С. 1195—1203.
Ямскова В. П., Краснов М. С., Ямсков И. А. К вопросу о механизмах, лежащих в основе процессов восстановления и репарации в тканях // Клеточные технологии в биологии и медицине. 2010. № 1. С. 32—35.
Ямскова В. П., Краснов М. С., Ямсков И. А. // Новые экспериментальные и теоретические аспекты в биорегуляции. Механизм действия мембранотропных гомеостатических тканеспецифических биорегуляторов. Saarbrucken: Lambert Academic Publishing. 2012. P. 36.