Рекордсмен регенерации среди млекопитающих
Регенерация – поистине будоражащее воображение слово, когда речь идет о восстановлении утраченной части тела или органа. На ум сразу приходит былинный Змей Горыныч, с легкостью заменяющий потерянные головы, или, ближе к реальности, саламандра, «чемпион по регенерации» среди животных, способная восстанавливать не только лапы или хвост, но и глаза и даже сердце. Человек, как и другие теплокровные, о подобном может лишь мечтать.
Но и среди млекопитающих, обладающих в целом крайне низкими способностями к регенерации, имеются исключения. И это – иглистые мыши, мелкие грызуны, которые могут не только заживлять огромные раны на коже, но и восстанавливать спинной мозг после разрыва! Как им это удается? Почему остальные млекопитающие не умеют так же эффективно справляться с повреждениями? Может ли человек «научиться» у иглистых мышей такой полезной суперспособности? В обзорной статье молодого российского исследователя читатель сможет найти ответы на эти вопросы
Что такое регенерация? Строго говоря, восстановление поврежденных тканей и органов можно разделить на репарацию и регенерацию. Первая приводит к образованию рубца на месте повреждения, который обеспечивает целостность органа, но не функций. Регенерация, напротив, дает практически полное восстановление как исходной архитектуры, так и функции органов.

У большинства млекопитающих, в том числе и у человека, способности к регенерации сильно ограничены. У пациентов, которые получили обширные травмы или подверглись хирургическим операциям, восстановление обычно идет именно по пути репарации: в месте повреждения формируется «заплатка» из клеток соединительной ткани и дезорганизованного межклеточного материала, что ведет к потере функции этой области и зачастую вызывает хронические боли.
Изучение животных, которые обладают выдающимися способностями к регенерации, может подсказать нам, как достигнуть «правильного» заживления повреждений у человека.
Вверх по лестнице, идущей вниз
Если проследить способность к регенерации по эволюционному древу, то окажется, что чем сложнее организм, тем она хуже (Brewer, 2018). Одни из самых примитивных многоклеточных – губки – могут буквально собрать себя заново, даже если их раскрошить на отдельные клетки. А многие беспозвоночные, такие как черви, медузы, кораллы и иглокожие, могут восстановить организм из фрагмента тела.
Широко известна способность к регенерации конечностей и хвостов у амфибий. Но чем выше по эволюционному древу, тем ситуация плачевнее. В чем причина? Почему это, казалось бы, крайне полезное свойство с точки зрения естественного отбора утрачивается в ходе эволюции? Причины неясны. Остается открытым и вопрос, являются ли эти ограничения адаптивными или же они закрепились в разных эволюционных ветвях случайным образом.
На самом деле у тех же позвоночных дела с регенерацией обстоят не так уж плохо. В принципе, регенерировать умеют все: от рыб до птиц и млекопитающих. Но есть одна загвоздка: большинство из них способно к этому лишь на ранних стадиях своего развития.

Яркий пример потери возможности регенерации с возрастом – восстановление фаланг пальцев у человека. Известно, что у детей, примерно до 12 лет, могут отрасти ампутированные концевые фаланги вместе с ногтевой пластиной, что у взрослых невозможно. Точные причины того, почему способность к регенерации падает с течением времени, еще предстоит установить.
Лучше всего среди позвоночных регенерируют во взрослом состоянии рыбы и амфибии. Например, хвостатые амфибии (саламандры и тритоны) могут заново отращивать конечности, восстанавливать внутренние органы, нервную систему и даже хрусталик глаза, благодаря чему они и стали излюбленными объектами в исследованиях регенерации (Song et al., 2010).
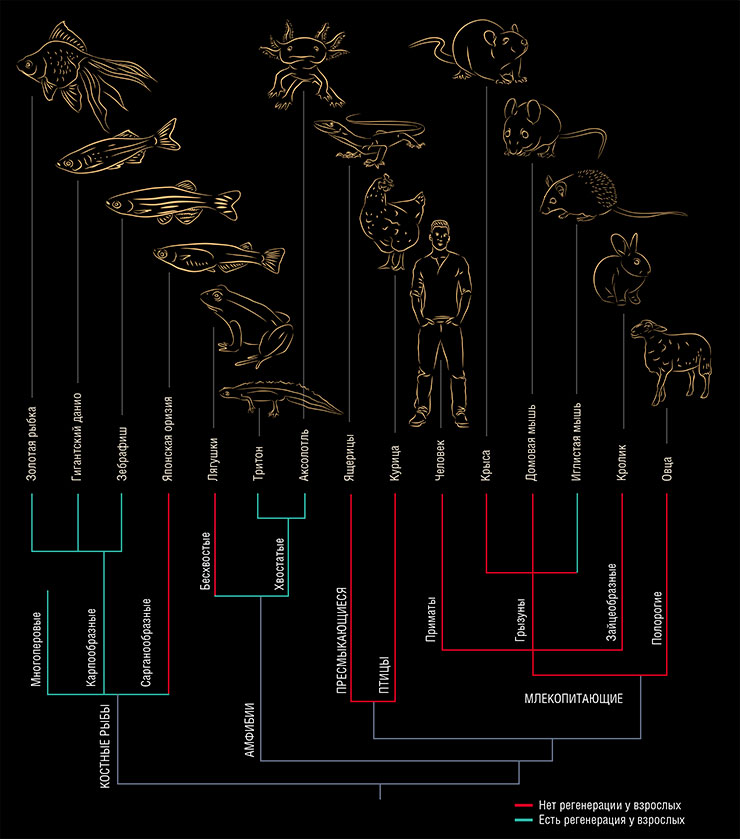
У рептилий широко известен феномен регенерации хвоста после его «добровольного» отбрасывания (аутотомии) при защите от хищников. Но такая регенерация, кстати, не совсем настоящая: вновь отросший хвост не будет иметь «нормальной» иннервации, а также позвонков – их место займет удлиненная хрящевая трубка.
Что касается человека, то уже с древних времен было известно о возможности регенерации печени у взрослых – вспомним миф о Прометее и Зевесовом орле. Восстановление этого органа идет путем так называемой компенсаторной гипертрофии, за счет увеличения числа или объема клеток. К сожалению, остальные внутренние органы не могут похвастаться такой способностью.
При этом среди млекопитающих есть немногочисленные примеры поистине неординарных способностей к регенерации. К примеру, домовые мыши лабораторной линии MRL/MpJ и родственных ей линий. Эти животные умеют восстанавливать сквозные повреждения ушной раковины, а также кожу, суставы и роговицу глаза. Интересно, что такая способность у них возникла спонтанно и изначально не служила критерием отбора при создании линии. Среди возможных причин ее появления – изменения в регуляции клеточного цикла и более слабый воспалительный ответ на повреждение (Heydemann, 2012).

Однако даже выдающиеся таланты этих линейных мышей меркнут по сравнению с достижениями «рекордсменов по регенерации» среди млекопитающих – иглистых мышей.
Все началось с хвоста
Иглистых мышей содержат в качестве лабораторных и декоративных животных с начала прошлого века, что неудивительно: эти грызуны активны, любопытны и легко привыкают к людям, которые за ними ухаживают. Однако их поразительные способности к регенерации были замечены всего несколько лет назад.
Все началось с того, что у иглистых мышей было обнаружено очень необычное свойство – аутотомия, при которой часть тела отбрасывается в качестве защитной реакции (Seifert et al., 2012). Среди позвоночных аутотомия очень редка и обычно выражается в отбрасывании хвоста с переломом позвонков (истинная аутотомия, как у ящериц) либо потерей шкуры на хвосте (ложная аутотомия, как у тушканчиков и сонь) (Dubost, Gasc, 1987).

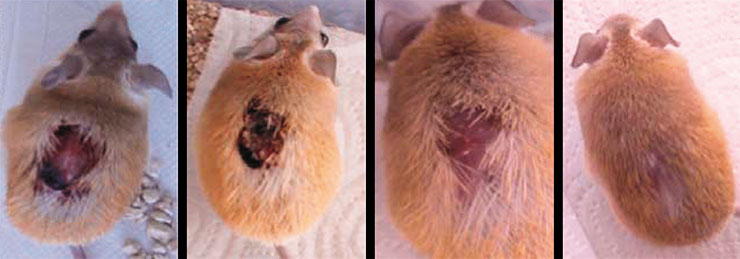
Иглистые мыши также могут отбрасывать хвосты, но, в отличие от рептилий, они у них не восстанавливаются, поэтому поднимать этих животных за хвост, как делают с обычными мышами, – плохая идея (Shargal et al., 1999). Аутотомия иглистых мышей заключается в отбрасывании лоскутов кожи на спине, которая сама по себе очень непрочная и может легко порваться, если животное кто-то схватит. Кровотечение при таком повреждении минимально (Pinheiro et al., 2018).
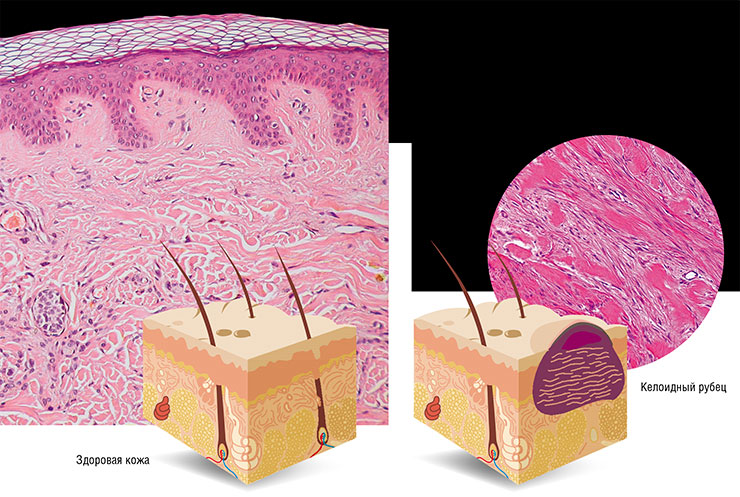
В коже мышей не были найдены какие-то специальные зоны, по которым она бы отделялась, подобно тому как это происходит при отбрасывании кожи у гекконов и сцинков (Seifert et al., 2012). Ее хрупкость обусловлена особыми свойствами межклеточного матрикса, который, с одной стороны, непрочен и позволяет кожным лоскутам легко отделяться, с другой – способствует заживлению в месте повреждения. Раневая поверхность быстро затягивается эпителием, а затем на ней полностью восстанавливаются волосяные фолликулы, железы, мышечный слой и другие составные части кожного покрова.
В результате травмированное место полностью регенерирует без образования рубца. Причем создается впечатление, что во время восстановления оно не доставляет животным какого-либо беспокойства: они продолжают двигаться и питаться как обычно (Seifert et al., 2012).

Во-первых, иглистые мыши – полупустынные животные, адаптированные к жизни в сухом климате и на малопитательном корме. Из-за экономии влаги они выделяют очень концентрированную мочу: уровень мочевины достигает 4,8 м/л – это одни из самых высоких значений среди млекопитающих. Поэтому иглистых мышей используют в исследованиях в области физиологии мочевыделительной системы (Shkolnik, Borut, 1969).
 Организм этих мелких млекопитающих отличается высокой эффективностью использования питательных веществ. Уровень метаболизма у них на 25–30 % ниже, чем ожидалось с учетом размера, а у вида A. russatus – вообще один из самых низких среди грызунов (Degen, 2013).
Организм этих мелких млекопитающих отличается высокой эффективностью использования питательных веществ. Уровень метаболизма у них на 25–30 % ниже, чем ожидалось с учетом размера, а у вида A. russatus – вообще один из самых низких среди грызунов (Degen, 2013).
Еще одно следствие жизни на скудном корме – пониженное выделение инсулина в ответ на приемы пищи (Rabinovitch et al., 1975). В результате в неволе, при свободном доступе к жирной высококалорийной пище, иглистые мыши склонны к развитию ожирения. И не только к нему: на такой диете у животных развивается гипергликемия и гиперплазия бета-клеток островков Лангерганса, которые в дальнейшем дегенерируют. Другими словами, у них развивается сахарный диабет 2‑го типа, что позволяет использовать иглистых мышей в качестве удобной животной модели этой патологии (Shafrir et al., 2006).
У иглистых мышей есть еще одна удивительная особенность: это единственные грызуны, у самок которых случается менструация. В конце 11‑дневного эстрального цикла у них происходит отторжение эндометрия (внутреннего слоя матки), сопровождающееся кровотечением. И это открывает возможности использования иглистых мышей в качестве модели при изучении женской репродуктивной биологии (Bellofiore et al., 2018).
 Беременность у них длится 39 дней, что значительно дольше, чем у других грызунов. Рождаются покрытые шерстью мышата с открытыми глазами и слуховыми проходами. Их мозг уже достаточно развит, вскоре после появления на свет они способны питаться твердой пищей и могут покидать гнездо, в отличие от детенышей мышей и крыс, неспособных самостоятельно передвигаться после рождения. Поэтому иглистые мыши стали удобным объектом и для исследований развития мозга и нейропластичности, а также в бихевиористике (D’Udine, Alleva, 1988; Cohen et al., 2010)
Беременность у них длится 39 дней, что значительно дольше, чем у других грызунов. Рождаются покрытые шерстью мышата с открытыми глазами и слуховыми проходами. Их мозг уже достаточно развит, вскоре после появления на свет они способны питаться твердой пищей и могут покидать гнездо, в отличие от детенышей мышей и крыс, неспособных самостоятельно передвигаться после рождения. Поэтому иглистые мыши стали удобным объектом и для исследований развития мозга и нейропластичности, а также в бихевиористике (D’Udine, Alleva, 1988; Cohen et al., 2010)
Для выяснения молекулярной основы этого феномена ученые проанализировали протеом (совокупность всех произведенных белков) и транскриптом (совокупность всех считанных с ДНК молекул РНК, включая белковые «матрицы» и регуляторные РНК) в местах повреждения кожи у иглистой и домовой мыши. В результате были обнаружены значительные видовые различия в активности генов (Brant et al., 2015; Simkin, Seifert, 2018).
По сравнению с домовыми мышами, у иглистых в месте ранения снижен уровень молекулярных факторов, провоцирующих воспаление, таких как цитокины Il6, Cxcl3, Ccl12, Ccl7, Il1b. Кстати сказать, различается и состав иммунных клеток: в большом количестве присутствуют противовоспалительные макрофаги М2, а их «антиподов» макрофагов М1 и нейтрофилов, напротив, мало. Все это указывает на уникальные иммунные реакции в месте повреждения (Brant et al., 2015).
Анализ протеома и транскриптома также показал, что в результате повреждения кожи у иглистых мышей активировались гены, связанные с развитием мышц в ходе эмбриогенеза. Таким образом, восстановление подкожных мышц идет, возможно, по тому же пути, что и при их развитии у плода. У животных был также отмечен активный синтез таких ферментов, как матричные металлопротеиназы, участвующих в перестройке межклеточного вещества, а вот производство коллагенов I и III типов, связанных с образованием рубца, оказалось пониженным (Gawriluk et al., 2016).
Когда «вынесен» мозг…
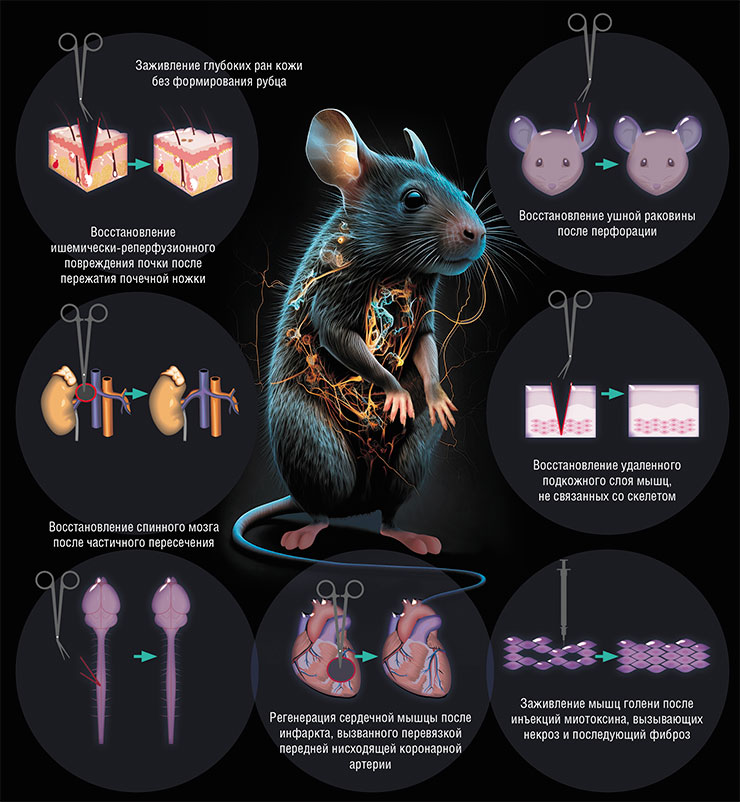
После открытия аутотомии быстро выяснилось, что способности иглистых мышей заживлять большие повреждения не ограничиваются кожей. В ходе исследований им травмировали самые разные органы: прокалывали ушные раковины, вводили токсины в мышцы, моделировали инфаркт миокарда, вызывали острое и хроническое повреждение почек. Картина была везде одна и та же: иглистые мыши блестяще справлялись со всеми повреждениями!
Особый интерес с теоретической и практической точек зрения представляет способность иглистых мышей регенерировать нервную систему. Ведь если в отношении способности к регенерации млекопитающие – худшие из худших среди позвоночных, то их нервная система – самая худшая среди всех систем и органов. Так, у человека повреждения центральной нервной системы часто ведут к необратимой потере ее функций, и сегодня в мире живет около 80 млн людей с инвалидностью, полученной из-за травм головного или спинного мозга (Sofroniew, 2014).
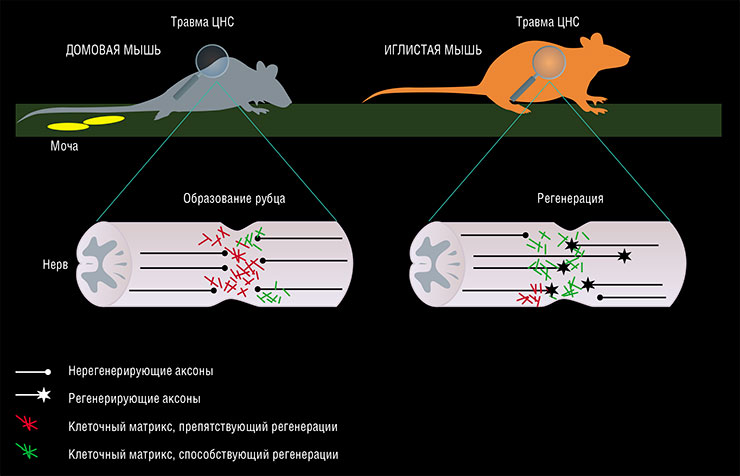
Травма центральной нервной системы обычно приводит к развитию астроцитарного рубца, который формируется астроцитами – глиальными («обслуживающими») клетками мозга. С одной стороны, это защитная реакция, направленная на поддержание оставшихся нервных клеток, с другой – помеха, затрудняющая рост аксонов (длинных, проводящих нервные импульсы отростков нейронов) и препятствующая восстановлению функций нервной ткани (Sofroniew, 2014).
Реализация наследственной информации в живом организме осуществляется от ДНК к РНК, от РНК – к белку. Соответственно, существует иерархия или связка дисциплин: геномика изучает геном и гены; транскриптомика – синтез и распределение транскриптов (молекул РНК); протеомика – совокупность белковых молекул; метаболомика – набор всех метаболитов, образующихся в результате биохимических реакцийПоскольку у иглистых мышей рубцы при регенерации кожи не формируются, было высказано предположение, что астроцитарные рубцы у них также не образуются. Это подтвердилось при изучении травм спинного мозга у данных животных (Streeter et al., 2020).
Оказалось, что в ответ на повреждение спинного мозга иглистые мыши демонстрируют уникальный образец активности генов в астроцитах и клетках соединительной ткани (фибробластах). Состав межклеточного матрикса в месте повреждения у иглистых мышей также значительно отличается по сравнению с домовыми мышами: содержание компонентов, обеспечивающих рост и поддержание новых аксонов, выше, а препятствующих этому, напротив, ниже.
Среди таких первых компонентов – кератансульфаты, сульфатированные полисахариды, которые есть в костной и хрящевой ткани, роговице глаза. В мозге эти химические соединения участвуют в регуляции роста клеточного цитоскелета и поддержании формы клеток, транспорте и хранении нейромедиаторов, посредством которых осуществляется передача нервного импульса, в росте аксонов и образовании новых синапсов.
В месте повреждения спинного мозга у иглистых мышей резко возрастает содержание фермента b3gnt7 – важнейшего для синтеза кератансульфатов. Ученые задались вопросом: можно ли «приручить» этот фермент, чтобы он работал и в других организмах, облегчая рост новых аксонов и заживление спинальной травмы? Ответ оказался положительным, и первые шаги на этом пути уже сделаны.
Ген B3GNT7, кодирующий этот фермент, удалось заставить работать в клетках линии CHO (культуре клеток яичника китайского хомячка). Нейроны человека, которые культивировали на «подложке» из этих клеток, демонстрировали очень активный рост отростков, в том числе аксонов (Nogueira-Rodrigues et al., 2022). Так что ген B3GNT7 теоретически можно использовать для лечения спинальной травмы.
Хорошая новость в том, что этот ген есть и у человека, но его нужно как-то заставить работать в организме активнее, чем обычно. Для этого дополнительные копии гена B3GNT7 можно доставлять в место повреждения с помощью генетических векторов, к примеру, аденоассоциированных вирусов. Работа этих «лишних» генов будет обеспечивать рост новых аксонов и восстановление функций спинного мозга. Так что открытие генов иглистой мыши, ответственных за регенерацию спинного мозга, может привести к разработке принципиально нового подхода к лечению травм позвоночника – генной терапии.
Огромный интерес представляет восстановление головного мозга. Известно, что источником возобновления утраченных клеток могут быть нейрональные стволовые клетки, из которых образуются как нейроны, так и обслуживающие глиальные клетки. У взрослых млекопитающих эти клеточные предшественники находятся в двух зонах, расположенных в гиппокампе и боковой стенке желудочков мозга.
Оказалось, что у иглистых мышей в этих зонах в несколько раз больше стволовых и делящихся клеток по сравнению с домовыми мышами. Такая большая численность нейрональных стволовых клеток может говорить о том, что эти грызуны обладают повышенными регенеративными возможностями и в отношении головного мозга, что открывает широкое поле для исследований (Maden et al., 2021).

Сегодня мы знаем, что иглистые мыши могут эффективно восстанавливать обширные повреждения кожи, сердца, почек, скелетной мускулатуры и спинного мозга.
Уникальные иммунные реакции, особое строение межклеточного матрикса, включение «эмбриональных» генов – вот, похоже, те главные особенности, которые позволяют иглистым мышам легко справляться даже с тяжелыми повреждениями. И в этом смысле они представляют огромный интерес для регенеративной медицины.
Изучение молекулярных механизмов регенерации у этих животных поможет найти гены и сигнальные пути, которые можно будет использовать в качестве мишеней при лечении различных повреждений, и в итоге создать революционные методы лечения травм у человека. Ведь само существование млекопитающих, к которым в ходе эволюции вернулась способность к регенерации, свидетельствует об отсутствии принципиального запрета на нее и для других высокоорганизованных животных. Включая нас с вами.
Литература
Модестов А., Кислова А. Регенерация на кончиках пальцев // Биомолекула. 2021. URL: https://biomolecula.ru/articles/regeneratsiia-na-konchikakh-paltsev
Терешина М. Б., Арасланова К. Р., Волков С. А. и др. Большой мозг в обмен на регенерацию // Нейротехнологии будущего: тез. участников конф. «Нейрокампус 2022: старт!» (04–07 сентября 2022 г.). 2022. № 1. С. 67–69.
Haughton C. L., Gawriluk T. R., Seifert A. W. The Biology and Husbandry of the African Spiny Mouse (Acomys cahirinus) and the Research Uses of a Laboratory Colony // J. Am. Assoc. Lab. Anim. Sci. 2016. V. 55 (1). P. 9–17.
Maden M., Varholick J. A. Model systems for regeneration: the spiny mouse, Acomys cahirinus // Development. 2020. V. 147 (4). dev167718.
Публикация подготовлена на основе статьи, опубликованной на портале «Биомолекула» (biomolecula.ru) в рамках конкурса «Био/мол/текст» – 2022/2023
Автор благодарит своего научного руководителя, сотрудника Федерального центра мозга и нейротехнологий ФМБА России, канд. биол. наук Г. А. Носова за большую и неизменную поддержку