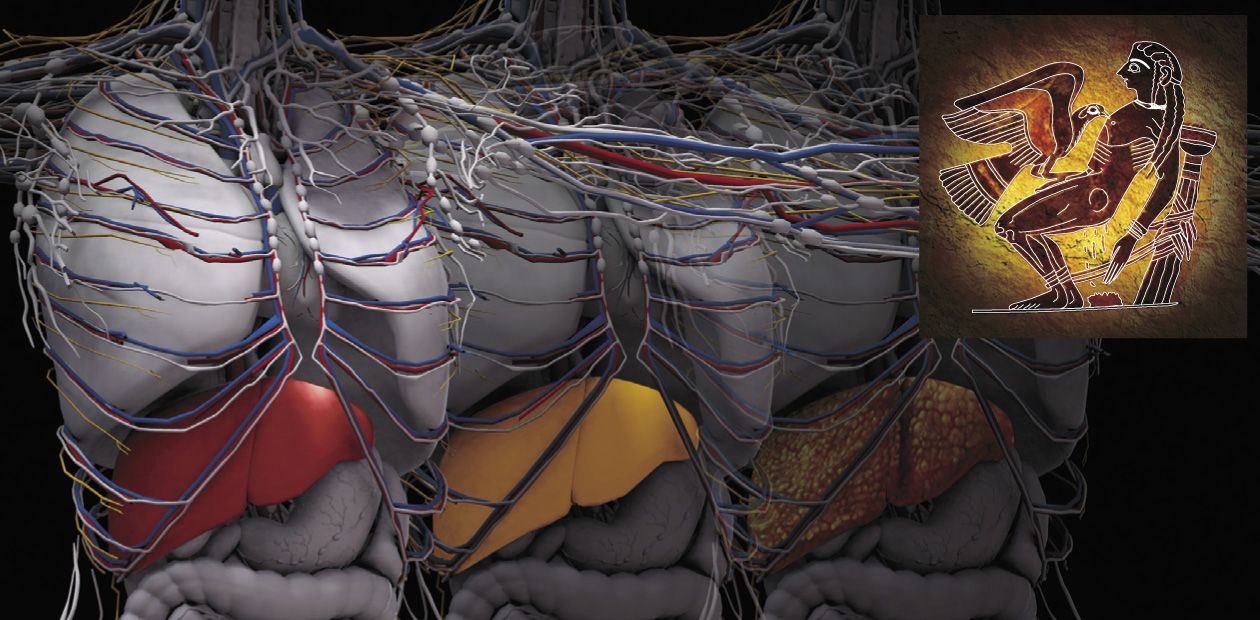
Смерть Прометея
Связь болезней печени с нарушениями функций мозга была впервые отмечена еще 2,5 тыс. лет назад знаменитым древнегреческим врачом Гиппократом. Согласно современным представлениям, именно печеночная недостаточность, обусловленная фиброзным (циррозом) или жировым перерождением печени в результате вирусного, токсического или лекарственного поражения, служит основной причиной хронических и острых энцефалопатий. Эти генерализованные заболевания, начинающиеся с апатии, агрессии и спутанности сознания, чаще всего заканчиваются гибелью больных.
Нейропсихиатрические нарушения возникают благодаря тому, что печень утрачивает функции активного фильтра и становится неспособной нейтрализовать поступающие в кровь токсины, в первую очередь – ион аммония. Рост внутриклеточных концентраций этого токсина вызывает разбалансировку работы ряда метаболических и сигнальных систем, что, в конечном итоге, пагубно влияет на когнитивные и моторные функции мозга. Современная и, надо сказать, не слишком успешная терапия направлена на снижение количества иона аммония в организме, а также ингибирование процессов, им вызываемых. Однако более действенным может оказаться стратегия, направленная на восстановление функций разрегулированных систем, в том числе использование веществ, способных снижать гиперактивность нейронных сетей путем активации тормозных рецепторов мозговых нейронов.
Печеночная энцефалопатия – это дисфункция мозга, целый «букет» нейропсихиатрических нарушений, которые возникают в ответ на острые или хронические поражения печени, когда этот орган утрачивает функции активного фильтра, способного нейтрализовать поступающие в кровь токсины, в первую очередь – ион аммония (NH4+).
Судя по письменным источникам, связь болезней печени и нарушений функций мозга впервые отметил знаменитый древнегреческий врач Гиппократ, живший 2,5 тыс. лет назад, хотя не исключено, что подобные явления задолго до этого были известны шумерам, древним египтянам и китайцам. Конечно, энцефалопатии мозга могут вызываться болезнями и других органов (например, почек), а также недостаточным кровообращением или прямой инфекцией мозга, но эти причины менее распространены.
Различают несколько стадий хронических печеночных энцефалопатий (Ferenci et al., 1999). На нулевой стадии заболевания клинических и психометрических признаков нет. На стадии минимальной печеночной энцефалопатии отмечаются небольшие изменения концентрации внимания и моторных функций мозга, обнаруживаемые только с помощью специальных тестов. Следующие стадии характеризуются спектром явно выраженных психических, поведенческих и двигательных нарушений. Сначала появляется забывчивость и рассеянность, бессонница или cонливость, дискоординация и утомляемость. Затем – апатия, летаргия, тремор рук, сбивчивая речь, эксцентричное поведение. За ними следует дезориентация во времени и пространстве, амнезия, приступы ярости, гиперрефлексия. И, наконец, потеря сознания, утрата рефлексов и комаНачало современным медико-биологическим исследованиям печеночных энцефалопатий было положено в конце XIX в. Последующие за ними 120 лет, отмеченные открытиями и заблуждениями, упорным трудом и невезеньем одних и удачей других, в какой-то мере напоминают вековую историю поиска европейцами морских путей в Индию.
От синдрома «мясной интоксикации» собак – к печеночной коме человека
Отсчет экспериментального изучения связей между заболеваниями печени и поражением мозга следует вести с 1877 г., когда образованнейший русский врач того времени Н. В. Экк, желая разгрузить печеночный кровоток, разработал хирургический метод создания путей оттока крови из воротной вены, несущей кровь от органов пищеварения в нижнюю полую вену, минуя печень. Однако из восьми прооперированных им собак семь погибли в течение нескольких дней после операции.
Спустя шесть лет эстафету Экка принял выдающийся русский ученый, будущий нобелевский лауреат И. П. Павлов, который работал во вновь открытом Императорском институте экспериментальной медицины в Санкт-Петербурге (на его оснащение и, в первую очередь, на оснащение лаборатории Павлова, А. Нобель предоставил грант в 10 тыс. рублей – огромные деньги по тем временам!). В своей классической работе Павлов разработал обратный шунт, при котором, наоборот, весь системный кровоток из воротной и нижней полой вен направлялся в печень (Hahn et al., 1893). Таким образом, была создана первая экспериментальная модель естественного шунта печеночного кровотока, который возникает при циррозе печени и портальной гипертензии в качестве компенсаторного «обходного» кровообращения, поскольку при этой болезни разрушающаяся ткань печени не может уже пропускать необходимые объемы крови.
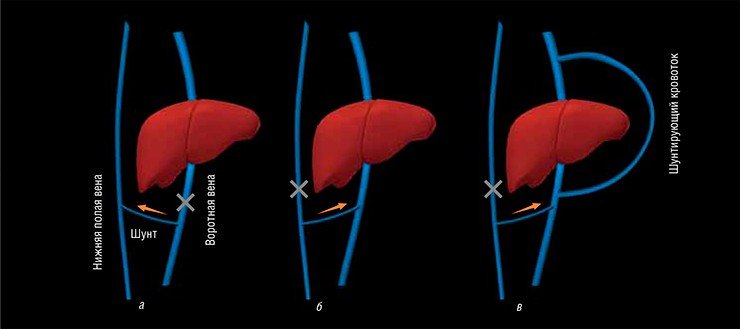
Оказалось, что прооперированные собаки не могут переносить пищу с высоким содержанием белков. Раздражительность, агрессивность, хлопающая и шатающаяся походка, блуждающий взгляд и слепота быстро сменялись ступором, судорогами, комой и гибелью животных. При отсутствии мяса (а следовательно, и избытка азота) в пище симптомы исчезали.
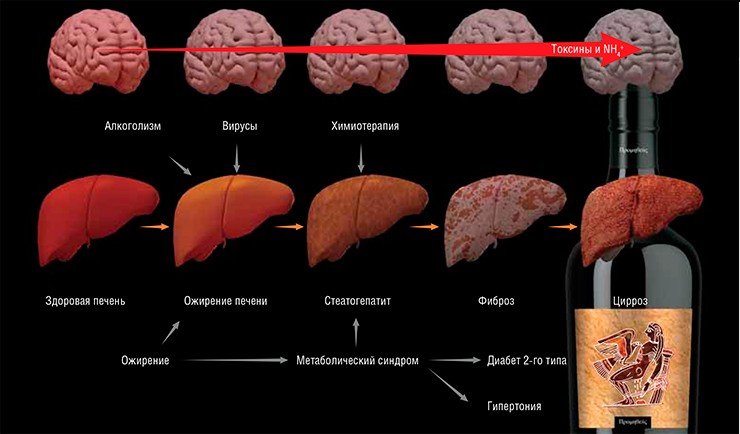
ОСТРЫЕ И ХРОНИЧЕСКИЕ Печеночные энцефалопатии классифицируются на острые и хронические в зависимости от типа печеночных нарушений, послуживших их причиной.В основе хронических печеночных энцефалопатий чаще всего лежит прогрессирующий цирроз печени – необратимое замещение нормальной печеночной ткани фиброзной соединительной («рубцовой»). Кстати сказать, первым, кто увидел связь ожирения внутренних органов с развитием сердечно-сосудистых и печеночных заболеваний, был знаменитый французский врач и патологоанатом, изобретатель стетоскопа Р. Лаэннек. Он и ввел в 1819 г. сам термин цирроз (от греч. «желтый/оранжевый»), указывающий на изменение цвета печени в результате ее жирового перерождения.
Цирроз может развиться в результате ряда болезней: алкогольного или неалкогольного (при диабете 2-го типа) стеатогепатита (воспалительного процесса, вызванного жировым перерождением печени), вирусных гепатитов, аутоиммунных заболеваний. Срок жизни пациентов с прогрессирующим циррозом печени не превышает 3—6 лет. В России смертность от этих болезней составляет не менее 75—100 тыс. человек в год, хотя официальная статистика по ним не ведется.
Среди опаснейших осложнений цирроза – портальная гипертензия, синдром повышенного давления в системе воротной вены, вызванного нарушением кровотока, которая приводит к развитию желудочно-кишечных кровотечений, увеличению селезенки и т. д. И конечно, хронические печеночные энцефалопатии, которые отмечаются у 80 % таких пациентов. Проходя последовательные стадии развития болезни: гепатит–фиброз–цирроз, печень постепенно утрачивает функции активного фильтра. Избыток иона аммония и сопряженных с ним вторичных токсинов (жирных кислот, провоспалительных цитокинов, нейростероидов и др.) воздействует на клетки мозга и других органов, приводя к развитию медленно текущего генерализованного заболевания, заканчивающегося неизбежной гибелью пациента.
Острые печеночные энцефалопатии возникают, когда печень утрачивает свои функции активного фильтра за очень короткий промежуток времени, от нескольких часов до нескольких суток. Такая острая печеночная недостаточность может быть вызвана вирусными, токсическими или лекарственными поражениями печени, сопровождающимися ее жировым перерождением. В некоторых случаях причиной являются врожденные дефекты ферментов различных метаболических путей, вследствие чего в организме накапливаются токсичные метаболиты, способные вызвать дисфункцию печени.
Особое внимание заслуживают лекарственные поражения печени. Сегодня из более чем 12 тыс. лекарств, находящихся в мировом фармацевтическом обороте, около тысячи потенциально токсичны при передозировке и, что еще более опасно, в сочетании с другими повреждающими факторами. К таким веществам относятся антибиотики, интерфероны, антиконвульсанты, трициклические антидепрессанты, противовоспалительные препараты, наркотические вещества и т. д.
Характерный пример – обычный аспирин, введенный в медицинскую практику в конце XIX в. и являющийся в настоящее время одним из двадцати наиболее востребованных препаратов. На фоне некоторых вирусных заболеваний прием аспирина может привести к быстрому микрокапельному ожирению клеток печени и других органов и тканей с развитием синдрома Рейе и других подобных заболеваний
Используя модель печеночного шунта Павлова, известный польский биохимик М. Ненски провел собственные исследования, выявившие ключевую роль накапливающихся количеств азота (иона аммония) в исследуемых процессах (Nencki & Zaleski, 1895). К концу 1890-х гг., когда стало понятно, что все наблюдаемые эффекты могут быть связаны с накапливающимся в крови ионом аммония, была опубликована итоговая совместная работа ученых относительно баланса азота в организме (Nencki et al., 1896). В ней было постулировано, что аммоний метаболизируется в печени до мочевины, и что нарушения этого процесса при шунтировании печеночного кровотока приводят к развитию дисфункции мозга.
Однако понадобилось еще свыше полувека исследований, чтобы синдром «мясной интоксикации» собак был недвусмысленно соотнесен с печеночной комой у человека, а нарушения метаболизма иона аммония при циррозе печени стали рассматриваться как основная причина дисфункции мозга (Burchi, 1927; Van Gulaert & Deviller, 1932, Sherlock et al., 1954).
Было установлено, что резкое увеличение концентрации иона аммония в крови может происходить при септическом шоке, остановке работы сердца, интенсивных физических нагрузках, вообще при кислородном голодании (Parnas et al., 1926; Nelson et al., 1953). Также обнаружилось, что энцефалопатии могут возникать у пациентов и в отсутствие цирроза, например, при скоротечном жировом перерождении печени (Brain et al., 1927; Mann еt al., 1962; Reye et al., 1963).
Следуя поговорке о том, что «новое – это хорошо забытое старое», некоторые исследователи, знакомые с работами Павлова, для лечения пациентов с циррозом печени стали использовать соли аммония или оперативным путем устанавливать прямой шунт печеночного кровотока. Естественно, все это неминуемо приводило к гибели пациентов. Применение метода проб и ошибок в лечении пациентов с циррозом и печеночными энцефалопатиями при отсутствии развернутых представлений о механизмах и генезе патологических процессов было вполне характерно для исследований первой половины XX в., и, как ни печально, послужило неизбежной платой за получение знаний.
Наконец, во второй половине XX в. были разработаны экспериментальные модели печеночных энцефалопатий на лабораторных животных, на которых стали проводиться исследования механизмов токсического действия иона аммония и вторичных токсинов и поиска защитных терапевтических средств. В последней четверти прошлого столетия с появлением методов прижизненных клеточных исследований с использованием флуоресцентной микроскопии, а также методов иммунохимии и генной инженерии, фокус исследований сместился на субклеточный и молекулярный уровень.
Отек мозга – в чем причины?
К настоящему времени опубликованы сотни тысяч работ, посвященных исследованиям механизмов патогенеза печеночных энцефалопатий и поискам средств и методов их коррекции. Предложены десятки теорий, в которых отражены скорее тренды научных исследований текущих десятилетий, чем глубина понимания проблемы.
В любом случае не вызывает сомнений, что развитие печеночной энцефалопатии сопровождается повышением в крови и в клетках тканей организма концентраций ключевого эндотоксина – иона аммония, а также ряда вторичных токсинов, включая провоспалительные цитокины («цитокиновый шторм»; Shawcross, 2012), длинноцепочечные жирные кислоты (синдром Рейе), нейростероиды и т. д. Стадии развития такой энцефалопатии характеризуются переходом от простых психомоторных нарушений к ступору, коме и смерти.
Сегодня считается, что развитие острых печеночных энцефалопатий обусловлено, главным образом, отеком мозга токсической или вазогенной (из-за повышения проницаемости капилляров) природы. Другими словами, причиной отека мозга служит накопление в клетках мозга так называемых «токсических осмолитов» глутамина, лактата и аланина – молекул, накопление которых в клетках приводит к набуханию клеток вследствие притока воды. Это происходит вследствие дисфункции нейронов и астроцитов («обслуживающих» клеток мозга) либо увеличения проницаемости гематоэнцефалического барьера из-за дисфункции сосудистого эндотелия (клеток внутренней выстилки) и гладкомышечных клеток кровеносных сосудов.
Именно отек мозга, приводящий к повышению внутричерепного давления, рассматривается в качестве основной причины развития комы и последующей гибели организма на фоне острой печеночной энцефалопатии. При этом молекулярные механизмы, приводящие к нарушению сигнальных функций нейронных сетей мозга при коматозных состояниях, до сих пор не установлены.
Накопление «токсических осмолитов» является компенсаторной реакцией клеток разных типов на резкое повышение концентраций иона аммония и вторичных токсинов. Однако негативное вляние первичного эндотоксина не ограничивается стимуляций накопления подобных осмолитов. Как известно, ионные радиусы аммония и калия сходны. Вследствие этого аммоний способен атаковать калиевые каналы клеток, радикально нарушая ионный гомеостаз различных органов и тканей. Кроме того, с помощью пока не известных механизмов он способен негативно влиять на сигнальные функции нейронных сетей, воздействуя на различные типы клеточных рецепторов.
Список клеточных мишеней для аммония и вторичных токсинов, к настоящему времени уже насчитывающий несколько десятков, постоянно растет. Соответственно этому растет и число предлагаемых способов лечения печеночной энцефалопатии, основанных на использовании блокаторов различных типов, таких, например, как ингибиторы синтеза «токсических осмолитов», с помощью которых можно уменьшить отек мозга и ослабить летальное действие токсинов.
При хронических формах печеночной энцефалопатии действие избытка иона аммония и вторичных токсинов на клетки мозга, других органов и тканей может приводить к развитию медленно текущего, многостадийного генерализованного заболевания c характерными спектрами метаболических, сигнальных и нейропсихических нарушений. Медленное угасание таких пациентов заканчивается неизбежной гибелью.
В этом случае необратимость патологических процессов в печени, а также в мозге и других органах и тканях связано не только с прямым действием токсинов на известные клеточные мишени, но и с изменением экспрессии ключевых генов различных метаболических, транспортных и сигнальных систем. Однако исследование подобных механизмов только стоит на повестке дня.
Как лечить
Наиболее эффективный на сегодня метод лечения печеночных энцефалопатий — хирургический, т. е. пересадка донорской печени (Bajaj, 2010). При этом в случае острых состояний трансплантация должна быть проведена практически немедленно, в течение первых 3—4 дней заболевания (Lee, 2003).
Сидром Рейе – редкое, но угрожающее жизни острое состояние, возникающее у детей и подростков на фоне лечения вирусного заболевания (грипп, корь, ветряная оспа) препаратами, содержащими ацетилсалициловую кислоту, такими, как аспирин. Заболевание характеризуется развитием жировой инфильтрации печени и быстро прогрессирующей энцефалопатией вследствие отека головного мозга. Механизмы действия всего комплекса токсинов и жирового перерождения печени в этих случаях до сих пор изучены недостаточно.При отсутствии соответствующего лечения состояние больного может быстро ухудшиться вплоть до развития комы и остановки дыхания. Высокая смертность в 1980-е гг. детей, принимавших аспирин на фоне вирусной инфекции, привела к появлению во многих развитых странах запрета использовать аспирин как жаропонижающее и противовоспалительное средство детям до 12 летУвы, в России за год проводится почти столько операций по трансплантации печени, сколько, например, в Испании за неделю. Хирургический метод декомпрессии портальной системы, предложенный Экком, в силу серьезных побочных эффектов не получил широкого распространения. В наши дни для декомпрессии портальной системы используют вазоконстрикторы (вещества, вызывающие сужение кровеносных сосудов и уменьшение кровотока) и лигирование (наложение латексных колец) варикозных сосудов.
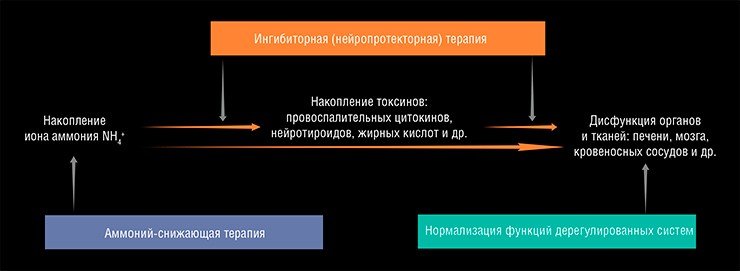
Начиная с середины прошлого века было предпринято много попыток разработать эффективные терапевтические способы предотвращения нейротоксических эффектов иона аммония. Современные стратегии лечения острых и хронических форм печеночной энцефалопатии можно разделить на два типа. Во-первых, это подходы, направленные на уменьшение содержания иона аммония в крови. Во-вторых, – «нейропротекторные», или «ингибиторные», стратегии, направленные на подавление процессов, активируемых ионом аммония и вторичными токсинами.
Методы снижения концентрации аммония в крови, разработанные для лечения печеночной энцефалопатии еще в середине прошлого века, остаются актуальны и востребованы и на сегодняшний день (McDermott, 1958; Rose, 2012). Эти методы базируются на подавлении продукции этого токсичного метаболита кишечными бактериями, а также активации его превращения в мочевину в цикле мочевины (цикле Кребса – Хензелейта) в клетках печени и в аминокислоту глутамин – в различных органах и тканях.
До последнего времени развитие прогрессирующего цирроза печени было связано в основном с алкоголизмом и вирусными заболеваниями печени (гепатитами B, C, E) у пациентов старше 40 лет. Однако в ближайшие годы ожидается резкое увеличение числа таких больных среди других групп населения, что связано со все большим распространением ожирения и диабета 2-го типа. По оценкам ВОЗ, число пациентов с диабетом 2-го типа в нашей стране на сегодня превышает 16 млн человек, четверть из которых – дети и подросткиДля подавления активности кишечных бактерий-продуцентов иона аммония используются пробиотики, избирательно влияющие на активность кишечной микрофлоры (например, синтетические изомеры сахаров) и антибиотики (например, неомицин). Для активации реакций утилизации эндотоксина могут использоваться различные сочетания амино- и дикарбоновых кислот. Примером таких препаратов может служить «ГепаМерц», действие которого направлено на активацию цикла мочевины.
Наряду с этими средствами, в условиях стационара при реанимации могут также использоваться гипотермия, инъекции глюкокортикоидов, противовоспалительных и других фармацевтических препаратов. В результате сочетанного применения подобных методов в клинической практике Европы и США за последние двадцать лет удалось в три раза уменьшить число летальных исходов, связанных с отеком мозга при острых формах печеночной энцефалопатии (Shawcross, 2012).
Однако предпринимаемые в течение последнего полувека активные попытки разработать и ввести в клиническую практику эффективные нейропротекторы, действие которых направлено на ослабление или предотвращение токсического действия иона аммония на клетки мозга, пока оказались безуспешными (Braissant еt al., 2012). Подобные «нейропротекторные стратегии» основаны на подавлении сигнальных, транспортных или метаболических систем в мозге, которые чрезмерно активируются возросшими концентрациями иона аммония.
В числе таких методов – ингибирование глутаминсинтазы, фермента, участвующего в реакции синтеза «токсического осмолита» (Schenker et al.,1967; Brusilow et al., 1986, 2012), и блокада глутаматных рецепторов, ключевых возбуждающих рецепторов нейронов мозга (Felipo et al., 1996, 2013). Проблема заключается в том, что глутаминсинтаза функционирует практически во всех органах и тканях, а глутаматные рецепторы имеются также и в клетках других тканей, помимо мозговой. Поэтому использование таких ингибиторов в рамках целостного организма неминуемо будет приводить к нежелательным системным эффектам. Кстати сказать, к подобным эффектам может приводить и использование ингибиторов синтеза молочной кислоты (лактата) и других веществ, способных оказывать токсический осмолитический эффект.
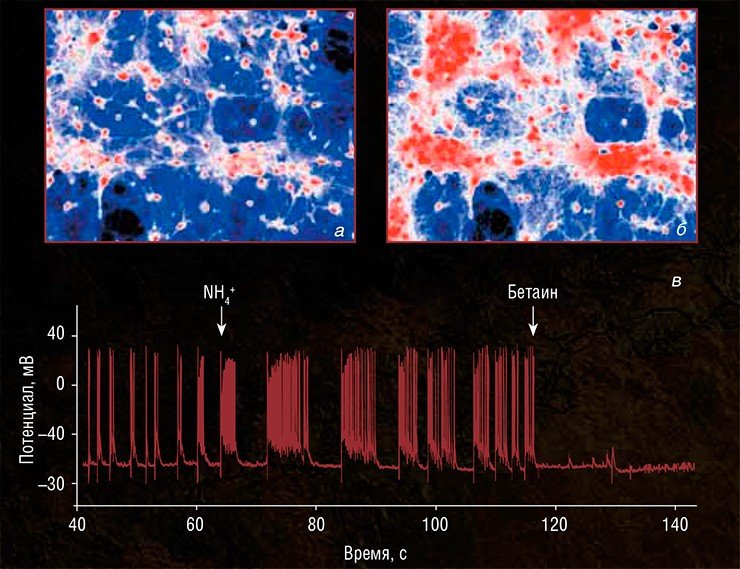
Предварительные исследования, проведенные в Институте биофизики клетки, Институте теоретической и экспериментальной биофизики и Институте биоорганической химии РАН (Пущино, Московская область), показали, что ион аммония вызывает гиперактивацию нейронных сетей, задействуя несколько типов клеточных рецепторов и каналов (Кононов и др., 2012, 2013; Dynnik et al., 2015). И чтобы уменьшить этот эффект, не обязательно ингибировать синтез глутамина или блокировать возбуждающие глутаматные рецепторы.
Действительно, зачем вызывать поломку двигателя несущегося автомобиля, имея исправные тормоза? На сегодня известен целый класс веществ, способных снижать гиперактивность нейронных сетей путем активации тормозных рецепторов нейронов мозга. К тому же комбинации этих веществ обладают аммоний-снижающим эффектом (Толмачева и др., 2011; Grishina et al., 2015). Комплексные соединения на их основе могут служить прототипами при разработке новых средств терапевтического лечения печеночной энцефалопатии (Богомолов и др., 2013).
Итак, несмотря на стодвадцатилетнюю историю исследования печеночных энцефалопатий, в медицинской практике по-прежнему господствует «ингибиторный» подход к лечению этих тяжелейших последствий печеночной недостаточности. Объективная причина заключается в многофакторной и комплексной природе заболевания, а также в чрезмерном упрощении представлений о структурах и механизмах регуляции исследуемых метаболических и сигнальных систем. Сегодняшнее положение дел во многом определяется и традициями медицинской биохимии и европейской фармакологии, основанными, скорее, на монотерапии и подавлении процессов, запускаемых токсинами и возбудителями болезней, чем на восстановлении функций разрегулированных систем.
В настоящее время на фоне отсутствия хорошо проработанных и широко доступных клеточных технологий эффективной регенерации больной печени перспективным, очевидно, является одновременное использование нескольких стратегий терапевтического лечения, направленных на снижение содержания токсинов и активацию разрегулированных метаболических и сигнальных клеточных систем, а также систем регуляции ключевых генов.
Разработка и использование в обычной медицинской практике подобных комплексных препаратов с «многогранной» активностью позволит, образно говоря, уменьшить страдания прикованного к скалам Прометея, т. е. увеличить срок и улучшить качество жизни больных с тяжелейшим диагнозом – цирроз печени и печеночная энцефалопатия. И, конечно, задачи такого масштаба могут быть эффективно решены только в рамках больших проектов, сочетающих междисциплинарные исследования.
Литература
Экк Н. В. К вопросу о перевязке воротной вены // Воен.мед. журн., 1877. 130, 2:1.
Al Sibae M. R., McGuire B. M. Current trends in the treatment of hepatic encephalopathy // Ther. Clin. Risk Manag. 2009. Vol. 5(3). P. 617—626.
Hahn M., Massen O., Nencki M. et al. Die Ecksche Fistel zwi der unteren Hohlvene und der Pfortader und ihre Folgen fur den Organismus // Arch. Exp.Pathol. Pharmacol. 1893. Vol. 32. P. 161—210.
Leise M. D., Poterucha J. J., Kamath P. S., et al. Management of hepatic encephalopathy in the hospital // Mayo Clin Proc. 2014. Vol. 89(2). P. 241—53.
Nencki M., Pavlov I. P., Zaleski J. Uber den Ammoniakgehalt des Bluttes und der Organe. Die Harnstoffbildung bei den Saugetieren // Arch. Exp. Pathol. Pharmacol. 1896. Vol. 37. P. 26—51.
Rose C. F. Ammonia-lowering strategies for the treatment of hepatic encephalopathy // Clin. Pharmacol. Ther. 2012. Vol. 92(3). P. 321—331.
Ryan J. M., Tranah T., Mitry R. R., et al. Acute liver failure and the brain: a look through the crystal ball. Metab. Brain Dis. 2013. Vol. 28(1). P. 7—10.
Review. Sturgeon J. P, Shawcross D. L. Recent insights into the pathogenesis of hepatic encephalopathy and treatments // Expert Rev. Gastroenterol. Hepatol. 2014. Vol. 8(1). P. 83—100.