Как создаются лекарства, или По вирусу – прямой наводкой
Население Земли за последние столетия стремительно выросло, достигнув без малого 8 млрд человек. Во многом это произошло благодаря успехам медицины, в частности открытию в середине прошлого века антибиотиков, спасших миллионы жизней. Но чем больше нас становится, чем шире мы распространяемся по планете, тем выше вероятность встречи с новыми инфекционными агентами: вирусами, бактериями и грибами. И если в борьбе с бактериями мы пока что выигрывали, хотя поиск новых антибиотиков становится все более долгим и дорогим, то бороться с вирусными инфекциями человечество еще только учится, больше полагаясь на профилактическую вакцинацию. Мы предлагаем читателю проследить, как создаются лекарства прямого действия против вирусов – «полуживых» паразитов человека, в том числе на примере разработки специфического препарата против коронавирусной инфекции
Эволюционная теория утверждает, что выживает тот, кто наиболее приспособлен к окружающей среде. Теория вероятностей добавляет: «или тот, кому повезет». Тем не менее выжить стремится любой организм, хотя это лишь цель, а не причина.
Вспомним, что на заре зарождения жизни существовали лишь отдельные молекулы в общем «первичном бульоне». И когда некоторые из них научились создавать себе подобных, то они и стали «выживать» лучше других, потому что их становилось больше, и с физической точки зрения это было энергетически выгодно. С тех пор минули миллиарды лет эволюции живого, но основы мира не изменились.
Человеку очень полезно знать эти основы, понимать, как осуществляются взаимоотношения между различными биологическими видами, населяющими нашу планету, и какую выгоду из них он может извлечь. Осознавать, какое положение занимает он сам, какую опасность могут представлять для него отдельные организмы и как с ними можно бороться.
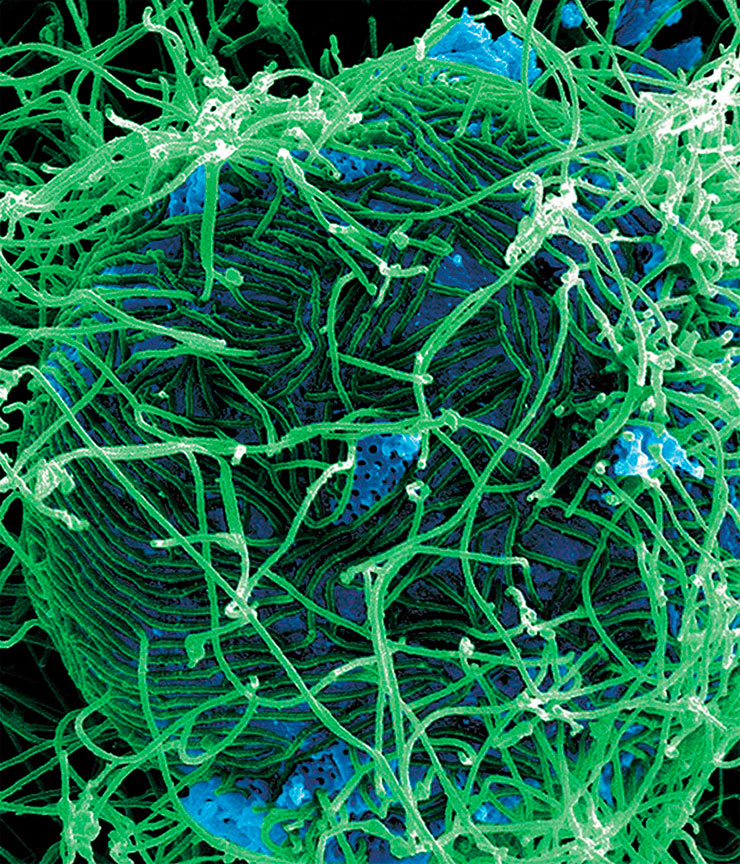 В широком смысле один организм может быть опасным для другого, если затрудняет его выживание. И речь идет не о счастливой жизни до глубокой старости, а о производстве как можно большего числа плодовитого потомства. В этом смысле опасность существует всегда, когда есть конкуренция за ресурсы, которая снижает вероятность успешного размножения.
В широком смысле один организм может быть опасным для другого, если затрудняет его выживание. И речь идет не о счастливой жизни до глубокой старости, а о производстве как можно большего числа плодовитого потомства. В этом смысле опасность существует всегда, когда есть конкуренция за ресурсы, которая снижает вероятность успешного размножения.
Можно выделить три класса взаимоотношений, при которых один вид снижает шансы на выживание другого. По сути, они напрямую связаны со способами питания: хищничество – прямое истребление одного вида другим, для которого он является пищей; конкуренция за ресурсы в узком смысле, возникающая, когда два вида одинаковой пищевой специализации живут на одной территории; паразитизм – непосредственная «кража» полезных ресурсов у другого вида, которые он производит для себя. Во всех этих случаях гибель какого-либо из организмов является побочным эффектом стремления выжить другого организма, как бы это цинично ни звучало в случае хищников.
Особый подкласс паразитов – инфекционные агенты, которые приспособлены для жизни исключительно внутри другого организма (хозяина) и не могут выживать вне его.
Некоторые виды паразитов могут годами жить внутри других организмов, не вызывая у тех серьезных патологических симптомов. Но подавляющее большинство, даже долгоживущие, не только крадут полезные ресурсы хозяина, но и выделяют вещества, негативно влияющие на его здоровье. А некоторые настолько полно «используют» своего носителя, что у того не хватает ресурсов для себя и его жизненные функции быстро угасают.
Таким образом, именно конкурентная борьба за ресурсы организма между ним самим и инфекционными агентами является основной причиной и спецификой инфекционных заболеваний.
Инфекции и как с ними бороться
Инфекционные заболевания обычно классифицируют по месту распространения возбудителя: общие или местные, а также по его виду: многоклеточные, одноклеточные, вирусы и прионы.
 Первое деление важно в основном для выбора способа введения лекарства: местно или внутрь, чтобы через кровь оно распространилось по всему организму с прицелом (или без) на определенные органы. Но чтобы понять, какое действующее вещество выбрать, в первую очередь нужно узнать, с каким врагом мы боремся. И в этом смысле самая важная граница проходит между живыми и неживыми инфекционными агентами, т. е. между клеточными организмами и неклеточными молекулярными структурами, каковыми являются вирусы и прионы.
Первое деление важно в основном для выбора способа введения лекарства: местно или внутрь, чтобы через кровь оно распространилось по всему организму с прицелом (или без) на определенные органы. Но чтобы понять, какое действующее вещество выбрать, в первую очередь нужно узнать, с каким врагом мы боремся. И в этом смысле самая важная граница проходит между живыми и неживыми инфекционными агентами, т. е. между клеточными организмами и неклеточными молекулярными структурами, каковыми являются вирусы и прионы.
С одной стороны, живые организмы в процессе жизнедеятельности осуществляют много разнообразных действий, необходимых для самоподдержания и размножения. Каждое из них теоретически может быть заблокировано и поэтому считается потенциальной мишенью для лекарств. С другой – даже одноклеточные в процессе эволюции разработали различные способы защиты от вредных веществ, направленных на их уничтожение. А защищаться им есть от чего, и не только от человека и прочих «хозяев»: даже разные виды патогенов стремятся избавиться друг от друга, конкурируя за ресурсы.
Прионы представляют собой одиночные белковые молекулы, которые обладают способностью «переделывать» клеточные белки по своему «образу и подобию». Тем самым они «размножаются», запуская в клетках каскад накопления белковой массы. Прионы угрожают не всем белкам, а только изначально похожим на них самих. К сожалению, у млекопитающих такие белки присутствуют во многих клетках разных тканей. А поскольку прионы невероятно устойчивы к стандартным способам защиты организма, проникновение такого белка всегда приводит к заражению и всегда – к летальному. Несмотря на всю простоту прионов, люди пока не смогли придумать способов борьбы с ними за те полвека, что прошли с момента их открытияВысшие организмы, начиная с позвоночных, имеют универсальную систему борьбы со всем чужеродным, что попадает в организм, – иммунную. Эта система после обнаружения «чужака» запускает для его уничтожения производство специальных клеток – лимфоцитов. Кроме того, начинается выработка антител – специальных белков, специфически связывающихся с мишенью, чтобы привлечь к ней еще больше лимфоцитов. А в случае, когда антител производится много, они оказывают и прямое действие на инфекционный агент.
На таком действии этих защитных белков основано применение профилактических вакцин – медицинских препаратов, содержащих агенты, подобные настоящим инфекционным, что позволяет заранее выработать на них иммунный ответ. В этом кроется и главный недостаток вакцин: они лишь подготавливают организм к будущей инфекции, но бесполезны при уже начавшейся.
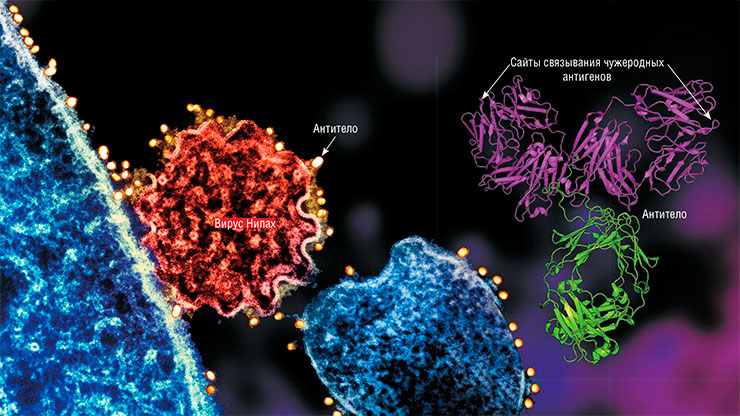
Кроме того, эффективность вакцин очень зависит от двух главных факторов: штамма (подвида) инфекционного агента и способности иммунной системы воспользоваться предоставленным ей «шансом». В первом случае при встрече с новым, отличным от вакцинного вариантом патогена наработанные антитела могут его не опознать, во втором – их может не хватить для его обезвреживания. Из плюсов вакцин можно выделить высокую стандартизацию процесса изготовления новых препаратов, не зависящего от типа возбудителя. Сразу после выяснения структуры «врага» можно приступать к производству вакцины.
Совсем другое дело – препараты прямого действия, которые непосредственно воздействуют на патоген, не влияя на иммунную систему.
 В случае одноклеточных микроорганизмов важным и, по сути, единственным классом таких веществ являются антибиотики – разнообразные и относительно небольшие молекулы с антимикробным действием. При этом почти все современные антибиотики изначально представляют собой вещества, которые сами микроорганизмы (в основном бактерии) вырабатывают для борьбы со своими конкурентами. А удачные примеры созданных человеком химических соединений, за редким исключением (например, фторхинолоны), являются видоизмененными природными соединениями.
В случае одноклеточных микроорганизмов важным и, по сути, единственным классом таких веществ являются антибиотики – разнообразные и относительно небольшие молекулы с антимикробным действием. При этом почти все современные антибиотики изначально представляют собой вещества, которые сами микроорганизмы (в основном бактерии) вырабатывают для борьбы со своими конкурентами. А удачные примеры созданных человеком химических соединений, за редким исключением (например, фторхинолоны), являются видоизмененными природными соединениями.
И дело здесь не в отсутствии желания изобретать велосипед, а в тех самых защитных механизмах микробов, которые и сейчас трудно обойти и которые к тому же еще эволюционируют буквально на глазах. Поэтому почти все попытки создать антибиотик, специфичный для определенного штамма или вида, либо превращались в бесконечную погоню за эволюцией, либо практически сразу признавались экономически невыгодными.
Неудивительно, что создатели новых антибиотиков сейчас концентрируют свои усилия на поиске и разработке принципиально новых соединений широкого и длительного действия. Другими словами, лекарств сразу от большого числа инфекций, на которые микроорганизмы не смогут выработать защиту хотя бы в ближайшем будущем. Поиск новых антибиотиков является очень важной темой в науке, мы же сегодня сосредоточимся на описании препаратов прямого действия против других, неклеточных инфекционных агентов – вирусов.
Вирусы – «полуживые» вредители
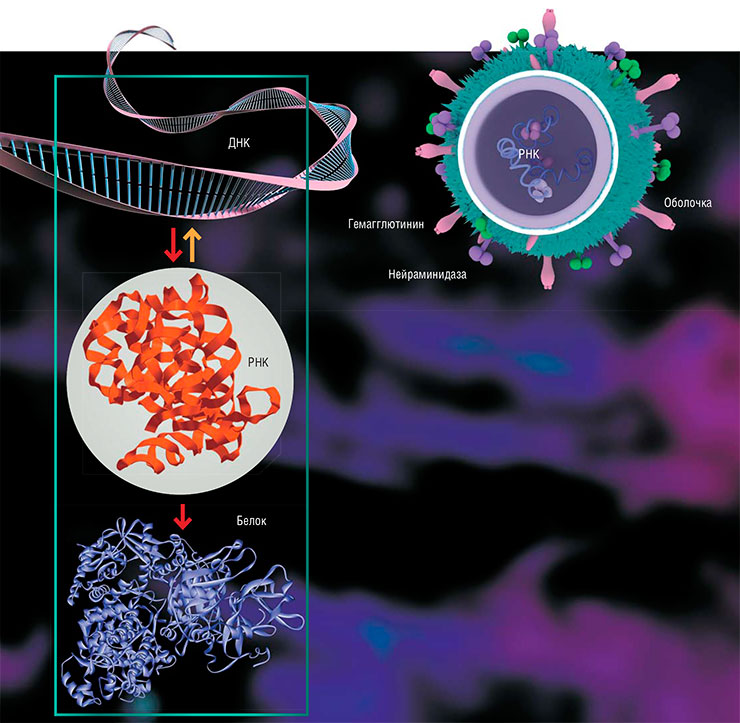
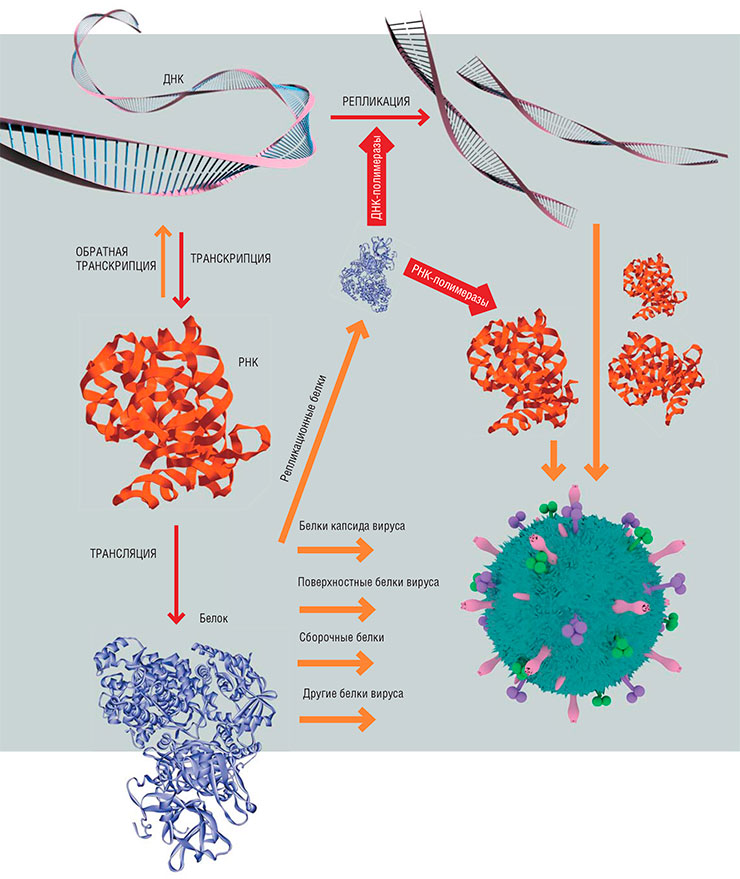
Вирусы, если говорить кратко, состоят из двух основных частей: генетического материала (ДНК или РНК) и оболочки (капсида), в которую этот материал заключен и где находятся «инструменты» для связывания с клеточной мишенью. Поэтому и весь жизненный цикл вирусов включает всего несколько процессов: проникновение в клетку, копирование своего генетического материала, сборку новых вирусных частиц и выход из клетки.
С вирусами может бороться иммунная система организма, особенно подготовленная вакциной. К тому же вирусы, в отличие от клеточных патогенов, не имеют защитных систем как таковых: в клетке хозяина вирусный генетический материал без оболочки и все, что с помощью него производится, открыты для воздействий. Но у вирусов есть свое «ноу-хау»: для защиты они успешно используют две стратегические схемы.
Первая основана на принципе «лучшая защита – нападение»: при попадании в организм вирусы начинают размножаться с такой скоростью, что иммунитет за ними попросту не успевает. Вторая – «маскировка», когда вирус внедряет свой генетический материал в геном клетки, после чего та уже не может распознать чужеродный кусок генетического кода. В таком виде вирус «ожидает» удобного момента для начала атаки. Так что нам решительно нужны лекарства прямого действия против вирусов, своего рода «вирусные антибиотики». Вопрос в том, где их взять.
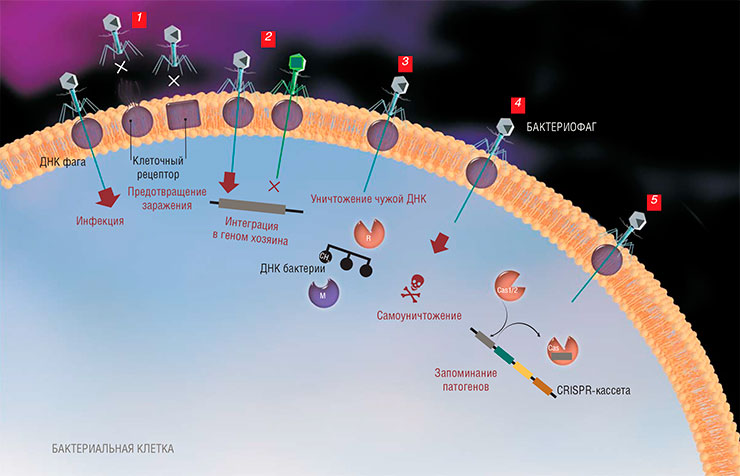
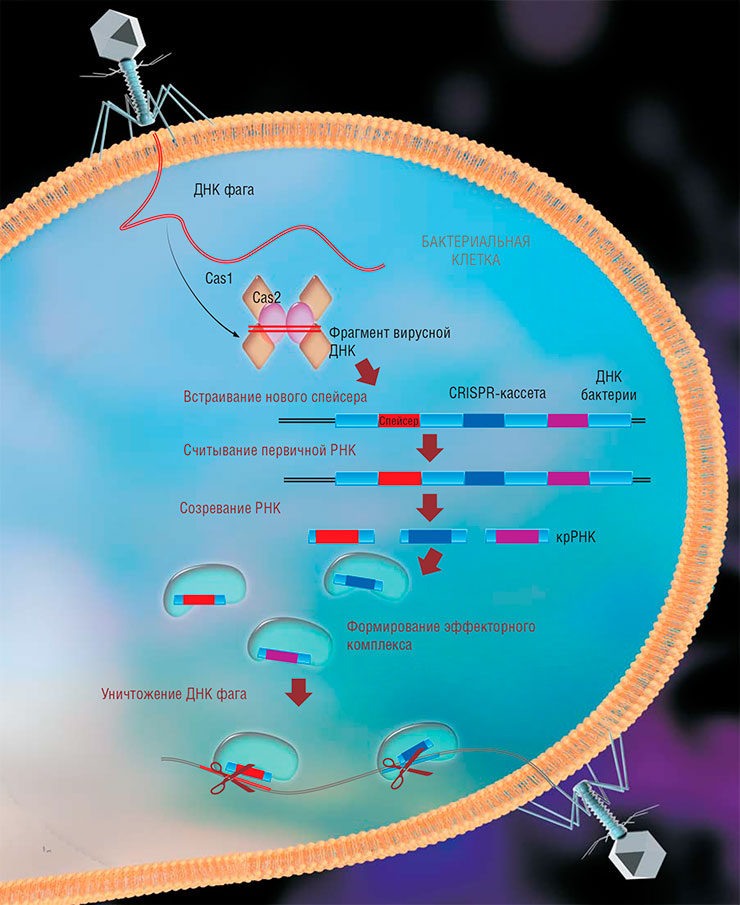
Бактериальный «иммунитет» СRISPR-Cas имеет одну общую черту с нашим – усиление ответа при повторном заражении. Такая возможность появляется у бактерий за счет встройки в бактериальный геном коротких генетических фрагментов вирусов, которые могут использоваться как шаблон для «опознавания» чужеродной ДНК или РНК.Гениальная догадка о возможности применять в качестве шаблонов не куски вирусных нуклеиновых кислот, а другие полезные последовательности ДНК, привела к созданию очень эффективной системы для редактирования геномов живых организмов. Возможно, что в будущем люди научатся встраивать в свой геном систему CRISPR-Cas, чтобы использовать ее по первоначальному назначению – для борьбы с вирусами, пусть пока эта идея и кажется фантастической
Предполагается, что вирусы или подобные им молекулярные структуры возникли примерно в то же время, когда жизнь на Земле осваивала клеточный уровень, т. е. около 4 млрд лет назад. В какой-то момент группа молекул, возможно, уже обладающая индивидуальной оболочкой, «поняла», что для успешного размножения необязательно иметь все необходимые средства у себя – можно воспользоваться чужими. Естественно, клеточные формы, размножавшиеся своими силами, начали вырабатывать способы противодействия. И эта война разных форм жизни с различными типами паразитов, длящаяся уже несколько миллиардов лет, вряд ли когда-либо закончится.
Бактерии, одни из первых полноценных клеточных организмов, смогли выработать два довольно сложных механизма борьбы со своими вирусами (бактериофагами): системы рестрикции-модификации и CRISPR-Cas. С их помощью бактерии отличают попавшие к ним вирусные ДНК и РНК от собственных и буквально рвут своих врагов на части. При этом они не используют никакие специальные малые молекулы наподобие антибиотиков, как в случае борьбы с клеточными «собратьями».
Нужно добавить, что и у высших организмов (не только у животных, но и у растений и грибов) имеется нечто подобное. Помимо иммунной системы, которая опознает не сам генетический материал возбудителя инфекции, а получающиеся на его основе продукты, существует еще и механизм РНК-интерференции. Но он неспецифичен и предназначен для удаления любой лишней РНК, которая не нужна клетке на данный момент, поэтому противовирусная эффективность у него низкая.
Таким образом, в случае вирусов мы не можем напрямую воспользоваться «наработками» бактерий как основой для создания противовирусных лекарств, как это было с антибиотиками. Нужно придумать что-то совершенно новое.
Мишень – вирус
Для начала более подробно рассмотрим процессы жизненного цикла вирусов, которые, хотя бы теоретически, можно изменить, а в идеале – и полностью заблокировать.
Чтобы размножиться, вирусу необходимо попасть внутрь клетки. Проникновение можно разделить на три шага. Первый – связывание с определенными поверхностными белками клеток тканей и органов, где будет идти заражение. За этим следует собственно проникновение – проход сквозь клеточную мембрану в цитоплазму, где и осуществляется третий этап – «раздевание», лишение вируса оболочки. Затем начинается процесс репликации вируса – копирования его генетического материала. В зависимости от исходного вида возбудителя этот процесс может различаться, но мы не будем вдаваться в детали. В любом случае размножение каждого вируса обязательно проходит через стадию создания РНК, так как именно она служит матрицей, по которой в клетке собираются вирусные белки.
У различных вирусов могут быть разные наборы белков. Какие-то вирусы являются «минималистами» и стараются по максимуму воспользоваться ресурсами клетки, другие шифруют все, что им нужно, в своих ДНК или РНК. При этом геном большинства вирусов все-таки содержит гены, кодирующие репликационные белки – ДНК- и/или РНК-полимеразы, поэтому они меньше зависят от клеточных ресурсов.
Механизм РНК-интерференции запускают длинные двуцепочечные молекулы РНК, которые в клетке в норме не образуются. Зато геном многих известных вирусов состоит именно из такой РНК. Кроме того, подобные молекулы могут синтезироваться в клетке в качестве промежуточного продукта в процессе размножения некоторых вирусов. Следовательно, появление двуцепочечной РНК является для клетки сигналом: «Опасность!»
Попадая в клетку, длинные двуцепочечные РНК связываются с клеточным ферментом Дайсер и разрезаются на короткие фрагменты, которые связываются с клеточным комплексом RISC. Этот комплекс находит и разрушает только те РНК, которые «узнает» по принципу гомологии нуклеотидных последовательностей. В результате попавший в клетку генетический материал вируса уничтожается
Завершением цикла размножения является выход вирионов из клетки. Для этого есть разные способы. Некоторые вирионы аккуратно выходят через мембрану, а вот другие принуждают свою хозяйку закончить жизнь самоубийством (апоптозом) и разрушиться.
Сразу отметим, что стадии «раздевания» вирионов и выхода их из клетки требуют взаимодействия большого количества уникальных белков, как хозяйских, так и вирусных, поэтому считаются сложными мишенями для специфического воздействия и находятся внизу списка приоритетов. Зато стадия репликации, напротив, самая привлекательная. Все дело в том, что вирусные ферменты, играющие здесь главные роли, – ДНК- и РНК-полимеразы – являются очень консервативными. Иными словами, структурно и функционально они очень схожи со всеми другими ферментами, выполняющими ту же задачу.
Вообще, подобное молекулярное сходство с известными примерами – это первое, что пытаются выявить и учесть при начале разработки нового лекарства. Если оно есть, открывается возможность использовать уже накопленные знания по ферментам данного типа, включая структуру его самого и молекул субстратов, с которыми он взаимодействует, условия протекания химических реакций и т. д. Если повезет, то окажутся известны и вещества, блокирующие какой-либо из аналогичных ферментов.
И полимеразы – именно такие ферменты, что неудивительно: их субстраты (ДНК, РНК и отдельные «звенья»-нуклеотиды, из которых собираются молекулы нуклеиновых кислот) есть у всех живых организмов и устроены по одному плану. Поэтому в случае с вирусной полимеразой сразу приходит в голову мысль взять за основу лекарства один из субстратов (лучше какой-нибудь нуклеотид, потому что он меньше и проще) и так изменить его, чтобы он «стопорил» ее работу.
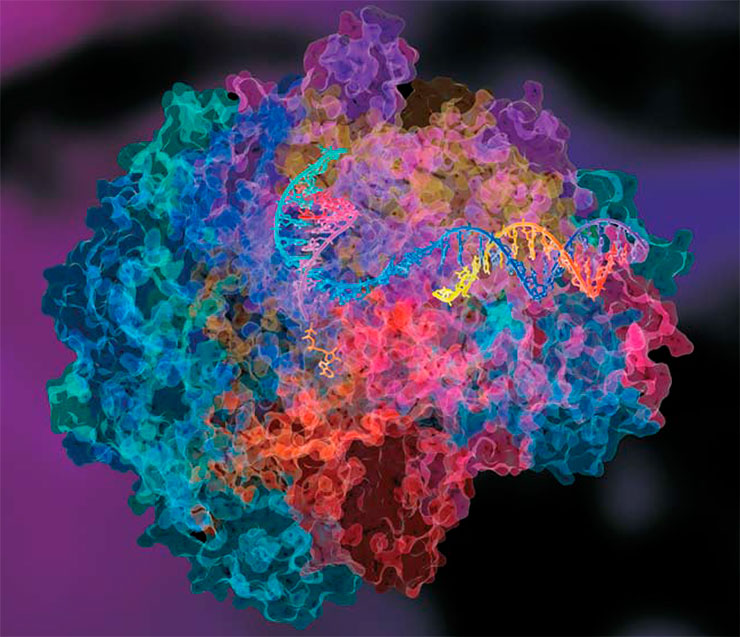
Зная структуру полимеразы, ее активного центра, где проходит реакция, и особенности субстрата, можно быстро понять, какие вещества способны стать потенциальными блокираторами – ингибиторами. Но здесь возникает проблема специфичности. Из-за того, что активные центры разных полимераз почти одинаковы, ингибитор не должен сильно отличаться от природного субстрата, иначе он не впишется в активный центр. С другой стороны, он должен не связываться со всеми имеющимися в клетке полимеразами, а выбирать именно вирусную. И это огромная проблема.
Высокоспецифичные ингибиторы теоретически можно создать и для молекул, работающих на стадиях связывания вириона с клеточной оболочкой и сборки новых частиц. Для последней стадии сделать это пока не получилось. А вот связывание вируса ВИЧ с клеткой удалось изучить настолько, чтобы создать очень специфичные ингибиторы.У ВИЧ есть по крайней мере два оболочечных белка, которые он использует для связывания с клеткой и последующего внедрения. Ингибиторы для этих белков уже есть – энфувиртид и фостемсавир. К сожалению, и к ним вирус может выработать устойчивость, но в данном случае это произойдет позже, так как белки связывания обладают некоторой консервативностью. Следовательно, и лечение этими двумя лекарствами обычно более эффективно.
Только у ретровирусов, к которым относится и возбудитель СПИДа, есть особый фермент (интеграза), встраивающий генетический материал вируса в геном хозяина. И для интегразы ВИЧ уже разработано несколько ингибиторов, среди которых выделяются ралтегравир и долутегравир
На данный момент уже зарегистрировано множество так называемых нуклеотидных ингибиторов полимераз. Но из-за неспецифичного связывания с другими ферментами, в первую очередь клеточными, они имеют внушительный список побочных эффектов. Тем не менее даже такие лекарства идут в ход в критических случаях, когда польза от их применения может превысить ожидаемый вред.
Однако и в этой области есть прорывы. Для полимераз некоторых вирусов удалось найти очень специфичные, ненуклеотидные ингибиторы. Пример – эфавиренз и невирапин, лекарства против СПИДа. Их активные молекулы связываются с вирусной полимеразой уже не в активном центре молекулы, а в ее «кармане», блокируя работу фермента. Лечение такими лекарствами достаточно эффективно – до тех пор, пока вирус не обретет устойчивость к ним. А он это сделает обязательно, потому что такой «карман», в отличие от активного центра, не важен для основной деятельности полимеразы и в ходе размножения может измениться в результате мутаций.
Помимо описанных мишеней есть немало и других белков, значимых для размножения вируса. Например, это белки, «обслуживающие» стадию репликации и следующую за ней стадию трансляции – синтеза белка на основе информации, закодированной в РНК.
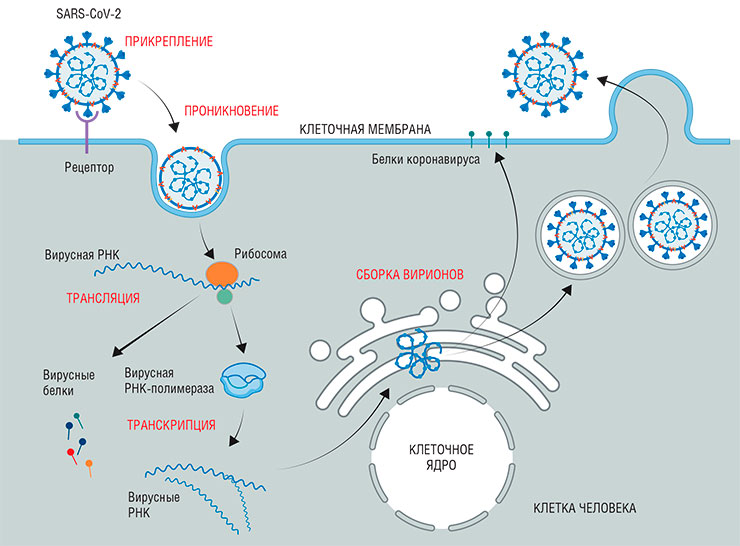
Кроме того, с переменным успехом удается создавать ингибиторы отдельных ферментов разных вирусов. К примеру, вещество балоксавир ингибирует составную часть комплекса фермента РНК-полимеразы возбудителя гриппа, который подготавливает начало репликации вируса. Балоксавир марбоксил – это пока единственное из всех специфических противогриппозных средств, доказавшее свою эффективность и безопасность во всех испытаниях.
На прицеле – протеазы
Особый интерес разработчика противовирусных препаратов вызывают протеазы – ферменты, расщепляющие белки. Например, вирусные протеазы, которые разрезают большие синтезированные «полипротеины» на отдельные функциональные белковые молекулы. Если такой фермент блокировать, размножение вируса можно остановить. К сожалению, не все вирусы нуждаются в таких протеазах, но если таковые имеются, на это сразу обращают внимание.
Все протеазы наделены примечательным сочетанием свойств, описанных выше. Во-первых, каждый из них осуществляет одну и ту же химическую реакцию в силу того, что белки у всех живых организмов построены однотипно. И если у вируса, пусть даже нового и неизученного, обнаруживается протеаза, то сразу можно уверенно говорить о ее функции и частично о строении. Во-вторых, протеазы обладают намного большей специфичностью к своим субстратам, чем те же полимеразы, потому что «разрезают» только нужные им белки и только в нужных местах. И это вполне закономерно.
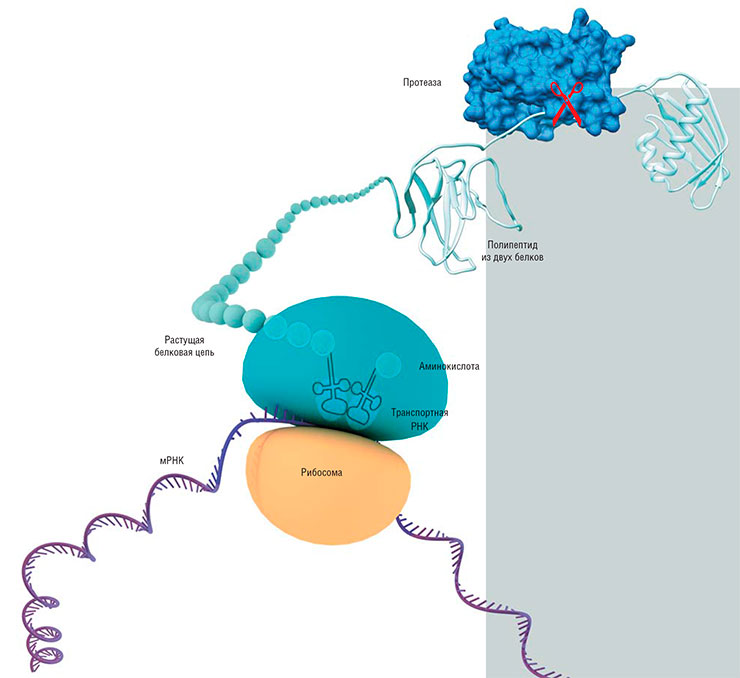
Все дело в том, что у полимераз универсальная и очень консервативная функция – точный синтез одной нуклеиновой кислоты на основе другой. И любая молекула ДНК или РНК построена на основе всего четырех «букв»-нуклеотидов, соединенных в между собой в многочисленных вариациях. Протеазы же выполняют не универсальную функцию по разрыву пептидной связи в белках: перед ними стоит задача распознать и разрезать только одну заранее определенную последовательность аминокислотных остатков белка. Отсюда следует как высокая специфичность, так и некоторая потеря консервативности у этих ферментов.
Разные протеазы проводят одну и ту же реакцию с очень разными последовательностями аминокислотных остатков. По этой причине их активный центр состоит из двух частей: каталитического центра, где проходит реакция расщепления, и связывающего центра (набор «карманов», в которых могут разместиться боковые цепи только целевого белка). Можно догадаться, что каталитические центры у всех протеаз будут очень похожими, в то время как связывающие – очень разными. При этом каталитический центр всегда намного меньше размером, так как в осуществлении химической реакции участвует лишь небольшая часть белковой молекулы.
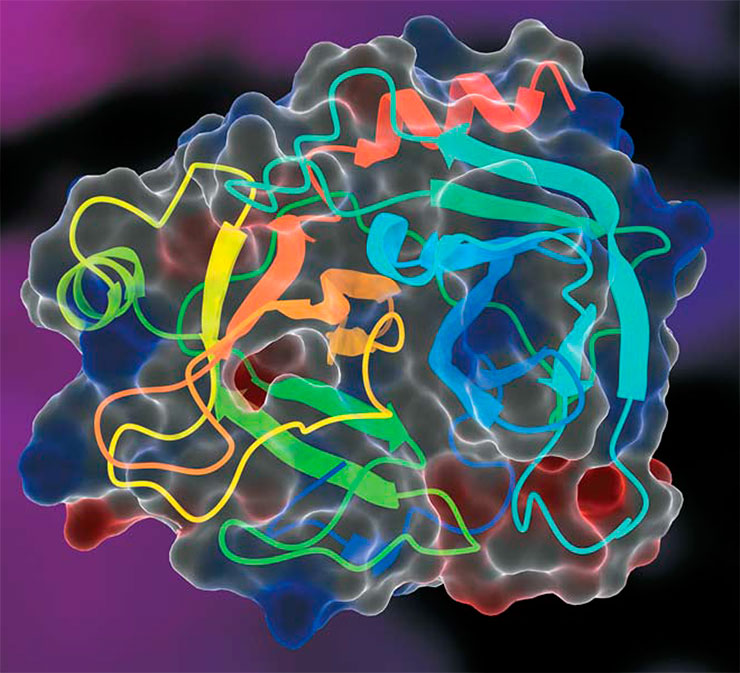
Кроме того, те же нуклеиновые кислоты могут позволить себе быть очень большими, а вот белкам «лишний вес» совсем не нужен. Ведь чем меньше белок, тем меньше ресурсов затрачивается на его создание и тем больше белковых единиц может поместиться в заданном объеме. А это важно, когда для функционирования желательно присутствие многих рабочих «копий».
В целом все эти хорошо изученные черты протеаз открывают возможности для создания для них высокоспецифичных ингибиторов, причем относительно быстро. Как идет такой процесс – рассмотрим на примере коронавирусов, представители которых стали в XXI в. причиной не только нескольких эпидемий, но и пандемии, унесшей жизни миллионов человек.
Коронавирус и его главная протеаза
Коронавирусы – это семейство РНК-содержащих вирусов, вызывающих инфекции дыхательных путей у млекопитающих и птиц. Первые случаи коронавирусных инфекций были зарегистрированы у домашних кур около ста лет назад, а у людей – во второй половине прошлого века. Коронавирусы впервые привлекли к себе пристальное внимание во время эпидемии тяжелого острого респираторного синдрома (ТОРС, или SARS), или атипичной пневмонии, возбудителем которого является SARS-Cov.
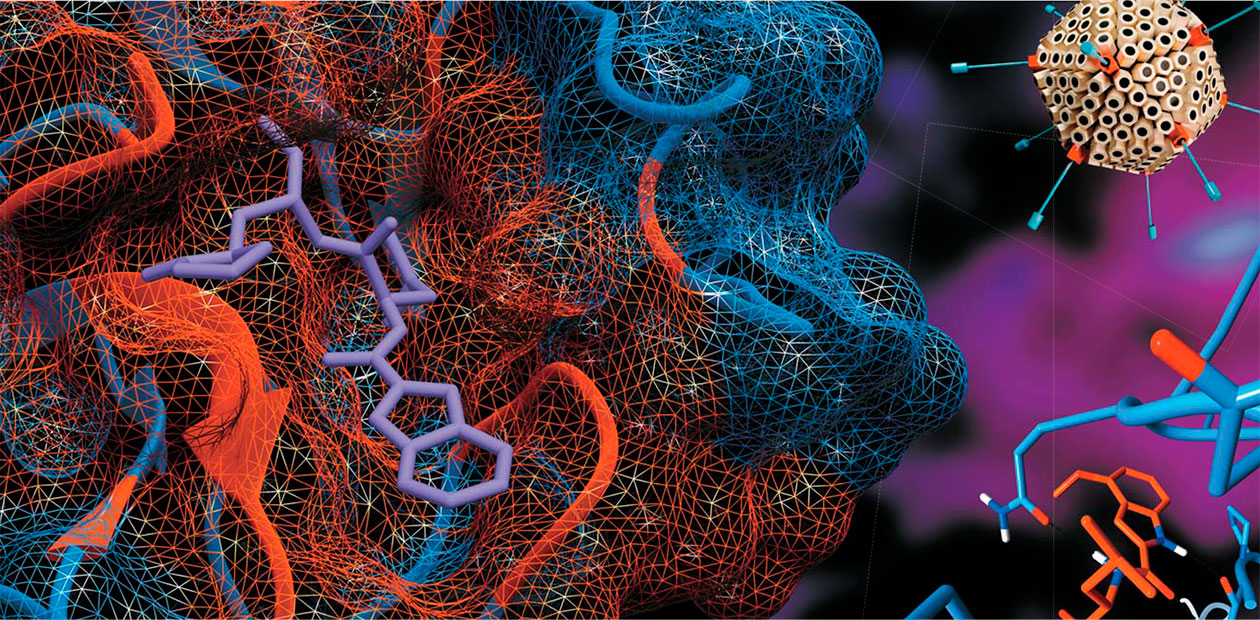
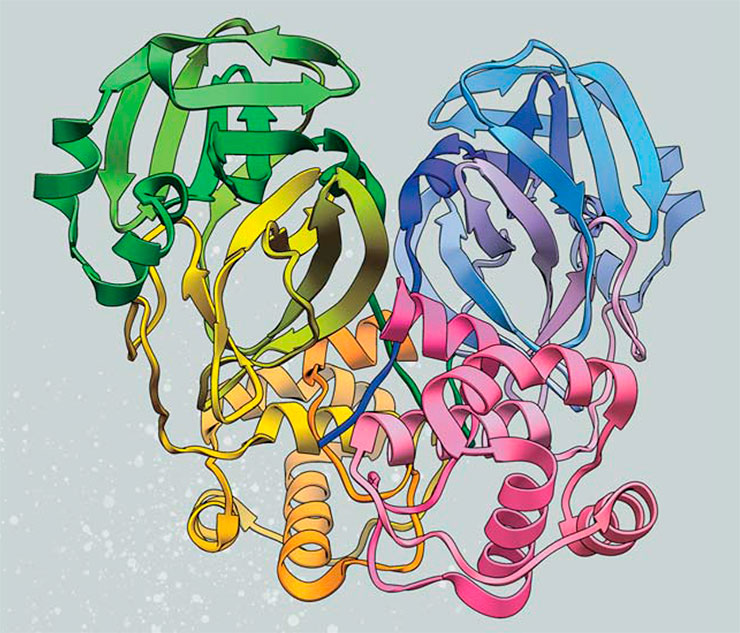 В результате изучения структуры этого вируса выяснилось, что у него есть две протеазы, одна из которых обязательна для размножения. Когда была получена трехмерная структура этой протеазы, названной главной (англ., в сокращенной форме – Mpro), оказалось, что она во многом подобна другой, известной и хорошо изученной протеазе – химотрипсину из секрета поджелудочной железы животных и человека. Кроме того, была определена специфичность Mpro, т. е. последовательность аминокислотных остатков, которую распознает и разрезает эта протеаза.
В результате изучения структуры этого вируса выяснилось, что у него есть две протеазы, одна из которых обязательна для размножения. Когда была получена трехмерная структура этой протеазы, названной главной (англ., в сокращенной форме – Mpro), оказалось, что она во многом подобна другой, известной и хорошо изученной протеазе – химотрипсину из секрета поджелудочной железы животных и человека. Кроме того, была определена специфичность Mpro, т. е. последовательность аминокислотных остатков, которую распознает и разрезает эта протеаза.
Неудивительно, что ингибиторы других протеаз, подобных Mpro, были сразу опробованы в качестве средства против коронавируса. И они оказались эффективны! Конечно, эта эффективность была низкой, но направление было задано. Следующим шагом стал поиск более специфичных ингибиторов на основе полученных знаний.
Одновременно, чтобы начать лечение тяжелобольных, были сделаны попытки найти «рабочие» лекарства среди уже официально зарегистрированных. «Перенацеливание» лекарств – быстрый и выгодный способ терапии нового заболевания, ведь характеристики таких препаратов хорошо изучены, включая их дозировку, действие на организм и побочные эффекты. И чтобы перенаправить «старое» лекарство на новую болезнь, нужно лишь проверить, будет ли оно эффективно.
В случае коронавируса результаты, к сожалению, оказались отрицательными, и не только в случае протеазы. Позже, уже после первой эпидемии коронавирусной инфекции, был опробован боцепревир – ингибитор протеазы гепатита С. Он также не показал достаточной эффективности, но, забегая вперед, скажем, что оказался очень хорошей основой для создания сильных ингибиторов Mpro.
Поиск – машинный и «ручной»
Если не получается найти лекарство среди известных, значит, нужно создавать новое. И пусть эти терапевтические молекулы будут мало отличаться от уже изученных, из принципа безопасности их придется проверять заново. Да и синтезировать их обычно также нужно с «нуля». Все вместе получается очень дорого и долго.
 Естественно, это не останавливает исследователей и заказчиков, но заставляет задуматься о способах экономии ресурсов. Со стороны исследователей главным способом является поиск среди всех уже имеющихся соединений. Трудность в том, что список этот исчисляется миллионами и должен быть сокращен.
Естественно, это не останавливает исследователей и заказчиков, но заставляет задуматься о способах экономии ресурсов. Со стороны исследователей главным способом является поиск среди всех уже имеющихся соединений. Трудность в том, что список этот исчисляется миллионами и должен быть сокращен.
При поиске нового потенциального ингибитора среди «готовых решений» сначала ставят теоретические ограничения, чтобы отсеять молекулы, которые заведомо не могут оказаться хоть сколько-нибудь действенными. Затем, составив несколько «типажей» предположительно хороших вариантов, оценивают то, что есть в наличии. Практические причины, ограничивающие разнообразие вариантов, просты: некоторые соединения могут быть ядовитыми, некоторые – иметься в недостаточных количествах даже для первичного исследования, другие находятся за тысячи километров от лаборатории, где создают новое лекарство.
Больших раздумий требует именно первый, теоретический этап. В качестве критериев отбора за основу берут все те же знания о субстрате фермента (если он есть) и уже известных молекулах, которые хоть как-то влияют на его активность. И начинают буквально измерять линейкой: оценивают общий размер и форму субстрата и ингибиторов, их отдельные части и химические группы, взаимное расположение последних… Важны и такие свойства, как электрический заряд, жесткость молекулы и т. п. Суммарно все это называется методом QSAR (quantitative structure-activity relationship) – поиск количественных соотношений «структура – свойство». Этот метод используется и при создании новых соединений путем модификации уже известных.
Задав список важных свойств потенциального ингибитора, его загружают в специальную компьютерную программу, которая проверяет на предмет соответствия все соединения из различных баз данных. На выходе получают перечень тех, которые наиболее соответствует критериям в порядке убывания.
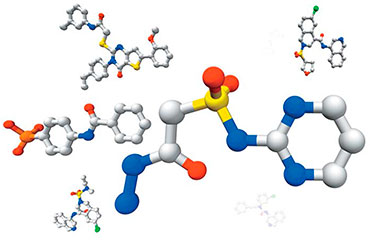 И здесь исследователей поджидают проблемы. Во-первых, выданный список может быть пуст из-за того, что было задано слишком много параметров и ни одно известное соединение даже близко ему не удовлетворяет. В таком случае набор ограничительных параметров начинают сокращать, что приводит к новой проблеме: в подавляющем большинстве случаев отобранные молекулы оказываются очень маленькими. Почему это происходит?
И здесь исследователей поджидают проблемы. Во-первых, выданный список может быть пуст из-за того, что было задано слишком много параметров и ни одно известное соединение даже близко ему не удовлетворяет. В таком случае набор ограничительных параметров начинают сокращать, что приводит к новой проблеме: в подавляющем большинстве случаев отобранные молекулы оказываются очень маленькими. Почему это происходит?
Дело в том, что при урезании списка важных свойств в первую очередь страдает сложность молекулы и ее размер – труднее всего найти именно «полноразмерную» молекулу нужной формы. Использование даже очень похожих по форме соединений является почти всегда ошибочным путем, потому что активные центры ферментов обычно достаточно «жесткие» и плохо подстраиваются под форму субстратов, что необходимо для достижения нужной специфичности. И когда молекул с подходящим аналогом этой «каталитической» части среди соединений той же формы не находится, отбираются те, у которых эта часть отсутствует.
Полученные таким образом молекулы оказываются намного меньше желаемых. Связываются с целевым белком они обычно все еще хорошо, но вот высокой избирательностью к целевому ферменту не отличаются. Как известно, различные молекулярные «карманы» имеются почти у всех ферментов, и подобные маленькие молекулы в них охотно заходят. «Застревая» там надолго, они в лучшем случае не приносят пользы, в худшем – блокируют работу других, нецелевых ферментов. Поэтому успешные находки в таких случаях – редкость.
Рациональный дизайн: играем в молекулярный конструктор
Когда не удается найти хорошие варианты молекул среди имеющихся, наступает время «ручного» вмешательства вкупе с творческим подходом. И тут нужна смекалка, ведь молекула искомого ингибитора фермента должна удовлетворять жестким ограничениям.
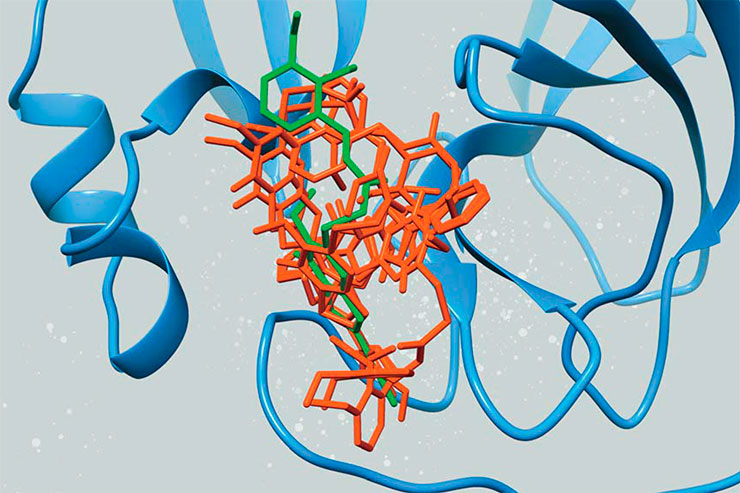
Во-первых, она должна напоминать природный субстрат, чтобы хорошо связываться с активным центром фермента, иначе он не сможет корректно работать с этим веществом. При этом необходимо, чтобы молекула ингибитора не была полной копией природного субстрата, в противном случае она не окажет блокирующего влияния. Во-вторых, молекула не должна быть слишком маленькой, чтобы сохранить специфичность (хотя есть редкие положительные примеры). Но не стоит рассматривать варианты и очень больших молекул, так как их трудно создать в реальности. Наконец, стоит избегать присутствия в молекуле ингибитора химических связей, склонных разрушаться спонтанно, а также отдельных частей, которые обладают общей токсичностью.
При разработке ингибиторов «с нуля» ради экономии реальных ресурсов полезно начинать работу с компьютерного анализа. Есть два главных и популярных компьютерных метода предсказания эффективности потенциальных ингибиторов. Первый – молекулярный докинг, при котором специальная программа получает на «входе» структуру фермента с указанием координат активного центра, где будет связываться ингибитор, и набор различных молекулярных структур для оценки. В этом методе белок «фиксируется» в пространстве, а ингибитор поворачивается вокруг него, пытаясь «пристроиться» наилучшим способом. На выходе исследователь получает список структур с лучшим связыванием.
Докинг не требует больших вычислительных ресурсов, поэтому его можно относительно быстро (за несколько дней) провести для тысяч соединений с помощью обычных компьютеров. Этот довольно грубый метод в основном используется либо для отсева совсем плохих вариантов, либо для поиска молекул с необычной и на первый взгляд неподходящей структурой.
Когда стоит задача создать действительно хороший ингибитор или значительно изменить структуру уже имеющего, используют метод молекулярной динамики (МД). Он может быть применен сразу, минуя этап докинга, в случае модификации малоэффективных ингибиторов, для которых уже известно, как будет располагаться в белковом «кармане» измененная молекула.
Преимущество метода МД в том, что в этом случае исследование поведения комплекса «белок – ингибитор» идет во времени, а не одномоментно, как в докинге. С помощью такого компьютерного моделирования можно более точно предсказать различные взаимодействия, возникающие между ингибитором и активным центром фермента, в то время как в докинге основное внимание уделяется соответствию форм молекулы и карманов связывающего центра.
Здесь же начинается, по сути, игра в конструктор, вот только моделью выступает не какая-нибудь машинка, а потенциальное лекарство. Опробовав в МД различные известные молекулы, оказывающие влияние на фермент, и соотнеся результаты моделирования с результатами реальных опытов, можно выявить закономерности их взаимодействия и понять, что нужно изменить.
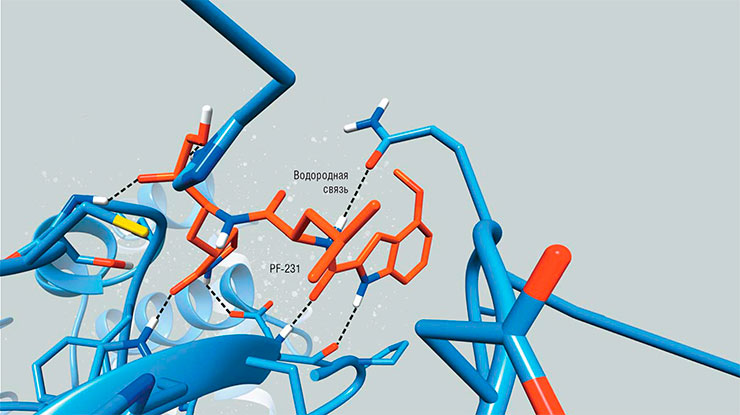
Например, можно увидеть, что какая-либо часть молекулы известного ингибитора не находится в контакте с поверхностью белка, что является признаком «малополезности». Ведь ингибитор должен как можно теснее контактировать с белком, чтобы между ними действовала максимальная сила притяжения, а также максимальная «прижимная сила» со стороны воды как растворителя. В другом случае можно обнаружить, что ингибитор заметно меняет форму активного центра фермента. Это означает, что ему нужна дополнительная энергия, чтобы противостоять жесткости «кармана» и изменить его форму. В реальности свободные молекулы такого ингибитора не смогут связаться с ферментом.
Есть еще множество разных признаков, по которым оценивается потенциальная «сила» ингибитора при моделировании методом МД. После оценки известных молекул можно приступать к их улучшению. К примеру, есть возможность так изменить ингибитор, что он станет вести себя с ферментом как «приклеенный». Каждое такое изменение подразумевает отдельное моделирование, которое занимает уже больше времени – сутки-двое для одной молекулы. Но подобные затраты окупаются, да и само это занятие скучным не назовешь.
Ингибиторы коронавирусной Mpro
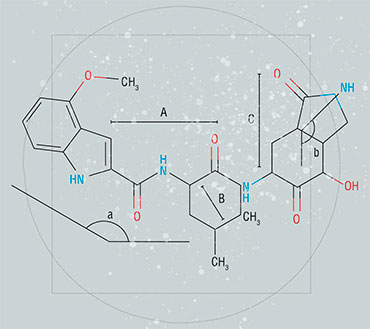
В случае коронавирусной протеазы Mpro работы по рациональному дизайну начались с изучения ингибиторов протеаз других вирусов. Быстро выяснилось, что заметное влияние на нее оказывает рупинтривир – ингибитор протеазы, первоначально разработанный для лечения ОРВИ, вызванной риновирусами. Это действие препарата было предсказано на основе сравнения специфичности риновирусной и коронавирусной протеаз, которые оказались близки.
Рупинтривир – это так называемый пептидоподобный ингибитор, по своей структуре напоминающий цепь из аминокислотных остатков. Чтобы такая цепь остатков не расщеплялась ни самой протеазой, ни другими ферментами, необходимо было изменить ту часть молекулы, которая подвержена расщеплению.
Ранее уже упоминалось, что малый размер каталитического центра протеазы является плюсом при разработке ингибиторов. Преимущество заключается в том, что поскольку каталитический центр мал, то и часть молекулы субстрата, в которой разрывается связь, также мала. И защитить ингибитор от расщепления можно, изменив лишь небольшой его фрагмент, причем такое малое преобразование вряд ли повлияет на силу его связывания с ферментом.
Для рупинтривира и многих других ингибиторов разных протеаз было разработано несколько способов защиты от расщепления самой протеазой. При этом удалось не только не нарушить, но в некоторых случаях даже улучшить связывание, заставляя ингибитор создавать с ферментом «сильную» ковалентную химическую связь.
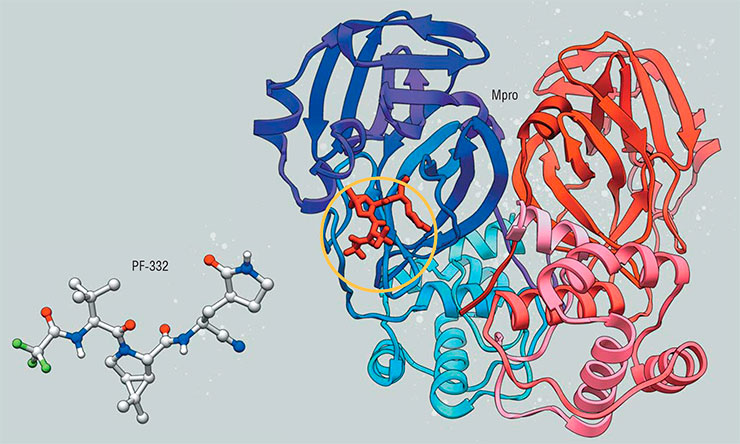
Еще одна защита требуется «концам» молекулы ингибитора, которые не должны напоминать стандартные аминокислотные остатки, чтобы избежать расщепления другими ферментами. А так как обычно такие защитные группы имеют значительный размер и могут сами сильно взаимодействовать с ферментом, очень желательно объединить защитные свойства со связывающими. Для рупинтривира и протеазы риновируса этого добиться удалось, но позже выяснилось, что именно из-за этой защитной группы ингибитор плохо связывается с протеазами других вирусов.
Ингибитор как лекарство
В случае коронавируса – возбудителя ТОРС – подходящие варианты ингибитора для протеазы Mpro нашлись сравнительно быстро. Исследователи из американской транснациональной компании Pfizer уже в 2004 г. предложили ингибитор, известный как PF‑231 (Hoffman, Kania, Brothers et al., 2020). Он обладает прекрасными блокирующими свойствами по отношению к Mpro не только SARS-CoV, но и всех последующих коронавирусов и в этом смысле до сих пор не превзойден. Но при попытке сделать из него лекарство возникло несколько серьезных проблем.
Дело в том, что уже при отборе наиболее перспективных вариантов ингибитора (или улучшении уже имеющегося) о нем нужно думать как о лекарстве, которое будет работать не только в пробирке, но и в организме. Ведь чтобы дойти до своей мишени, ему придется преодолеть много различных препятствий. В этом смысле важны такие свойства, как, к примеру, растворимость и способность проникать через клеточную мембрану. И в идеале это нужно принимать во внимание сразу, потому что можно зайти в тупик, создав такие молекулы, которые даже теоретически не будут работать в организме, как их ни оптимизируй.
Конечно, исследователи из Pfizer пытались сразу учесть все факторы, но создать совершенную молекулу с первого раза им не удалось: в своем первоначальном виде PF‑231 не смог преодолеть две проблемы.
Во-первых, PF‑231 очень плохо всасывается в желудочно-кишечном тракте – около 98–99 % действующего вещества выводится из организма. Отсюда – невозможность принимать препарат в виде таблетки, чтобы получить терапевтическую дозу. Конечно, пероральный прием, в принципе, необязателен: лекарство всегда можно вводить путем инъекций. Так оно действует быстрее, и можно принимать более высокие дозы препарата. Но во время эпидемий, когда каждый день в больницы поступают сотни и тысячи новых пациентов, важность самостоятельного приема лекарства резко возрастает.
Когда же препарат попытались вводить внутривенно, то столкнулись с другой проблемой – плохой растворимостью. Растворимость вещества – это максимальное число молекул, которые можно поместить в единицу объема растворителя без выпадения осадка. И растворимость ингибитора должна быть достаточной высокой, чтобы человек мог принять дозу, необходимую для полного ингибирования целевого фермента.
Но если на сегодня целенаправленно улучшить всасываемость вещества трудно (все влияющие на это факторы пока неизвестны), то повысить растворимость вещества можно достаточно легко (Boras, Jones, Anson et al., 2021). Поэтому PF‑231 был модифицирован и уже в таком виде протестирован в клинических испытаниях, где тем не менее проиграл другой, более современной разработке той же компании, известной как нирматрелвир (кодовое название PF‑332), которая в итоге станет основой лекарства против коронавируса под названием «Паксловид» (Anderson, 2022).
К сожалению, несмотря на несколько эпидемий коронавирусных инфекций и наличия «заготовок» лекарств, включая PF‑231, сделанных чуть ли не два десятилетия назад, к их клиническим испытаниям приступили только несколько лет назад. А закончились эти эксперименты совсем недавно – в конце 2021 г., спустя два года после начала пандемии. В далеком 2004 г., когда первая коронавирусная эпидемия практически сошла на нет, начинать тестирование этих препаратов казалось нецелесообразным. Если бы мы могли предвидеть будущее…
Лекарство из Сибири
В новосибирском Институте химической биологии и фундаментальной медицины СО РАН решение присоединиться к поискам новых высокоэффективных ингибиторов главной протеазы коронавируса было принято в начале 2021 г. после совместного обсуждения с коллегами из московского Института биоорганической химии РАН.
На момент начала исследования наиболее перспективным все еще считался PF‑231, хотя уже было проанализировано много других ингибиторов протеаз, созданных с 2004 г. Результаты всех этих экспериментов были тщательно изучены, на их основе выдвинуто несколько оригинальных предположений о связях между структурой и эффективностью ингибиторов (Zakharova, Kuznetsova, Uvarova et al., 2021).
Препарат «Паксловид», созданный компанией Pfizer для лечения COVID‑19, содержит комбинацию из нирматрелвира – ингибитора главной протеазы SARS-CoV‑2, который останавливает размножение и распространение вируса, и ритонавира, предотвращающего быстрое расщепление нирматрелвира в организмеВ качестве основного был выбран путь изменения уже существующих молекул. С помощью метода молекулярной динамики и моделирования десятков различных химических соединений выяснилось, что есть возможность улучшить растворимость и, вероятно, всасываемость ингибитора на основе PF‑231. Другой вариант – повысить силу связывания с ферментом у других соединений, которые первоначально обладают достаточной растворимостью.
Примерно в это же время была опубликована статья специалистов Pfizer с промежуточными результатами клинических испытаний PF‑231 и PF‑332 (Boras, Jones, Anson et al., 2021). Оказалось, что в компании частично использовали те же модификации ингибитора, которые обсуждали и новосибирские специалисты. Но существенные различия между подходами все же остались, поэтому после стадии рационального дизайна соединений в ИХБФМ СО РАН было принято решение перейти к этапу синтеза данных веществ и их проверки в реальных опытах.
Этап синтеза химических соединений – один из самых долгих при разработке нового препарата. Ведь, хотя ингибиторы и являются пептидоподобными веществами, их невозможно синтезировать так, как это делает живая клетка. Присоединение каждой химической группы к центральному звену выливается в одно-двухнедельную работу целой группы химиков-синтетиков, а создание целевой молекулы растягивается более чем на полгода.
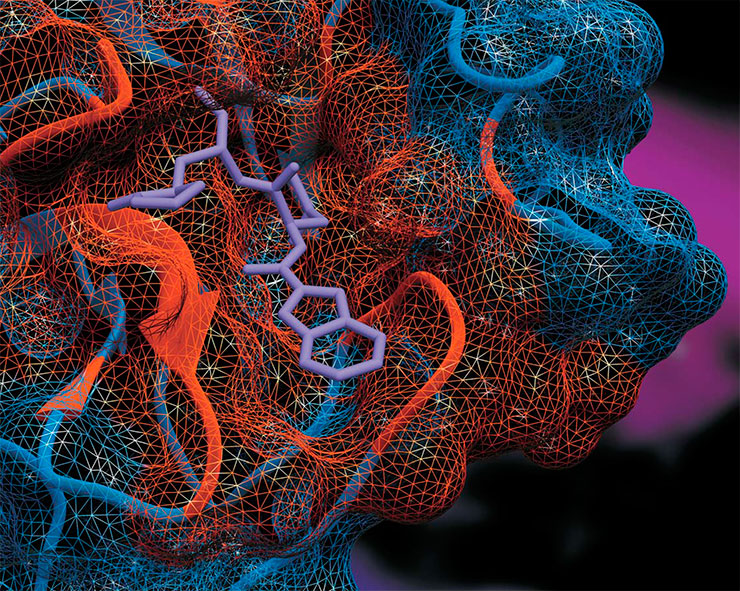
К середине 2022 г. совместными усилиями новосибирских и московских ученых синтезировано уже более десятка новых перспективных соединений, ингибирующие свойства которых в отношении главной протеазы коронавирусов проверены. Четыре из них продемонстрировали способность блокировать главную протеазу возбудителя COVID‑19 – коронавируса SARS-CoV‑2. Все эти вещества проходят дальнейшую проверку и в перспективе могут стать основой для создания отечественного лекарства против коронавирусной инфекции.
Понимание принципов «взаимоотношений» между вирусами, бактериями, грибами и высшими организмами, в первую очередь человеком, позволяет нам определить «болевые» этапы в процессах размножения этих микроорганизмов и распространения инфекционных заболеваний, вызванных конкретным возбудителем.
При этом возможности человечества в непрекращающейся борьбе с инфекциями значительно возрастают не только благодаря разработке новых экспериментальных подходов, но и за счет все более активного использования высокопроизводительных вычислений, машинного обучения и передовых компьютерных методов в целом. Сочетание этих двух «потоков» современных знаний и рост технической оснащенности позволяет раскрыть множество тайн «химии природы», включая молекулярные механизмы жизнедеятельности бесчисленных микроорганизмов, населяющих нашу планету. И это открывает возможность создания прорывных разработок для борьбы с инфекционными заболеваниями.
Литература
Кузнецова А. А., Алексеева И. В., Бакман А. С., Кузнецов Н. А. Ферменты для ДНК: скальпели, ножницы и швейные иголки // НАУКА из первых рук. 2022. № 5/6 (93). С. 24–33.
Марьянович А. Т., Кормилец Д. Ю. Коронавирус: не стреляйте, я свой! // НАУКА из первых рук. 2022. № 5/6 (93). С. 60–67.
Хельтье Х.-Д., Зиппль В., Роньян Д., Фолькерс Г. Молекулярное моделирование. Теория и практика. 3-е изд. (электрон.). М.: Бином, 2015.
Anderson A. S. A lightspeed approach to pandemic drug development // Nat. Med. 2022. V. 28. P. 1538.
Boras B., Jones R. M., Anson B. J. et al. Preclinical characterization of an intravenous coronavirus 3CL protease inhibitor for the potential treatment of COVID-19 // Nat. Commun. 2021. V. 12. P. 6055.
Hoffman R. L., Kania R. S., Brothers M. A. et al. Discovery of Ketone-Based Covalent Inhibitors of Coronavirus 3CL Proteases for the Potential Therapeutic Treatment of COVID-19 // J. Med. Chem. 2020. V. 63 (21). P. 12725–12747.
Owen D. R., Allerton C. M. N., Anderson A. S. An oral SARS-CoV-2 Mpro inhibitor clinical candidate for the treatment of COVID-19 // Sci. 2021. V. 374, № 6575. P. 1586–1593.
Zakharova M. Yu., Kuznetsova A. A., Uvarova V. I. et al. Pre-Steady-State Kinetics of the SARS-CoV-2 Main Protease as a Powerful Tool for Antiviral-Drug Discovery // Front. Pharmacol. 2021. V. 12. P. 773198.