Каталитическая РНК: лекарство из добиологической жизни
Основная идея концепции «мира РНК», появившейся в 1960-х гг., проста: на ранних стадиях предбиологической эволюции объекты, способные размножаться и конкурировать за ограниченные ресурсы, представляли собой отдельные молекулы РНК, а появившиеся позднее белки и ДНК стали лишь дополнением, хотя и очень важным, к общей схеме потока генетической информации. Эта концепция, поначалу граничившая с фантастикой, сейчас прочно заняла свое место в мировой биологии.
Важнейшим открытием стало обнаружение каталитических свойств РНК, сделанное в лаборатории профессора Йельского университета (США) С. Альтмана при изучении фермента РНКаза P (сейчас такие ферменты-катализаторы называются рибозимами). За открытие каталитических свойств РНК Альтман совместно с Т. Чехом получил Нобелевскую премию по химии (1989). Объяснение природы РНКазы P стало отправной точкой для превращения ее в инструмент для разрушения нежелательных РНК, например, бактериальных. Подобная стратегия лечения обещает человечеству победу в гонке, до сих пор считавшейся проигранной – между новыми лекарствами и устойчивостью к ним, которую приобретают бактерии
Один из таких реликтов за последние сорок лет прошел путь от экзотического биохимического курьеза до возможной «панацеи» от всех болезней. Эта история показывает, как, казалось бы, в исключительно фундаментальных исследованиях может внезапно родиться новая идея, потенциально способная преобразить важнейшую область человеческой деятельности – медицину. В нашем случае этим объектом является РНКаза P – фермент, вовлеченный в пост транскрипционные (т. е. после считывания с ДНК) модификации РНК.
Про РНК «для чайников»
В соответствии с центральной догмой молекулярной биологии «текст» наследственной информации, написанный буквами-нуклеотидами РНК (например, …AAAUUUCGAUC…), в процессе трансляции переводится в другой текст, записанный буквами-аминокислотами. Трансляцией, т. е. синтезом белков на матрице кодирующей РНК, занимаются рибосомы – специальные клеточные макромолекулярные машины по производству белка. Функционирование рибосом невозможно без еще двух классов РНК, уже некодирующих: рибосомной РНК (рРНК) и транспортной РНК (тРНК).
Рибосомы кишечной палочки (бактерии Escherichia coli), «рабочей лошадки» молекулярной биологии, содержат три разные молекулы рРНК, а у нас с вами – четыре. Чтобы жизнь не казалась биологам медом, каждая из этих рРНК у E. coli кодируется семью разными генами, которые очень схожи друг с другом; ситуация у человека примерно такая же.
Если же взглянуть на тРНК, то здесь все еще сложнее: у кишечной палочки насчитывается 86 генов, кодирующих тРНК для 20 стандартных аминокислот, но бактерий оставляет далеко позади человек со своими 497 ядерными и 22 митохондриальными транспортными РНК. Разумеется, такого количества разных тРНК более чем достаточно для кодирования 20 аминокислот или даже 61 триплета-антикодона. Известно, что некоторые из различий между молекулами тРНК, содержащими один и тот же триплет, имеют функциональное значение, и клетка использует какой-то конкретный вид тРНК в зависимости от обстоятельств.
Структуру тРНК часто изображают в виде «клеверного листа». На самом деле удивительно, что такая относительно короткая цепочка (большинство тРНК имеют в длину от 75 до 95 нуклеотидов) способна сворачиваться в структуру, содержащую четыре ветви – «стебель» и три петли. На одной из петель расположен антикодон – участок из трех нуклеотидов, узнающий кодон, кодирующий определенную аминокислоту, в матричной РНК.
Помимо основных петель, тРНК содержит и так называемую вариабельную петлю, длина которой служит основным признаком, по которому тРНК делят на две группы: у тРНК класса I она короткая (3—5 нуклеотидов), а у класса II может быть даже длиннее основных петель. Акцепторный стебель содержит короткий одноцепочечный участок на 3’-конце (обычно 4 нуклеотида длиной), заканчивающийся последовательностью …CCA, которая способна ковалентно присоединять аминокислоту с образованием аминоацил-тРНК, основного «кирпичика» белкового синтеза.
Но такая привычная всем картинка с клеверным листом является лишь схемой: истинная пространственная структура тРНК совершенно другая и напоминает скорее букву Г размерами ~6⨯6 нм, в которой антикодон и 3’-конец акцепторного стебля разнесены на максимально большое расстояние друг от друга.
«Неразборчивый» рибозим
Обычно тРНК синтезируется в виде длинной молекулы-предшественника (например, у бактерий несколько рядом стоящих генов обычно «считываются» вместе одной молекулой РНК). Поэтому в ходе своего созревания тРНК вырезается из более длинных транскриптов. Этот процесс осуществляет фермент РНКаза E, однако при этом на 5’- и 3’-концах предшественника тРНК остается несколько лишних нуклеотидов, и для их удаления требуется действие других, специфичных нуклеаз.
Один из таких ферментов, РНКаза P, занимается тем, что удаляет нуклеотиды с 5’-конца предшественника тРНК. Эта нуклеаза стала главным объектом работ в моей лаборатории с начала 1970-х гг., когда мы открыли, что тРНК синтезируется из РНК-предшественника. Но, безусловно, самое главное и неожиданное наше открытие, касающееся этой нуклеазы, опубликованное в 1983 г. в журнале Cell, заключалось в обнаружении каталитических свойств входящей в ее состав молекулы РНК. Другими словами, фермент оказался не белком, а РНК – сейчас такие катализаторы называются рибозимами.
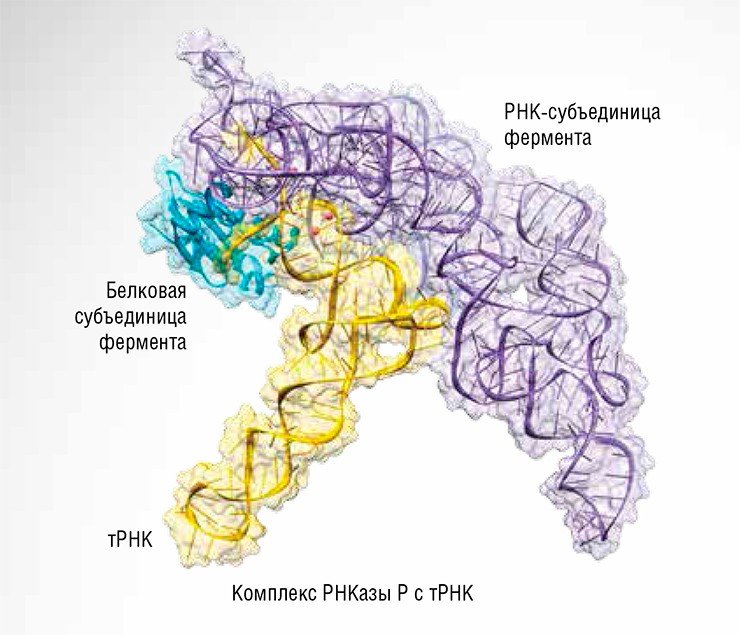
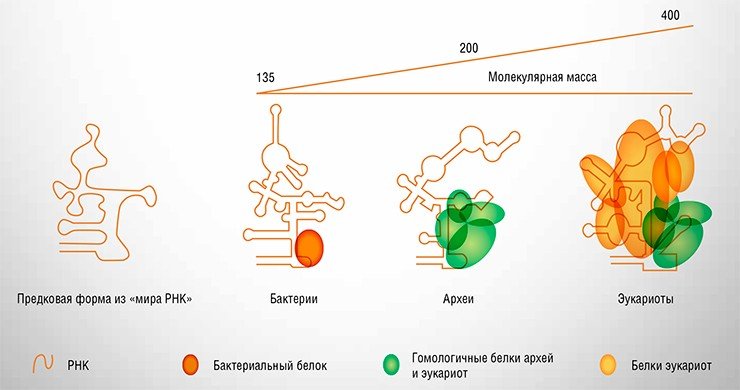
На самом деле РНК в РНКазе P никогда не работает сама по себе. Она может катализировать реакцию в пробирке, но во всех живых организмах она находится в комплексе как минимум с одним белком, а у высших организмов (эукариот) число последних достигает десяти. Хотя РНК даже и при удалении белков сохраняет частично каталитическую активность, она не может работать в клетках, полностью лишенных одного из белковых компонентов РНКазы P. Однако достаточно логично предположить, что все известные сегодня -РНКазы P произошли от предшественника, содержавшего только РНК, когда бы этот «предок» ни существовал: в самые ранние эволюционные времена «мира РНК» или позже, когда конвейер белкового синтеза стал приобретать современный вид.
Наши исследования механизма действия РНКазы P позволили установить минимальные требования к ее субстрату. Как должна выглядеть молекула РНК, чтобы ее мог узнавать и расщеплять этот рибозим?
Поразительно, но структура в виде клеверного листа для этого совершенно не требуется. РНКаза P эффективно расщепляет любую РНК, которая напоминает стебель тРНК, т. е. является частично двуцепочечной со свободным одноцепочечным 3’-концом …RCCA (где R – остаток аденина либо гуанина). РНКаза P расщепляет такие субстраты с 5’-конца в том месте, где кончается двуцепочечная ДНК и начинается одноцепочечный «хвост». Даже если взять в качестве мишени одну РНК с любой последовательностью, а другую – комплементарную ей – снабдить …RCCA-хвостиком (так называемая внешняя направляющая последовательность), то мишень все равно будет расщеплена.
Причины такой «неразборчивости» ясно следуют из строения РНКазы P, которое было расшифровано методом рентгеноструктурного анализа. Рибозим связывает субстрат в основном за счет соответствия своей структуры форме субстрата, а специфичные комплементарные связи образуются лишь в области 3’-конца, где расположен неизменный «хвостик». Более того, можно использовать даже химически измененную направляющую РНК, лишь бы только она содержала последовательности, требуемые для распознавания.
Против лекарственной устойчивости
Объяснение субстратной специфичности РНКазы P стало отправной точкой для дальнейших поисков. Раз мы можем при помощи РНКазы P расщепить практически любую РНК, почему бы не превратить ее в инструмент для разрушения нежелательных РНК? Если бы мы могли, например, ввести внешнюю направляющую РНК в клетки патогенных бактерий, их собственная РНКаза P разрушила бы комплементарную им клеточную РНК-мишень, потеря которой была бы для бактерии летальна.
Нужное ли это дело? Широкое неконтролируемое использование антибиотиков привело к росту встречаемости микробов с лекарственной устойчивостью. Одна из главных причин ее появления в том, что бактерии легко обмениваются кусками генетического материала (плазмидами), которые зачастую несут гены устойчивости к антибиотикам. Так что если подобная плазмида появляется в популяции каких-то бактерий или даже в микробной экосистеме, состоящей из разных видов, то очень скоро все ее члены становятся ее носителями в случае, если в окружающей среде присутствует соответствующий антибиотик. Все другие бактериальные клетки просто вымрут.

Нужно уточнить, что лекарственная устойчивость может развиваться и по другим причинам, связанным с мутацией белка-мишени в лекарстве, с производством клетками слишком большого количества белка-мишени, а также с активацией генов, ответственных за выведение лекарства из организма. В целом же масштаб проблемы лекарственной устойчивости и связанных с ней рисков огромен. Например, сегодня во всем мире наблюдаются формы туберкулеза с множественной лекарственной устойчивостью, нечувствительные к противотуберкулезным антибиотикам первой линии (изониазиду и рифампицину) и ответственные за 4 % новых случаев и 20 % рецидивов заболевания. Если же туберкулезные бактерии выработали еще и устойчивость к хинолоновым антибиотикам и средствам второй линии – канамицину и др., то они вызывают заболевание с экстремальной лекарственной устойчивостью. И такие случаи в мире насчитываются десятками тысяч ежегодно. Добавим, что в Индии, Иране и Италии уже наблюдаются случаи туберкулеза с тотальной лекарственной устойчивостью, которые в принципе не поддаются никаким современным антибиотикам.
Ситуацию не улучшает и тот факт, что разработка нового антибиотика стоит миллионы долларов, и фармацевтические компании не выстраиваются в очередь, чтобы потратить эти миллионы на создание недорогих лекарств для узкой группы потребителей. Пациенты же, которые, не раздумывая, потратили бы десятки тысяч долларов за курс химиотерапии при раке, продлевающий жизнь на несколько месяцев, неохотно платят сотню долларов за лечение инфекции.
Точное попадание
Осознав терапевтический потенциал внешних направляющих последовательностей РНКазы P, мы стали искать способ эффективно доставлять их в клетки бактерий. Для этого направляющие последовательности соединили с особыми пептидами (короткими белковыми фрагментами), которые могли проделывать дыру в клеточной стенке бактерий либо активно транспортироваться в клетку. Направляющая последовательность в этом случае играет роль своеобразного «пассажира».
Другим важным решением стал выбор химических свойств направляющих последовательностей: мы использовали не обычные РНК или ДНК, а так называемые морфолиновые олигонуклеотиды, в которых вместо углеводного остатка рибозы или дезоксирибозы стоит гетероциклическая морфолиновая группа. Такие конструкции более стабильны в клетках и образуют более тесные комплексы с РНК-мишенями.
В качестве мишени мы использовали бактериальную мРНК, транскрибируемую с гена gyrA, который кодирует фермент ДНК-гиразу, необходимый для репликации бактерий. Инактивация ДНК-гиразы смертельна для бактериальных клеток. Поэтому гираза – известная мишень для таких важных групп антибиотиков, как фторхинолоны (например, популярный в последнее время антибиотик ципрофлоксацин) и аминокумарины.
Ген gyrA настолько консервативен, что оказалось возможным создать направляющую последовательность, общую для целого ряда патогенов. В нашей лаборатории бактерицидные свойства направляющих последовательностей были исследованы на нескольких видах бактерий, которые либо сами патогенны, либо являются моделью опасных бактерий. В большинстве случаев при применении нашего препарата выживало менее 1 % бактерий, хотя нужно признать, что концентрация препарата была при этом достаточно высока по сравнению с рабочими концентрациями привычных антибиотиков.
Воодушевившись первым успехом, мы обратили внимание на другую болезнь – малярию. Один из возбудителей малярии, Plasmodium falciparum, относится не к бактериям, а к одноклеточным эукариотам. Однако в клинических изолятах этого паразита также наблюдается устойчивость ко многим противомалярийным препаратам. Когда мы разработали направляющую последовательность для направленного расщепления мРНК, кодирующей ДНК-гиразу плазмодия, и ввели ее в зараженные эритроциты, то паразит прекратил расти. Однако он чувствовал себя прекрасно, если мы вводили направляющие последовательности, разработанные для бактериального гена gyrA, т. е. в этом случае специфично разрушалась именно целевая мРНК P. falciparum.
Многие лекарства с несчастливой судьбой кончают свою карьеру в тот момент, когда, несмотря на многообещающие предварительные результаты, не показывают активности в условиях живого организма. Поэтому на следующем этапе мы опробовали свой подход в ситуации, более приближенной к реальности, – на гнойных ранах.
Разумеется, ради науки страдали не люди, а лабораторные мыши, которым в область спины делали укол, а в получившуюся ранку вносили суспензию золотистого стафилококка – частого возбудителя кожных инфекций человека. На следующий день рану покрывали специальным гелем, содержащим морфолиновый олигонуклеотид, направленный на мРНК бактериального гена gyr, ранее прекрасно зарекомендовавший себя на чувствительных и устойчивых к антибиотикам штаммах; контролем служила либо неспецифичная последовательность, либо обычный физиологический раствор. Оказалось, что раны заживали значительно быстрее у мышей, пролеченных активным морфолиновым олигонуклеотидом, по сравнению с контрольными группами. Судя по данным микроскопии, лечение приводило к лучшей регенерации эпителия и зрелого коллагенового слоя. Более того, в ранах таких мышей численность бактерий была также намного меньше. Таким образом, строгий тест на активность в организме млекопитающих был пройден – по крайней мере, на мышах.
Стратегия лечения, основанная на действии рибозима РНКазы P, обещает человечеству победу в гонке, которая до сих пор считалась проигранной: между новыми лекарствами и устойчивостью к ним, которую приобретают бактерии. Ведь когда разработка нового препарата стоит 100 млн долларов, а путь от идеи до аптечной полки занимает 10 лет, а бактерии за один-два года становятся совершенно к нему устойчивы, то гадать о победителе не приходится.
Препараты, способные целенаправленно расщеплять бактериальную РНК, могут кардинально изменить эту ситуацию. После подтверждения безопасности и эффективности этой группы соединений, например, морфолиновых олигонуклеотидов, соединенных с определенным пептидом, способным проникать в клетку, можно достаточно свободно варьировать направляющую последовательность, нацеливая ее на различные жизненно важные гены болезнетворного микроорганизма. Или даже комбинировать мишени, что делает появление лекарственной устойчивости практически невозможным. Наконец и для фармакологии это, скорее, исключение, чем правило – один и тот же тип лекарств может действовать как на бактерий, простейшие и грибки, так, возможно, даже на вирусы и определенные типы раковых клеток. Для этого достаточно лишь найти способ доставки препарата в нужное место.
Почему же врачи до сих пор при лечении инфекций полагаются на ампициллин, хлорохин и прочий арсенал многолетней давности? Ответ лежит в основном в экономической плоскости. Морфолиновые (да и любые другие) нацеливающие последовательности действительно дороже традиционных антибиотиков, массовое производство которых налажено, и фармацевтические компании боятся того, что пациенты и врачи будут предпочитать продолжать использовать старые лекарства. Однако разница в цене не столь велика: одна доза может стоить на 2–3 доллара дороже, чем доза обычного антибиотика. Терапия на основе нацеливающих последовательностей РНКазы P эффективна и сопряжена с меньшими побочными эффектами. На наш взгляд, пришло время объединить усилия ученых, врачей, фармацевтических компаний и государства и вложиться в новую технологию, которая сулит огромную выгоду для всех.
Литература
Власов В. В., Воробьев П. Е. Мир РНК: вчера и сегодня // НАУКА из первых рук. 2012. № 3 (45). С. 40–49.
Горман К., Файн Марон Д. Революция в мире РНК // В мире науки. 2014. № 6. С. 70–77.
Григорович С. Вначале была РНК? В поисках молекулы первожизни // Наука и жизнь. 2004. № 2.
Автор благодарит проф., д. б. н. Д. Жаркова (ИХБФМ СО РАН, Новосибирск) за подготовку публикации на основе лекции, прочитанной автором в мае 2014 г. в Новосибирске.
Работа поддержана грантом Правительства РФ (2013)