Биочипы – высокие технологии в медицинской диагностике
Открытие функционального значения тысяч генов и молекулярных механизмов действия множества ферментов стало революционным событием в биологии, оказавшим и продолжающим оказывать огромное влияние на развитие медицины XXI в. Перед учеными и медиками открылись уникальные возможности для выяснения причин многих инфекционных и наследственных заболеваний, а также разработки эффективных методов их лечения. В свою очередь, развитие новых диагностических методов потребовало и создания новых технологий многопараметрического анализа биологических образцов, с помощью которых можно одновременно исследовать множество белковых и ДНК-маркеров различных заболеваний, функционально-значимых биологических макромолекул и их комплексов. Так появилась технология биологических микрочипов, способных, подобно микрочипам электронным, извлекать и обрабатывать огромные массивы информации из одного небольшого образца биологического материала, полученного от конкретного пациента
За последние десятилетия был накоплен огромный объем знаний о молекулярных основах биохимических процессов в живых организмах. Это дало возможности не только точно диагностировать то или иное заболевание, но и оценить вероятность его возникновения еще до проявления у пациента клинических симптомов, а также подобрать эффективную терапию. Подавляющую часть такой информации получают с помощью лабораторной диагностики, на которую в мире ежегодно расходуется свыше 100 млрд долларов. В России в 1970 г. она насчитывала 81 биохимический / молекулярный тест, в 2000 г. – 170, а сегодня число тестов измеряется тысячами!
Большинство важнейших современных методов молекулярной диагностики основано на анализе данных, полученных при исследовании структуры геномов человека и микроорганизмов. В первую очередь речь идет о полимеразной цепной реакции (ПЦР). Обычно ДНК содержится в образцах в минимальных количествах, однако с помощью ПЦР можно в миллионы раз «размножить» в исследуемой пробе биоматериала определенные фрагменты этих макромолекул. «Мишенями» могут служить бактериальные или вирусные гены, генетические маркеры раковых опухолей и т. п. С помощью этого метода можно определить наличие, к примеру, возбудителя болезни, даже если в пробе присутствует всего несколько молекул его ДНК.
Однако возможности методов, базирующихся на ПЦР, ограничены в случае, когда речь идет об одновременном анализе десятков и сотен различных биомаркеров. И здесь на первый план выходит уже успешно зарекомендовавшая себя технология биологических микрочипов (биочипов). Достоинство этой технологии в том, что тест проводится в формате «один образец – один реакционный объем биочипа», т. е. образец не нужно разделять на несколько частей и их отдельно анализировать. Такой формат намного повышает чувствительность анализа и снижает его трудоемкость и стоимость, что дает возможность клинико-диагностическим лабораториям тестировать десятки и сотни образцов за одну рабочую смену.
Сегодня ведущие научные журналы регулярно публикуют обзоры, посвященные биологическим микрочипам, которые производят многие десятки компаний, а объем продаж составляет сотни миллионов долларов в год. Вместе с тем сама идея создания биочипов родилась лишь четверть века назад, и одним из мест рождения этой технологии стал Институт молекулярной биологии им. В. А. Энгельгардта Российской академии наук.
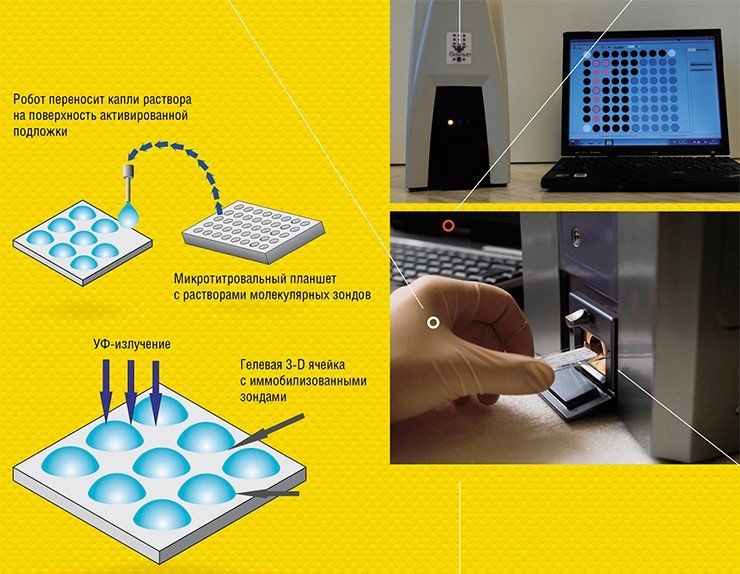
С самого начала подход российских исследователей отличался удачным выбором ключевых технологических решений, благодаря которым технологии биочипов ИМБ РАН продолжают оставаться конкурентоспособными в мировой науке. Многие из этих подходов (например, замена радиоактивных меток на флуоресцентные, применение гидрогеля и элементов сферической формы) стали использовать в своей работе другие исследователи, занимающиеся разработкой биочипов. А с 2000 г. в ИМБ РАН при поддержке Международного научно-технического центра начались работы по созданию биочипов для медицинской диагностики возбудителей социально значимых заболеваний.
Биочипы в деле
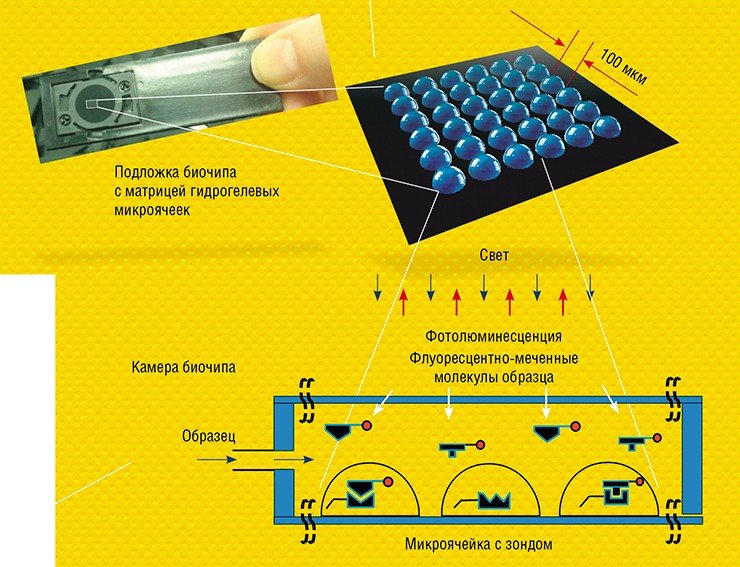
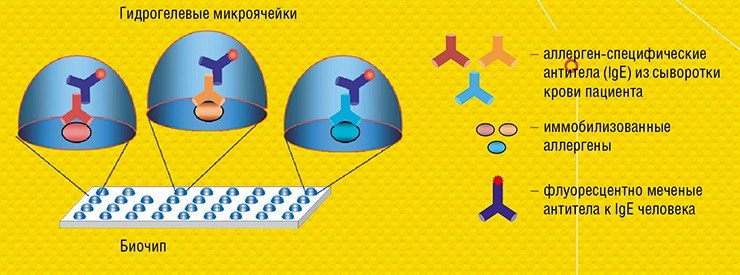
Главным элементом любого биочипа служит матрица из сотен и тысяч микроячеек, каждая из которых содержит так называемые молекулярные зонды – молекулы, способные специфично связываться только со строго определенными биологическими молекулами или их фрагментами. Зондами могут служить олигонуклеотиды, участки геномной ДНК, РНК, антитела, олигосахариды, различные низкомолекулярные соединения и др. Каждая ячейка биочипа служит своего рода отдельной «нанопробиркой», где иммобилизованный зонд распознает в анализируемом образце только свою мишень. Таким образом удается проводить параллельное распознавание сразу множества мишеней, например, генов, ответственных за лекарственную устойчивость возбудителя болезни.
Принципиальное отличие технологии матричных биочипов, разработанной в ИМБ РАН, в том, что зонды располагаются не на плоской подложке, а в заполимеризованных «каплях» гидрогеля полусферической формы. Размещение молекулярных зондов в трехмерном объеме, а не на плоскости, дает ряд существенных преимуществ. Оно позволяет в десятки и сотни раз увеличить емкость биочипа на единицу поверхности и, соответственно, чувствительность измерений. Кроме того, гель – насыщенное водой желеобразное вещество, исключает возможность взаимодействия зондов друг с другом и с твердой поверхностью подложки, а также обеспечивает отличную изоляцию отдельных ячеек на биочипе.
РОССИЯ – ПИОНЕР «БИОЧИПОСТРОЕНИЯ»Большие матрицы с ДНК и белками, иммобилизованными на фильтре или зафиксированными в лунках планшета, были известны достаточно давно. Но идея о создании микрочипов современного формата появилась лишь в конце прошлого века. Первая работа по ДНК-микрочипам и одна из первых – по белковым чипам были опубликованы группой академика А. Д. Мирзабекова из московского Института молекулярной биологии им. В. А. Энгельгардта АН СССР (Khrapko et al., 1989; Arenkov et al., 2000).Эта революционная идея родилась как предложение для нового метода секвенирования ДНК с использованием гибридизации – процесса объединения двух комплементарных одноцепочечных молекул ДНК в двуцепочечную. Работы по совершенствованию методик секвенирования были стимулированы все более возраставшим интересом к проблеме расшифровки генома человека.
В то время в научной среде широко дискутировался вопрос, должна ли эта задача решаться масштабированием существующих подходов или нужно разрабатывать новые, более эффективные. Ученые сначала пошли по первому пути. Так, в 1977 г. появился «метод Сенгера», основанный на ферментативном синтезе комплементарной последовательности ДНК на матрице анализируемой одноцепочечной ДНК, а его разработчики получили в 1980 г. Нобелевскую премию. В своей нобелевской речи один из лауреатов, американский биохимик У. Гилберт, отметил, что «идея метода пришла только после второго визита А. Мирзабекова» в его лабораторию (Gilbert, 1984).
При секвенировании гибридизацией «расшифровка» ДНК идет не отдельными буквами-нуклеотидами, а «словами» определенной величины, и такой словарь может содержать тысячи слов. Стала очевидной необходимость создания микрочипов: в это время и вышла первая статья ученых из ИМБ, где были описаны приготовление и свойства гелевых микрочипов (Khrapko et al., 1989).
Технология производства гелевых биочипов прошла несколько этапов развития. Технология первого поколения, еще достаточно громоздкая и несовершенная, была разработана и запатентована в ИМБ в 1989—1993 гг., а впоследствии реализована в совместной лаборатории, организованной институтом и Аргоннской национальной лабораторией (США), и лицензирована американскими компаниями Motorola и Packard Instruments. Однако из-за технологических проблем фирмы стали производить биочипы, матрица которых представляла собой поверхность, сплошь покрытую полиакриламидным гелем.
В ИМБ РАН технология гелевых биочипов продолжала развиваться. Современная, достаточно простая, универсальная и дешевая технология позволяет производить даже в лабораторных условиях сотни и тысячи олигонуклеотидных, ДНКовых или белковых микрочипов в день (Колчинский и др., 2004)
Для регистрации результатов анализа используют флуоресцентные метки, которые вводят в молекулы образца. Если зонд специфично распознает и свяжется с мишенью, в ячейке возникает флуоресценция. Интенсивность свечения ячеек биочипа измеряется с помощью специальных аппаратно-программных комплексов-анализаторов, которые и выдают отчет о присутствии в исследуемом образце специфичных молекулярных мишеней, информирующих о наличии микроорганизмов или генных мутаций, онкомаркеров или аллергенов и т. п.

Оригинальная технология создания таких гелевых чипов, разработанная в ИМБ РАН, была запатентована и сертифицирована по европейским стандартам. Биочипы, созданные по этой технологии, занимают отдельную нишу диагностических микроматриц и применяются в российских клиниках. Коммерческие микроматрицы, произведенные ведущими научно-производственными корпорациями Германии и США применяются, в основном, в исследовательских целях.
Туберкулез и лекарственная устойчивость
Первой в мире тест-системой на основе биочипов, зарегистрированной для медицинского применения, стал разработанный в ИМБ в 2004 г. набор «ТБ-Биочип‑1». С его помощью можно определить наличие в геноме микобактерии туберкулеза 47 мутаций, приводящих к устойчивости к двум основным противотуберкулезным препаратам – рифампицину и изониазиду.
Тест-системами серии «ТБ-Биочип» и оборудованием для их анализа были оснащены 20 учреждений противотуберкулезной службы РФ и 8 бактериологических лабораторий Федеральной службы исполнения наказаний. Число излеченных больных с лекарственно-устойчивым туберкулезом увеличилось по меньшей мере в 3 раза при ранней постановке диагноза с использованием биочипов в отличие от диагностики традиционными методами (Gryadunov et al., 2011). В этом случае огромную роль играет такой фактор, как время анализа: в первом случае для диагностики достаточно нескольких часов, тогда как выращивание микобактерий на средах с разными противотуберкулезными препаратами занимает 2—3 месяцаПочему внимание исследователей привлек именно туберкулез? Дело в том, что многие десятилетия для борьбы с этой болезнью использовали комбинированное лечение сразу несколькими химиопрепаратами, чтобы повысить его эффективность. При монотерапии больные быстро приобретали устойчивость к лекарству. Однако такая стратегия привела к тому, что уже в конце прошлого века в мире, в том числе и в России, начал повсеместно распространяться туберкулез со множественной лекарственной устойчивостью. Именно этот фактор в наши дни чаще всего является причиной неудачного исхода лечения и возникновения рецидива болезни, от которой ежегодно в мире умирает более 3 млн человек.
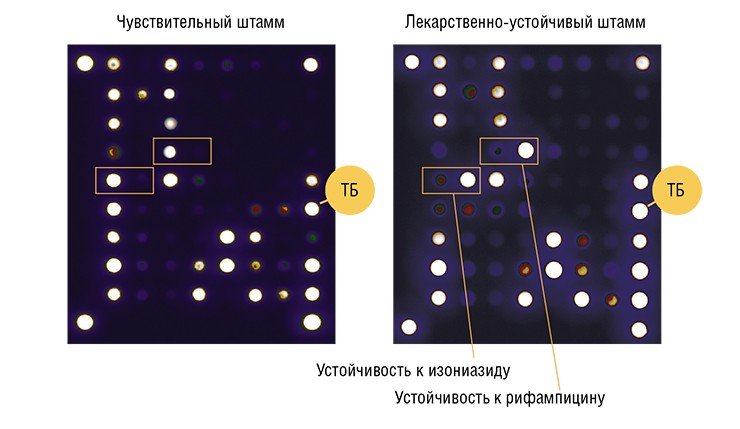
Изониазид и рифампицин относятся к популярным и наиболее эффективным препаратам первого (основного) ряда. И если выделенный от пациента возбудитель окажется устойчивым к этим лекарствам, нужно обращаться к химиопрепаратам второго (резервного) ряда, к которым будет чувствительна эта бактериальная популяция. Сегодня одними из наиболее перспективных препаратов для лечения таких форм туберкулеза являются фторхинолоны. Поэтому следующей тест-системой в ряду диагностических тестов ИМБ стал «ТБ-Биочип‑2», с помощью которого можно выявить лекарственную устойчивость к различным классам этих препаратов (Грядунов и др., 2009).
Все более широкое распространение форм туберкулеза со множественной лекарственной устойчивостью явилось стимулом для дальнейшей «эволюции» тест-системы. Требовалось, во‑первых, максимально охватить весь спектр генетически детерминированной резистентности к широкому ряду противотуберкулезных препаратов. Во-вторых, возникла необходимость определять генотип и соответственно принадлежность выделенного штамма к основным семействам, циркулирующим на территории РФ, что важно не только для эпидемиологического мониторинга структуры популяции возбудителей туберкулеза, но и для назначения адекватной терапии.

Так в 2012—2013 гг. в результате масштабных геномных исследований был создан не имеющий мировых аналогов набор реагентов «ТБ-ТЕСТ», позволяющий одновременно идентифицировать 120 генетических локусов, отвечающих за развитие устойчивости к препаратам первой и второй «линии обороны»: рифампицину, изониазиду, этамбутолу, фторхинолонам и инъекционным препаратам (амикацину и капреомицину) (Zimenkov et al., 2016). Такая диагностика позволяет дифференцированно назначать высокие дозы химиопрепаратов или, напротив, удалять те или иные лекарства из схем терапии.
Чтобы получить государственную регистрацию в Росздравнадзоре, тест-система прошла все виды испытаний и экспертиз и с 2014 г. разрешена к применению в медицинской практике РФ. В настоящее время «ТБ-ТЕСТ» приходит на смену наборам «ТБ-Биочип».
От гепатита до рака и аллергий
Еще одной актуальной проблемой мирового здравоохранения является лечение больных гепатитом С. Возбудитель этого вирусного заболевания может долгое время размножаться в печени, ничем не выдавая себя, а первые признаки болезни обнаруживаются лишь спустя пару месяцев после заражения. Еще недавно гепатит С считался практически неизлечимой болезнью, а основным терапевтическим средством служила комбинация из интерферона и рибавирина, которая зачастую оказывалась неэффективной и имела много негативных побочных эффектов.

Сегодня созданы новые антивирусные препараты, обладающие так называемым прямым противовирусным действием и блокирующие ключевые внутриклеточные этапы размножения возбудителя. Но вся сложность в том, что вирус гепатита С имеет 7 вариантов генотипа, при этом каждый генотип имеет еще несколько подтипов. Более того, разные генотипы/подтипы обладают и разной чувствительностью к традиционным и новым препаратам, и выбор противовирусной терапии должен проводиться в соответствии с генотипическими особенностями возбудителя.
В ИМБ РАН совместно с лабораторией вирусологии госпиталя Университета г. Тулузы (Франция) был разработан и запатентован не имеющий мировых аналогов подход, основанный на использовании платформы гидрогелевых биочипов для типирования вируса гепатита С на основе анализа области NS 5B вирусного генома. Тест-система «HCV-БИОЧИП», способная определять 6 генотипов и 36 подтипов этого вируса, успешно прошла клинические испытания в России и Франции (Gryadunov et al., 2011).
Важнейшим направлением приложения технологии гидрогелевых биочипов служит анализ мутаций и полиморфизмов ДНК самого человека: ДНК-маркеров, ассоциированных с возникновением различных неинфекционных заболеваний.
Среди онкологических заболеваний у детей ведущее место занимают лейкозы. Тест-система «ЛК-БИОЧИП» способна идентифицировать в образцах крови 13 наиболее клинически значимых хромосомных транслокаций (переносов фрагмента одной хромосомы на другую), характерных для некоторых типов острых и хронических лейкозов. Каждая из этих транслокаций определяет свой вариант развития лейкоза и важна для выбора стратегии лечения. Эта тест-система применяется в Национальном научно-практическом центре детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева (Москва), где анализируются образцы из 18 региональных гематологических центров РФ (Gryadunov et al., 2011).
Для ранней диагностики рака молочной железы и яичников создана тест-система «РМЖ-БИОЧИП», которая позволяет определять мутации в генах BRCA1/2, ассоциированные с высокой (до 80 %) вероятностью возникновения наследственных форм этих заболеваний.
В настоящее время в ИМБ РАН разрабатываются варианты тест-систем на основе биочипов для определения чувствительности злокачественных клеток к противоопухолевой терапии. Например, с помощью биочипа для индивидуального подбора препаратов, эффективно воздействующих на молекулярные мишени в опухолевых клетках меланомы, можно выявить мутации генов, которые определяют целесообразность использования таких препаратов таргетной («молекулярно-прицельной») терапии поздних стадий и рецидивов меланомы, как траметиниб, иматиниб и вемурафениб (Emelyanova et al., 2017).
Трехмерная структура гидрогеля, в котором на биочипах зафиксированы молекулярные зонды, позволяет сохранить без изменений достаточно «чувствительную» нативную структуру белковых молекул. Поэтому такие биочипы можно использовать также для исследования белок-белковых взаимодействий, что требуется, к примеру, при проведении различных видов иммунохимического анализа.
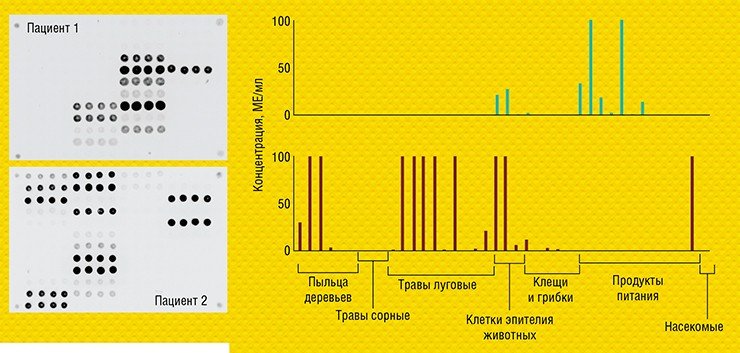
В ИМБ РАН удалось перевести такой классический анализ в формат микрочипа и адаптировать его для диагностики аллергических заболеваний. Совместно с германской биотехнологической компанией Dr. Fooke Laboratorien GmbH, предоставившей наборы природных и рекомбинантных аллергенов, была разработана и запатентована тест-система «АЛЛЕРГО-БИОЧИП» для параллельного количественного определения больших панелей аллерген-специфичных антител Е и G4 в сыворотке крови (Feyzkhanova et al., 2017).
 Важно, что для анализа антител на 30 и более аллергенов на биочипе требуется очень небольшой (всего 60 мкл) объем сыворотки крови – ровно столько, сколько требуется для анализа на один аллерген традиционным иммуноферментным методом! Такое отличие особенно значимо в педиатрии. Лабораторный вариант этой тест-системы уже проходит доклинические испытания в Детской городской клинической больнице № 13 им. Н. Ф. Филатова (Москва).
Важно, что для анализа антител на 30 и более аллергенов на биочипе требуется очень небольшой (всего 60 мкл) объем сыворотки крови – ровно столько, сколько требуется для анализа на один аллерген традиционным иммуноферментным методом! Такое отличие особенно значимо в педиатрии. Лабораторный вариант этой тест-системы уже проходит доклинические испытания в Детской городской клинической больнице № 13 им. Н. Ф. Филатова (Москва).
Двенадцать специализированных тест-систем, созданных на основе технологии гидрогелевых биочипов в ИМБ РАН, получили разрешение к применению как медицинские изделия для лабораторной диагностики. Эти тест-системы успешно используются более чем в 50 научно-исследовательских и медицинских центрах РФ, стран СНГ и ЕС.
Технологии биочипов, разработанные в ИМБ РАН, защищены 42 отечественными и международными патентами. И эти технологии продолжают интенсивно развиваться. Разрабатываются новые подходы, позволяющие упростить и ускорить методики, интегрировать в единую процедуру все стадии проведения анализа: от обработки биологического образца до количественной идентификации в режиме реального времени.
Ядро системы – гидрогелевый биочип – будет в дальнейшем модифицироваться в зависимости от назначения диагностического теста, в то время как остальные компоненты уже сейчас являются унифицированными. Такие «лаборатории на чипе» позволят значительно улучшить качество лабораторной диагностики, снизить вероятность заражения медперсонала и в конечном счете повысить эффективность и сократить стоимость лечения.
Литература
Грядунов Д. А., Зименков Д. В., Михайлович В. М. и др. Технология гидрогелевых биочипов и ее применение в медицинской лабораторной диагностике // Медицинский алфавит. 2009. № 3. С. 10—14.
Заседателев А. С. Биологические микрочипы для медицинской диагностики // Наука и технологии в промышленности. 2005. № 1. С. 18—19.
Колчинский А. М., Грядунов Д. А., Лысов Ю. П. и др. Микрочипы на основе трехмерных ячеек геля: история и перспективы // Молекулярная биология. 2004. Е. 38 № 1. С. 5—16.
Arenkov P., Kukhtin A., Gemmell A., et al. Protein microchips: use for immunoassay and enzymatic reactions // Analytical Biochemistry. 2000. V. 278. N. 2. P. 123—131.
Emelyanova M., Ghukasyan L., Abramov I. et al. Detection of BRAF, NRAS, KIT, GNAQ, GNA11 and MAP2K1/2 mutations in Russian melanoma patients using LNA PCR clamp and biochip analysis // Oncotarget. 2017. V. 32. N. 8. P. 52304—52320.
Feyzkhanova G., Voloshin S., Smoldovskaya O. et al. Development of a microarray-based method for allergen-specific IgE and IgG4 detection // Clinical proteomics. 2017. doi: 10.1186/s12014-016-9136-7.
Gryadunov D., Dementieva E., Mikhailovich V. et al.Gel-based microarrays in clinical diagnostics in Russia // Expert review of molecular diagnostics. 2011. N. 11 P. 839—853.
Khrapko K. R., Lysov Yu. P., Khorlyn A. A. An oligonucleotide hybridization approach to DNA sequencing // FEBS Letters. 1989. V. 256. N. 1-2. P. 118—122.
Zimenkov D. V., Kulagina E. V., Antonova O. V., et al. Simultaneous drug resistance detection and genotyping of Mycobacterium tuberculosis using a low-density hydrogel microarray // Journal of antimicrobial chemotherapy. 2016. V. 71. N. 6. P. 1520—1531.