Клеточная экзотика в России
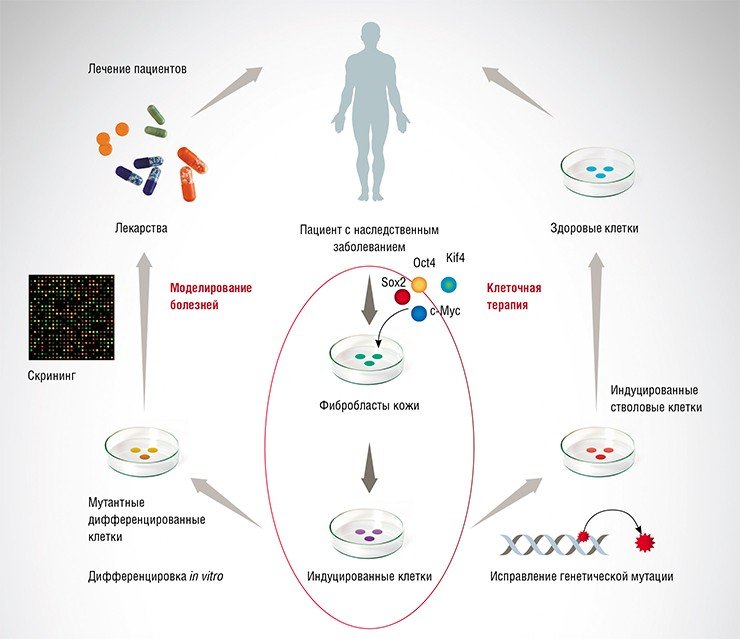
Когда в 2006 г. японским ученым удалось повернуть программу развития клеток вспять и вернуть зрелые клетки взрослого организма в «детство», это стало одним из наиболее важных достижений биологической науки последних десятилетий. Автор технологии генетического репрограммирования клеток С. Яманака получил в 2012 г. Нобелевскую премию, а в мире биологии началась новая эра. Технология производства ИПСК (индуцированных плюрипотентных стволовых клеток) позволила на принципиально новом уровне создавать модели заболеваний, проводить скрининг лекарственных средств. Ближайшей перспективой является создание новых средств терапии: после коррекции методами геномного редактирования патологии в ИПСК «исправленные» клетки будут пересаживаться больному человеку. Каковы шансы на успех у этих работ? И какова роль российских ученых в реализации этого амбициозного проекта?
К сожалению, в России мало лабораторий, специализирующихся на работе со стволовыми клетками или ИПСК: два института в новосибирском Академгородке, да несколько лабораторий в Москве и Санкт-Петербурге. С годами число нужных специалистов растет, но оно недостаточно, чтобы конкурировать с международными группами. Если в физике Россия хоть как-то «держит марку», то работы наших клеточных биологов зарубежным коллегам не особо интересны и воспринимаются, скорее, как экзотика. Опыт России в международных проектах по клеточной биологии – это отдельные работы конкретных ученых. Кроме того, Россия умудряется игнорировать мировой опыт. Так, к российскому Федеральному закону «О биомедицинских клеточных продуктах» есть много вопросов. Например, он не разрешает использовать фетальные и эмбриональные стволовые клетки в качестве источника для создания клеточных продуктов – подобных запретов нет ни в США, ни в Великобритании, ни в Японии.
ВЕРНУТЬ КЛЕТКИ В «ДЕТСТВО» Клетки, составляющие разнообразие тканей многоклеточного организма, претерпевают множество делений от момента оплодотворения яйцеклетки до смерти особи. В процессе развития организма клетки «дифференцируются» (становятся специализированными), теряя при этом потенциал к превращению в другие специализированные типы. В норме – это заложенный в генетической программе однонаправленный процесс: дифференцированная клетка не может опять стать стволовой. Идея эпигенетической регуляции однонаправленного процесса развития была сформулирована еще в 1940-х гг. К. Уоддингтоном, который предложил и сам термин «эпигенетика» – изменение активности генов, не затрагивающее структуру ДНК. Успехи биологии последних десятилетий свидетельствуют в пользу возможности эффективно управлять состоянием клетки, изменяя ее функции и специализацию.
Идея эпигенетической регуляции однонаправленного процесса развития была сформулирована еще в 1940-х гг. К. Уоддингтоном, который предложил и сам термин «эпигенетика» – изменение активности генов, не затрагивающее структуру ДНК. Успехи биологии последних десятилетий свидетельствуют в пользу возможности эффективно управлять состоянием клетки, изменяя ее функции и специализацию.
Впервые вернуть клетки в «детство», сделать их опять стволовыми, направляя в нужную сторону с помощью комплекса факторов, удалось в 2006 г. японским ученым К. Такахаши и С. Яманака, получившим плюрипотентные клетки из фибробластов мыши. Безусловно, эти работы базировались на предшествующих исследованиях Р. Бриггса, Т. Кинга, Дж. Гердона и других ученых, доказавших, что перенос ядра взрослой клетки в лишенную ядра яйцеклетку может привести к изменению генетической программы и началу роста нового организма.
Работая с сочетаниями 24 транскрипционных факторов, участвующих в приобретении и поддержании плюрипотентного состояния, Такахаши и Яманака определили комбинацию белковых факторов Oct4, Sox2, Klf4 и с-Myc (известную теперь как «коктейль Яманака»), экспрессия которых в соматической клетке приводит к ее превращению в плюрипотентную. Этот процесс получил название «генетического репрограммирования», а найденные клетки стали называть «индуцированными плюрипотентными стволовыми клетками» (ИПСК). Технология репрограммирования оказалась универсальной и позволила получать плюрипотентные клетки из различных типов клеток не только мыши и человека, но и других животных, включая крыс, собак и свиней
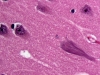
США и Япония, лидеры в области клеточной биологии, обладающие финансовыми возможностями и способные привлечь интеллектуальную элиту со всего мира, уже начали клинические испытания первых ИПСК-клеточных продуктов. В Великобритании, Швеции, Голландии и многих других странах ведутся интенсивные работы в области плюрипотентных стволовых клеток. Конечно, вровень с Европой, США, Японией мы уже не встанем, однако некоторые исследования наших ученых вполне «на уровне». Главное – прилагать усилия, понимать, что творится в научном мире, достойно представлять себя в международных проектах и не зацикливаться на том, что мировая наука ушла далеко вперед, а искать те ниши, где можно продуктивно работать: интересные феномены, неизвестные ранее механизмы. Наша лаборатория старается найти подобные ниши, и одна из них – это исследование молекулярных механизмов развития неврологических заболеваний, а именно – атаксий, нейродегенеративных заболеваний, которые поражают спинной мозг и мозжечок, в результате чего нарушается координация движений.
В поисках молекулярных механизмов атаксии
Основная проблема и с лечением, и с изучением нейродегенеративных заболеваний состоит в том, что, когда появляются первые симптомы, количество живых, не пораженных болезнью клеток уменьшается настолько, что во многих случаях помочь человеку уже ничем нельзя, остается только поддерживающая паллиативная терапия. По этой же причине эти болезни нелегко изучать: косвенных исследований пациента (томография, анализы биологических жидкостей) недостаточно, а в образцах, взятых после смерти, нужные клетки уже погибли – изучать практически нечего. Поэтому, чтобы понять, что происходит при той или иной патологии на молекулярном уровне, нужны животные и клеточные модели.
Семь лет назад кандидатские диссертации были посвящены получению ИПСК, характеристике клеток. Три года назад эти темы перешли на уровень магистерских работ, а сегодня – на уровень работы бакалавраВ развитии атаксий генетически «виноваты» многократные повторы триплета CAG в гене, кодирующем аминокислоту глутамин, что вызывает избыточное встраивание глутаминовых остатков в некоторые белки.
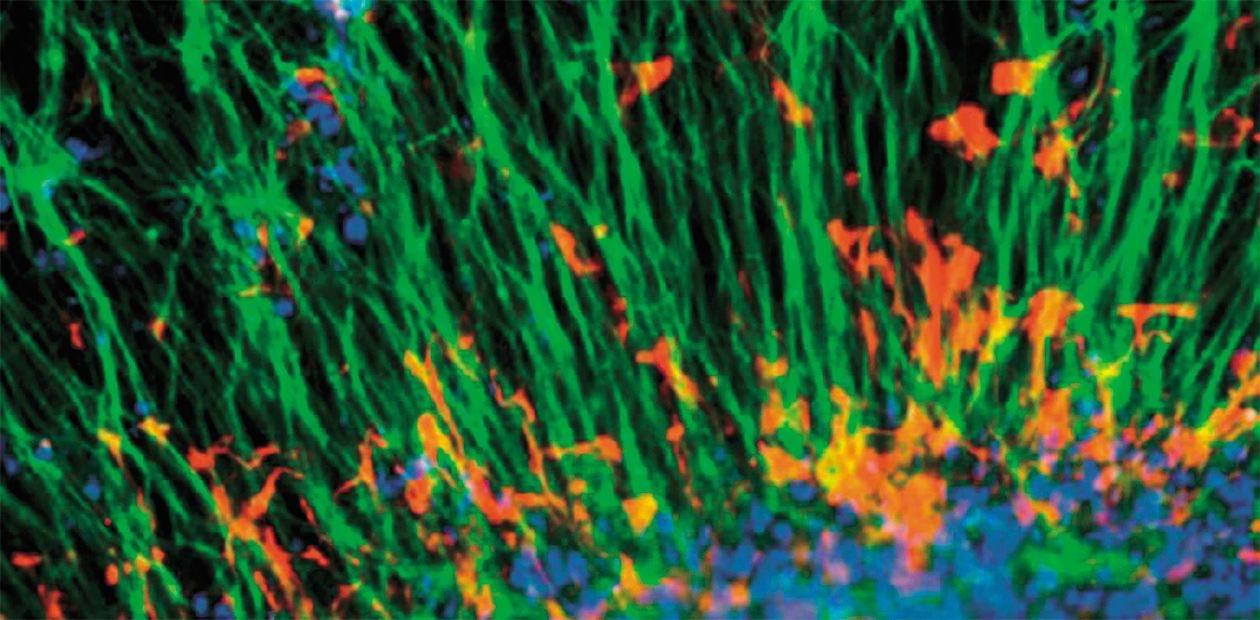
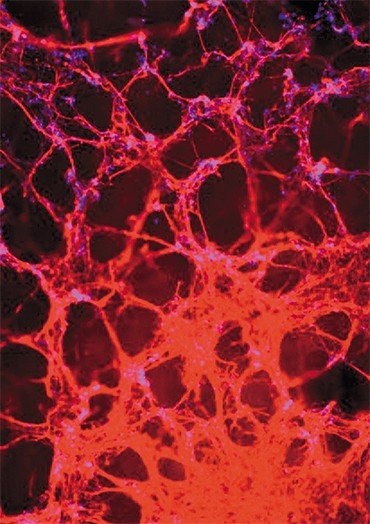
В настоящее время известно 8 типов подобных расстройств. Спиноцеребеллярная атаксия 1 типа – редкая болезнь, и ее в основном изучали на примере немногочисленных больных и частично – на животных моделях, но в тонкие молекулярные механизмы не вникали. Мы создаем клеточные модели этого заболевания: берем у больного биопсию кожи, репрограммируем клетки до ИПСК и дифференцируем их в нейроны Пуркинье мозжечка, которые деградируют при этом заболевании.
Разработка технологически правильного протокола дифференцировки нейронов Пуркинье – первая наша задача, которую нам необходимо решить. Важно, чтобы протокол был воспроизводимым и «работал» для любой клеточной линии. Следующая задача – поиск молекулярных механизмов атаксии 1 типа с помощью ИПСК.
В рамках таких исследований необходимо сравнивать больные клетки со здоровыми. Проблема в том, что люди – это не мыши определенных линий, и их индивидуальные различия могут сильно исказить картину. Поэтому нельзя сравнивать клетки больного и здорового человека – нужно использовать клетки, происходящие от одного и того же человека. Для этого нужно либо «вылечить» больные клетки, либо внести генетическими методами мутацию в геном здоровых клеток.
В случае атаксии 1 типа больше подходит второй вариант: мы научились с помощью метода CRISPR/Cas вносить в геном здоровой клетки повторы CAG. Эта технология уже стала рутинной, и, сравнивая больные и здоровые клетки, мы исследуем «поведение» молекул РНК и белков, ищем механизмы развития заболевания. Работы идут вполне успешно.
ИПСК для окулистов и фармакологов
Другое направление работ нашей лаборатории связано с работами, результаты которых будут иметь практическое значение для медицины, хотя пока это не означает, что уже завтра мы будем кого-то лечить. Речь идет о получении из плюрипотентных клеток пигментного эпителия сетчатки глаза. Тут мы идем по проторенной дорожке: клинические испытания таких клеток уже начаты в Японии.
 Пигментный эпителий – это очень важные клетки, именно их смерть во многом обусловливает дистрофию сетчатки. Они защищают от ультрафиолетового излучения, фагоцитируют (захватывают) слущивающиеся внешние мембранные диски фоторецепторов, выполняют барьерную функцию между сетчаткой и сосудистыми клетками, поддерживают водный обмен. Как уже было показано, пересадка клеток пигментного эпителия лабораторным животным (в том числе обезьянам) существенно улучшает у них течение смоделированного заболевания – дистрофии сетчатки глаза.
Пигментный эпителий – это очень важные клетки, именно их смерть во многом обусловливает дистрофию сетчатки. Они защищают от ультрафиолетового излучения, фагоцитируют (захватывают) слущивающиеся внешние мембранные диски фоторецепторов, выполняют барьерную функцию между сетчаткой и сосудистыми клетками, поддерживают водный обмен. Как уже было показано, пересадка клеток пигментного эпителия лабораторным животным (в том числе обезьянам) существенно улучшает у них течение смоделированного заболевания – дистрофии сетчатки глаза.
У нас отработана процедура получения пигментного эпителия сетчатки глаза из ИПСК, но, чтобы двигаться дальше, необходимо сотрудничество между молекулярными и клеточными биологами, физиологами, гистологами и оперирующими врачами. Такой союз – большая редкость.
Сейчас мы ведем переговоры с Институтом цитологии и генетики СО РАН (Новосибирск), где есть интересная модель быстро стареющих крыс OXYS, у которых, в числе других симптомов, наблюдается ранняя ретинопатия, т. е. патология сетчатки. Возможно, эта модель подойдет для наших исследований. Мы надеемся, что сможем найти не только людей, которые будут оперировать крыс, но и редких, «вымирающих» в наше время специалистов – гистологов и физиологов, и запустим совместный проект, у которого есть хороший шанс дойти до клинических испытаний.
Органоид вместо органа
Клеточная и молекулярная биология сильно подвержены «модным тенденциям». Года три назад исключительно модным словом было «аутофагия», с этим понятием связывали многие клеточные процессы. Еще раньше таким словом был «апоптоз». Сейчас у нас модно работать методом редактирования генома CRISPR/Cas и говорить про экзосомы – маленькие мембранные пузырьки, с помощью которых клетки «общаются» друг с другом.
Поиск и разработка новых моделей для таких неизлечимых нейродегенеративных заболеваний человека, как болезнь Гентингтона, является весьма актуальной задачей. Недавно разработанная технология генетического репрограммирования позволяет из легкодоступных клеток (например, фибробластов кожи) получить в лабораторных условиях ИПСК, которые в свою очередь могут неограниченно расти в культуре и дифференцироваться в любые типы клеток, в том числе нейроны, столь необходимые для изучения молекулярных механизмов развития нейродегенеративной патологии.
На сегодняшний день созданный в лаборатории клеточной биологии Федерального научно-клинического центра физико-химической медицины Федерального медико-биологического агентства (Москва) набор клеточных линий является уникальной платформой для изучения болезни Гентингтона. Он может быть использован для создания высокоэффективной системы, направленной на анализ молекулярных механизмов заболевания и поиск новых нейропротекторов методами высокопроизводительного скрининга
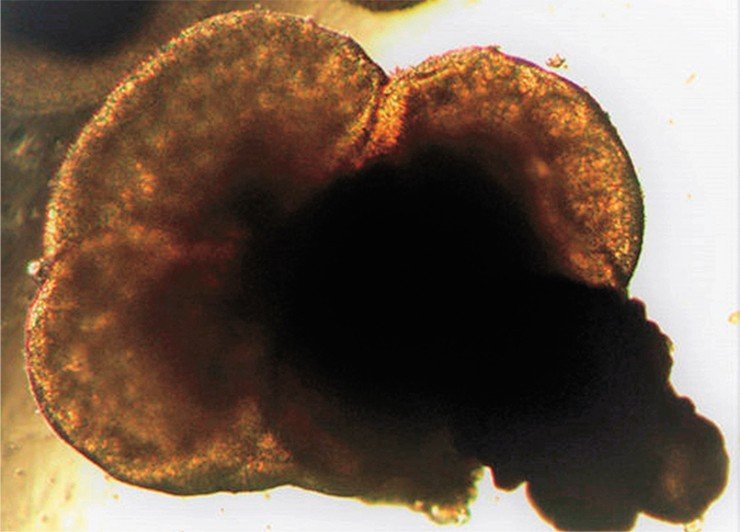
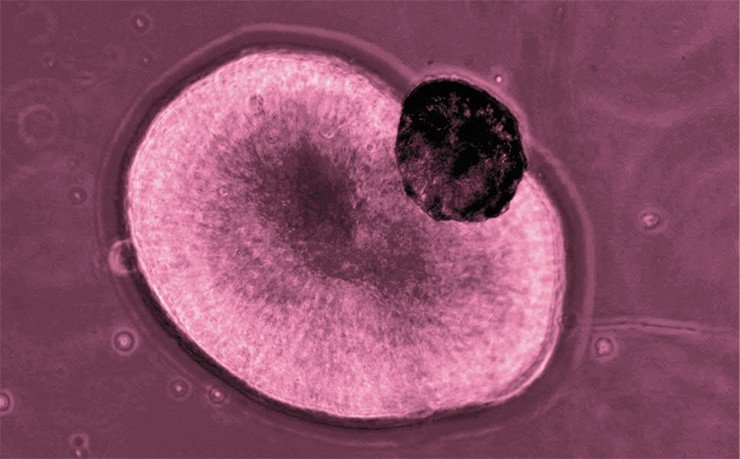
Одно из таких «модных» направлений, которым занимается и наша лаборатория, – это создание так называемых органоидов, продуктов самоорганизации группы плюрипотентных клеток. Если в начале дифференцировки суметь дать клеткам толчок в нужном направлении, между ними начинаются процессы взаимодействия, которые определяют условно, «где голова, а где хвост», и начинают воспроизводить эмбриональную программу развития. Вырастает органоид, клеточная масса, которая по своим молекулярным и гистологическим характеристикам похожа на тот или иной орган.
Например, голландские ученые из одной стволовой клетки вырастили органоид кишечника, который содержал несколько типов клеток эпителия (эндокринные, секреторные, поддерживающие типы клеток), и с его помощью изучили, как взаимодействует с тканями кишечника бактерия Helicobacter pylori, которую считают причиной некоторых заболеваний желудочно-кишечного тракта (Dutta & Clevers, 2017). Этот процесс трудно посмотреть in vivo даже на модельном животном, но это просто сделать при работе с органоидами.
У нас в лаборатории уже растут органоиды глаз, а также мозга и мозжечка, с помощью которых мы планируем изучать атаксии.
Редкие гомозиготы – шанс для ИПСК-терапии
У российских биологов нет традиции создавать научные коллаборации. В США даже конкурирующие группы часто объединяются, закрыв глаза на разногласия и понимая, что такая совместная работа выведет исследования на новый уровень. Ради достижения цели ученые делятся клеточными культурами, лабораторными моделями заболеваний, оборудованием. Нашей лаборатории с сотрудничеством очень повезло. Мы много лет работаем вместе с Научным Центром Неврологии (чл.-корр. РАН С. Н. Иллариошкин и его коллеги), с Институтом Цитологии РАН (профессор Е. В. Казначеева и ее сотрудники), еще с несколькими институтами и университетами России. И, конечно, нельзя не упомянуть проф. С. Л. Киселева из института Общей Генетики РАН, благодаря которому начались и были сделаны первые в стране работы с плюрипотентными клетками человекаСейчас есть технологии и знания, которые позволяют при помощи ИПСК изучать патогенез заболеваний и проводить скрининг лекарств. Хотя пока неизвестно, когда мировая наука научится редактировать в индуцированных плюрипотентных клетках генетические патологии и пересаживать людям исправленные клетки.
Такой подход еще нигде не реализован, а если прорыв и случится, то, скорее всего, это будет дорого и долго. Ведь только от момента забора биопсии кожи до получения ИПСК проходит несколько месяцев. Каждая клеточная линия должна быть сделана в стандартных GMP-условиях (Good Manufacturing Practice, надлежащая производственная практика), пройти тесты на наличие мутаций и потенциальную способность образовывать опухоли.
 Но существует и альтернативный подход, идея которого принадлежит С. Яманаке: создание относительно универсальных линий ИПСК. Проблема в том, что у нас есть гены и белки, отвечающие за тканевую совместимость (гены главного комплекса гистосовместимости), и при их несовпадении при трансплантации развивается синдром отторжения тканей. Эти гены очень вариабельны, поэтому при необходимости пересадки органов (например, костного мозга) так трудно найти донора. Грубо говоря, каждый человек в мире может стать донором только для одного человека из каждых 40 тысяч. Вероятность совпадения генов комплекса гистосовместимости даже у родных брата и сестры – всего одна четверть.
Но существует и альтернативный подход, идея которого принадлежит С. Яманаке: создание относительно универсальных линий ИПСК. Проблема в том, что у нас есть гены и белки, отвечающие за тканевую совместимость (гены главного комплекса гистосовместимости), и при их несовпадении при трансплантации развивается синдром отторжения тканей. Эти гены очень вариабельны, поэтому при необходимости пересадки органов (например, костного мозга) так трудно найти донора. Грубо говоря, каждый человек в мире может стать донором только для одного человека из каждых 40 тысяч. Вероятность совпадения генов комплекса гистосовместимости даже у родных брата и сестры – всего одна четверть.
У каждого из нас есть по две копии (аллеля) гена: одна досталась нам от отца, а другая – от матери. Но есть люди, у которых копии генов комплекса гистосовместимости одинаковые (т. е. они по этим аллелям гомозиготны), – это счастливое совпадение. Материал от таких доноров подойдет для пересадки (хоть органов, хоть ИПСК) любому человеку, у которого будет совпадение хотя бы одного аллеля. Подсчитано, что тридцати линий ИПСК от здоровых гомозиготных клеток достаточно, чтобы обеспечить совпадение при трансплантации 25—30 % всего населения Японии, а пятидесяти – около 75 %. Конечно, встречаются и совсем редкие генные аллели, но половина населения страны – это уже очень неплохо.
Яманака собирает банк таких гомозигот, и уже создано несколько клеточных линий на их основе. Японцам проще собирать такую базу, потому что у них существуют большие реестры потенциальных доноров костного мозга с известными вариантами комплекса гистосовместимости.
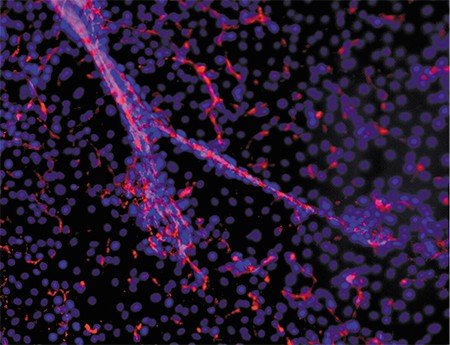
ОРГАНЫ ИЗ ПРОБИРКИ Группа новосибирских исследователей из Института цитологии и генетики и Института химической биологии и фундаментальной медицины СО РАН (Новосибирск), Новосибирского научно-исследовательского института патологии кровообращения им. академика Е. Н. Мешалкина занимается разработкой тканеинженерных подходов для регенеративной медицины сосудов.Актуальность этой темы связана с тем, что в наши дни быстро растет число больных с патологией кровеносных сосудов, причем лечение подобных заболеваний зачастую предусматривает замену сосудов на аутологичные (донорские) либо синтетические. Оба эти варианта имеют свои ограничения, альтернативой является использование тканеинженерных протезов сосудов.
В Новосибирске был разработан протокол получения специфических васкулярных клеток, которые способны формировать кровеносные сосуды из биопсийного материала, а также из плюрипотентных стволовых клеток человека, подвергнутых направленной дифференцировке. Полученные сосудистые клетки детально исследуются с помощью различных функциональных и молекулярно-генетических тестов, а затем ими заселяются синтетические поверхности. Полученный в результате сосудистый протез по своим свойствам близок к натуральному кровеносному сосуду (Шевченко, Захарова, 2014)
В России практически нет пропаганды донорства костного мозга, и поэтому база доноров очень небольшая. Я считаю, что ее нужно развивать, ведь для этого надо всего лишь сдать кровь (перед этим внутривенно вводят препарат, благодаря которому в кровь попадают клетки костного мозга). Это обычная практика, например, в Германии. Думаю, и Россия к этому придет.
Прошло более десяти лет с открытия генетического репрограммирования соматической клетки до плюрипотентного состояния. В этом году в журнале New England Journal of Medicine опубликованы результаты первой трансплантации клеток, производных ИПСК, пациентке с дистрофией сетчатки глаза. Войдут ли в широкую клиническую практику клетки, производные ИПСК (нейроны, инсулин-продуцирующие клетки и т.д.), покажет время. По мнению автора этой статьи, – должны.
 В России несколько научных групп используют ИПСК для создания моделей заболеваний, в том числе нейродегенеративных, создают изогенные системы методами геномного редактирования. Довольно много работ посвящено изменению структуры и эпигенетического состояния хроматина при репрограммировании и дифференцировке.
В России несколько научных групп используют ИПСК для создания моделей заболеваний, в том числе нейродегенеративных, создают изогенные системы методами геномного редактирования. Довольно много работ посвящено изменению структуры и эпигенетического состояния хроматина при репрограммировании и дифференцировке.
За прошедшие годы с помощью ИПСК было проведено множество интересных фундаментальных научных работ, посвященных механизмам поддержания плюрипотентности, тканеспецифической дифференцировки. Область эта исключительно конкурентная, но довольно дорогая. Тем не менее ИПСК оказались удобным инструментом для изучения молекулярных механизмов заболеваний, органогенеза и других процессов.
Литература
Богомазова А. Н., Васина Е. М., Киселев С. Л. и др. Генетическое репрограммирование клеток: новая технология для фундаментальных исследований и практического использования // Генетика. 2015. Т. 51. № 4. С. 466—478.
Иллариошкин С. Н. Болезнь Гентингтона как модель для изучения нейродегенеративных заболеваний // Бюллетень Национального общества по изучению болезни Паркинсона и расстройств движений. 2016. № 1. С. 3—11.
Максимов В. В., Лагарькова М. А., Киселев С. Л. Генная и клеточная терапия заболеваний сетчатки глаза // Клеточная трансплантология и тканевая инженерия. 2012. Т. 7. № 3. С. 12—20.
Некрасов Е. Д., Лебедева О. С., Васина Е. М. и др. Платформа для изучения болезни Гентингтона на основе индуцированных плюрипотентных стволовых клеток // Экспериментальная неврология. 2012. Т. 6. № 4. С. 30—35.
Шевченко И. С., Захарова А. Г. Органы из пробирки // НАУКА из первых рук. 2014. Т. 55. № 1. С. 19—23.