Материнская депрессия: когда счастье не в радость
Шутка, что у человека имеется три пола – мужчины, женщины и беременные женщины, скрывает в себе немалую долю истины: в пред- и послеродовой период многие системы и органы женщины действительно начинают функционировать по другому, нестандартному «сценарию». В это время наблюдаются существенные изменения и в течении многих, особенно психических, болезней, таких как депрессия, называемая в этом случае материнской или послеродовой. Как показывают последние исследования, в развитых странах от этого нарушения психики в той или иной степени страдает почти каждая пятая молодая мать.
Механизмы возникновения материнской депрессии связаны со сбоями в работе нейрохимических систем мозга в результате генетической предрасположенности или действия внешних факторов, таких как эмоциональный стресс. Для лечения заболевания слабой степени тяжести достаточно обычной психотерапии, однако не менее чем в четверти случаев требуется терапия лекарственными препаратами, среди которых наиболее перспективными являются налоксон (антагонист опиоидных рецепторов), низкие дозы эстрогенов и стимуляторы рецепторов «гормона счастья» дофамина
Материнскую, или послеродовую, депрессию выделяют из обширной группы депрессивных нарушений психики как отдельное заболевание в основном по времени его наступления: эта патология развивается в первый год после рождения ребенка.
Подобное состояние регистрируется у 10—15 %, а по некоторым данным – даже почти у половины всех рожениц! Реальную цифру, особенно для нашей страны, назвать сложно, поскольку мать, как правило, не обращается за врачебной помощью, особенно в случае легкой или средней степени тяжести заболевания. Вероятнее всего, этой патологией страдает каждая пятая родившая женщина. Нужно сказать, что это противоречит расхожему мнению о деторождении как панацее от плохого настроения и расстройств психики.
Такая ситуация определяется тем, что молодая мать и ее окружение нередко воспринимают депрессивно-подобные симптомы в околородовой период как малозначимое явление, которое впоследствии должно пройти само собой. Более того, женщина может стыдиться своей подавленности в этот период жизни, традиционно считающийся счастливым («мать не может быть несчастной!»), и скрывать свое состояние от себя и близких.
Неудивительно поэтому, что материнская депрессия является относительно малоизвестным и малоизученным заболеванием, особенно в странах с низким уровнем жизни. В итоге молодая мать, затрачивая огромные силы на уход за ребенком, нередко не заботится о собственном психическом здоровье.
Последствиями послеродовой депрессии могут стать и физические расстройства, например, частые головные боли, головокружения, тошнота, озноб, сбои менструального цикла и т. п. Совместно с изменениями в эмоциональной сфере эти симптомы оказывают негативное влияние на качество жизни женщины и повышают риск появления более серьезных проблем со здоровьем в дальнейшем. К тому же при наличии вредных привычек подобное состояние нередко сопровождается возобновлением (ростом) потребления табака, алкоголя или наркотиков, что крайне негативно сказывается на атмосфере в семье.
Двойная мишень
Симптомы материнской, или послеродовой, депрессии:• постоянная усталость, нарушения сна и аппетита;
• состояние глубокой печали и опустошенности, частый плач, «эмоциональная тупость»;
• отстраненность от семьи, друзей, привычных приятных занятий;
• сильная озабоченность и беспокойство о ребенке, страх навредить ему либо, напротив, отсутствие интереса к новорожденному;
• мысли о самоубийстве (Stevens, 2010)
Кто же попадает в группу риска, наиболее уязвимую в отношении развития материнской депрессии? Естественно, в первую очередь те женщины, в истории болезни которых имеются эпизоды депрессии или иных психиатрических расстройств. Однако были выявлены и другие социальные группы с высокой встречаемостью патологии. Так, заболевание чаще встречается у матерей-одиночек, безработных, рожениц подросткового возраста, в случаях незапланированной беременности или тяжелого ее протекания (Lanzi et al., 2009; Micali et al., 2011).
На психологическом состоянии молодой матери негативно сказывается и повышенный уровень стресса во время беременности, жестокость в семье. В послеродовой период женщина часто находится в состоянии своего рода социальной и информационной изоляции, поскольку основную массу усилий и времени посвящает новорожденному. Поэтому важную роль играет уровень социальной поддержки (взаимоотношения с друзьями, родственниками и, особенно, отцом ребенка), а также условия трудовой деятельности матери, т. е. ее обеспеченность декретным отпуском и возможность работы по свободному графику (Cooklin et al., 2011).
Стоит отметить, что чаще других страдали послеродовой депрессией женщины, затронутые трагическими нью-йоркскими событиями 11 сентября 2001 г. (Gershoff et al., 2010), а также подвергшиеся воздействию урагана Катрина в августе 2005 г. (Savage et al., 2010).
Наконец, к факторам, провоцирующим болезнь, можно отнести физическое состояние роженицы, в том числе наличие послеродовых швов, трудности с отправлением естественных надобностей после родов и даже отсутствие комфорта в больничной палате! Молодые матери часто переживают и за состояние своей фигуры, болезненно воспринимая ее неизбежные изменения в результате родов и кормления ребенка (LaCoursiere et al., 2010).
Свою лепту в провоцирование депрессии вносит и наличие никотиновой или иной зависимости. В некоторых случаях прослеживается связь развития послеродовой депрессии с диетой женщины, например, с уровнем поступления в ее организм омега-3 жирных кислот или морепродуктов (Levant, 2011; Miyake et al., 2011). Эти факторы подтверждают мнение, что разнообразный полноценный пищевой рацион благоприятно сказывается на течении беременности в целом.
При этом важно понимать, что в случае родовой депрессии страдает здоровье не только матери, но и ребенка! Развитие этой болезни чревато нарушениями в питании матери и несоблюдением медицинских предписаний по уходу за собой и за новорожденным. Женщины, страдающие послеродовой депрессией, часто неадекватно оценивают эмоциональные реакции собственного ребенка, особенно негативные (Stein et al., 2010).
Нарушение взаимодействия между матерью и ребенком может привести в будущем к отклонениям в его физическом, умственном и эмоциональном развитии. В частности, к нарушениям сна в возрасте до года (Pinheiro et al., 2011), развитию депрессивности, расстройств внимания, повышенной возбудимости (Calvarino et al., 2010; Tompson et al., 2010), а также снижению коэффициента умственного развития в подростковом возрасте (Fishnell, 2010). Однако долгосрочных исследований взаимоотношений «депрессивная мать–ребенок» не очень много, и итоги их разнятся.
Нейрофизиология родительской заботы
Очевидно, что для эффективного поиска способов лечения послеродовой депрессии и нарушений родительского поведения необходимо иметь представление о нейробиологических механизмах формирования материнской мотивации. Поскольку проводить подобные исследования на людях крайне сложно, для этой цели используют экспериментальных животных, в первую очередь грызунов. На основе этих моделей удалось обнаружить весьма обширную сеть мозговых структур, принимающих участие в формировании материнского поведения, и эти же самые структуры ответственны за развитие послеродовой депрессии.
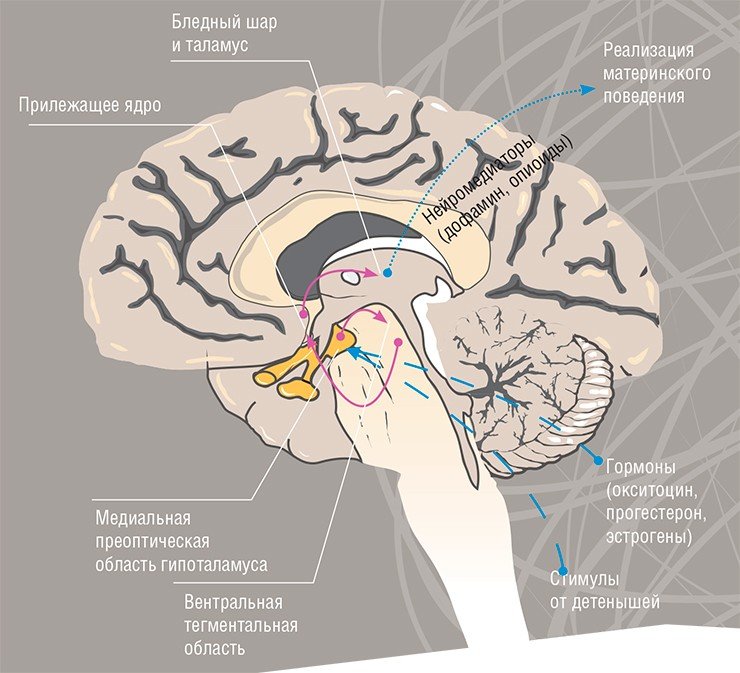
Материнское поведение – забота о потомстве, взаимодействие с новорожденными, формируется у млекопитающих благодаря активности таких областей мозга, как гипоталамус (важнейшей из «древних» структур головного мозга, ответственной за врожденные поведенческие программы), вентральная часть покрышки среднего мозга и базальные ганглии больших полушарий. Эти структуры не только специфически активируют материнское поведение, но и подавляют конкурирующие мотивационные состояния, такие как реакция избегания детенышей (Brunton, Russel, 2008).
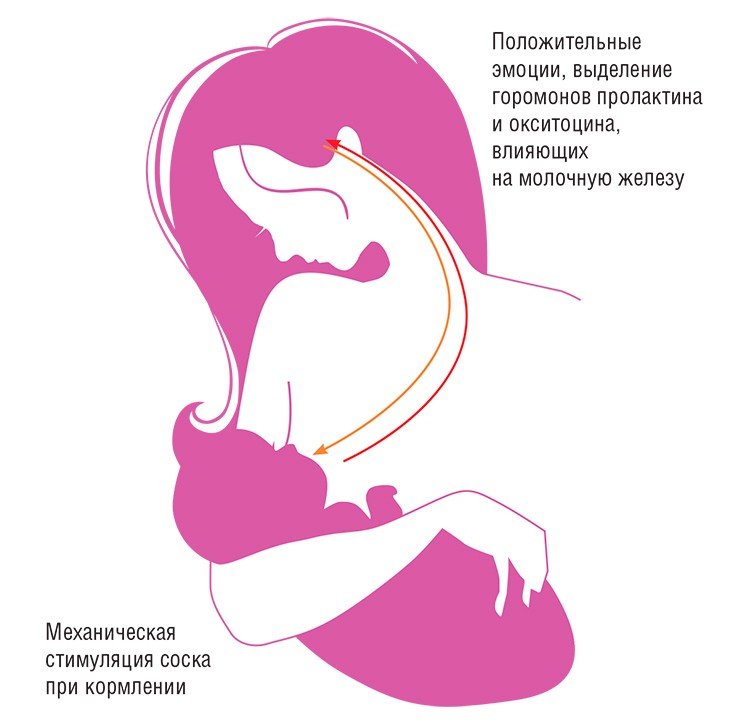
Запуск программы родительской заботы происходит на соответствующем гормональном фоне, а также под воздействием других внутренних сигналов и сигналов из внешней среды, включая стимулы, поступающие от детенышей. Дело в том, что детско-родительские отношения – это сложная система с большим количеством обратных связей. Например, при кормлении детеныша в результате механической стимуляции соска в кровь матери выделяются гормоны пролактин и окситоцин. Мать при этом испытывает положительные эмоции – так работает нервно-эндокринная дуга, способная в течение долгого времени поддерживать материнское поведение. В свою очередь, мать влияет на новорожденного через физиологически активные компоненты грудного молока.
Важнейшую роль в регуляции материнского поведения выполняет нейромедиатор дофамин («гормон удовольствия»), который вырабатывается нейронами мозговых структур, в данном случае – нейронами тегментальной области среднего мозга.
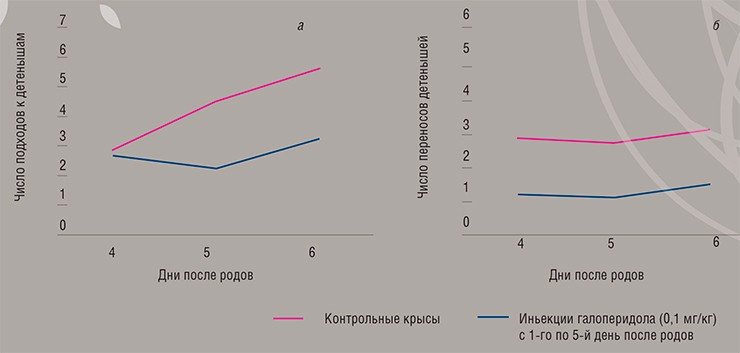
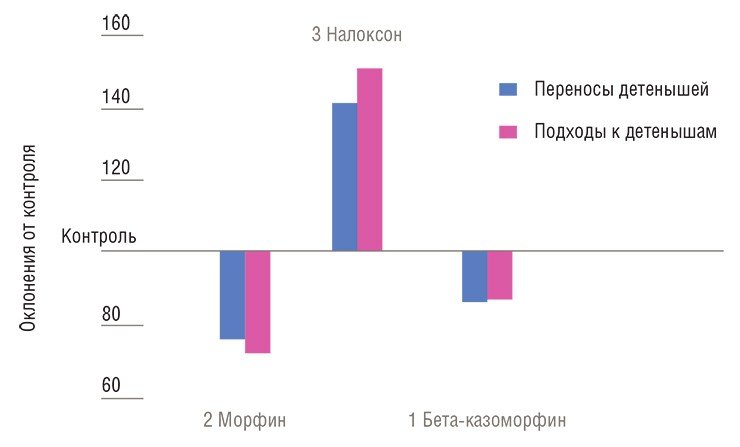
На экспериментальных животных моделях показано, что введение кормящим самкам антагонистов или блокаторов дофамина негативно отражается на таких аспектах материнского поведения, как перенос детенышей и строительство гнезда (Giordano et al., 1990; Stern, Keer, 1999; Добрякова и др., 2005). При хроническом введении кормящим самкам подобных фармакологических препаратов происходит длительное, стабильное нарушение функционирования дофаминовой нейромедиаторной системы, соответствующее клиническим данным при послеродовой депрессии.
ЧЕТВЕРОНОГИЕ «МОДЕЛИ» Исследования нейробиологических механизмов развития материнской депрессии проводить на людях крайне сложно, поэтому основные данные получены при использовании экспериментальных животных, в первую очередь грызунов. Конечно, лабораторная крыса не может ответить на вопросы анкеты, но депрессивно-подобные отклонения в ее поведении зарегистрировать можно.Для моделирования состояния послеродовой депрессии кормящим самкам вводят различные вещества, например, нейролептики. Хроническое введение таких препаратов приводит к стабильному нарушению функционирования нейромедиаторных систем и соответствующим изменениям материнского поведения.
Одним из симптомов депрессии является агедония – снижение способности получать удовольствие. Человеку в таком состоянии даже коробка любимых конфет не принесет радости. Крысы тоже любят сладкое и в норме выбирают поилку с раствором сахарозы, а не обычную воду. У животного в депрессии такое предпочтение формироваться не будет. Психическое состояние особи можно оценить и в тесте «принудительное плавание», когда животное на 10—15 минут помещают в емкость с водой. Здоровая особь в такой ситуации будет активно плыть, барахтаться и карабкаться на стенки сосуда. Животное, находящееся в депрессии, будет склонно к «пассивному плаванию».
Для оценки взаимодействия самки с новорожденными используют тестирование в «открытом поле» – круглой арене, окруженной стенкой, в центре которой помещают детенышей. После этого регистрируются все акты материнского поведения: подходы к детенышам, перенос их из центра на более безопасную, с точки зрения матери, периферию и т. п.
Важную роль в системе подкрепления и выработки положительных эмоций, помимо дофаминовой, играет опиоидная система мозга. При формировании материнского поведения ее активность в медиальной преоптической области гипоталамуса понижается; соответственно, ее стимуляция (например, инъекции морфина в эту область мозга) приводит к поведенческим нарушениям. Не только морфин, но и другие агонисты («стимуляторы») опиоидных рецепторов также нарушают материнское поведение у белых крыс (Добрякова и др., 2011).
Подводная часть айсберга
Понимание нейробиологических основ материнского поведения дает нам основу для выявления глубинных причин его нарушения и механизмов появления послеродовой депрессии. Гипотезы относительно этих причин также проверяются на лабораторных «крысиных» моделях.
Как уже упоминалось выше, в группу риска по родовой депрессии входят женщины, у которых ранее уже наблюдались депрессия или другие расстройства психики. Это свидетельствует о возможной генетической предрасположенности к депрессии вообще и к послеродовой депрессии в частности. И действительно, низкая выраженность родительских реакций и признаки общей депрессивности были обнаружены у крыс линии WAG/Rij, характеризующихся наследственно закрепленными нарушениями поведения (Dobryakova et al., 2008; Sarkisova et al., 2010).
Еще один пример – крысы линии Flinders Sensitive, врожденно предрасположенные к депрессии. Оказалось, что контакт с новорожденными не вызывал у них роста концентрации дофамина в прилежащем ядре мозга – структуры, входящей в мозговой «центр удовольствия», стимулирование которого вызывает чувство наслаждения (Lavi-Avnon et al., 2008). При этом другие подкрепляющие стимулы (например, питье воды при жажде) приводили у них к нормальной секреции дофамина и, соответственно, появлению чувства удовольствия.
Однако сбои в работе нервной системы могут определяться не только врожденной предрасположенностью, но и воздействием нейротоксических веществ на раннем (внутриутробном) этапе развития организма будущей матери. Так, в исследованиях, проведенных авторами, беременным самкам крыс вводили вальпроат натрия. Известно, что это вещество вызывает нарушения формирования центральной нервной системы эмбрионов, что приводит к появлению у этих особей в будущем определенных психических отклонений (в частности, аутизма). Изучение потомства матерей, подвергнутых токсическому воздействию, показало, что их дочери успешно приносили потомство, однако уровень родительской заботы у них был действительно существенно ниже.
Выше уже упоминалось о провоцирующей роли хронического стресса в развитии послеродовой депрессии. Известно, что такой стресс сопровождается повышением активности системы нейронов, секретирующих гормон и нейромедиатор норадреналин. Как и дофамин, норадреналин снижает активность нейронов тегментальной области мозга и, соответственно, оказывает аналогичные негативные эффекты на материнское поведение (Numan, Insel, 2003).
При этом следует отметить, что кратковременный (ситуативный) стресс способен, напротив, усиливать материнские «чувства». Например, родительские реакции крыс активируются при более яркой (т. е. более стрессогенной для животных) освещенности арены в тесте «открытое поле». В таких условиях, очевидно, проявляет себя принцип доминанты, сформулированный еще великим российским физиологом А. А. Ухтомским. Согласно нему, в ситуации, когда поведение особи преимущественно определяется материнской мотивацией, любой дополнительный сенсорный стимул способен еще больше усиливать ее проявление.
Провокатором послеродовой депрессии может стать и так называемая гормональная абстиненция. Дело в том, что в организме женщины во время беременности продуцируются в больших количествах женские половые гормоны, эстрогены и прогестерон. Помимо всего эти гормоны воздействуют на мозг, регулируя активность нейромедиаторных систем и нервных центров (Brunton and Russel, 2008). Сразу же после родов уровень женских половых гормонов в крови резко снижается.
Для проверки гипотезы о влиянии гормональных изменений на возникновение послеродовой депрессии самкам крыс хронически инъецировали прогестерон и эстрадиол, что имитировало нормальный гормональный фон при беременности (Stoffel and Craft, 2004). После отмены препаратов у животных был зафиксирован относительный рост депрессивных проявлений.
Лечить или не лечить?
Для лечения послеродовой депрессии слабой степени тяжести, очевидно, достаточно обычной психотерапии. В этом смысле огромное положительное влияние оказывают участие и поддержка близких, особенно, супруга. Однако не менее чем в четверти случаев требуется медикаментозная терапия.
При этом необходимо учитывать, что чаще всего заболевание развивается на фоне грудного вскармливания, поэтому воздействию препаратов будет подвергаться не только мать, но и ребенок. Так, концентрация галоперидола в крови матери при его хроническом применении будет лишь в два раза выше, чем в ее молоке (Whalley et al., 1981).
Современная лекарственная терапия послеродовой депрессии направлена, в первую очередь, на регуляцию активности дофаминергической и серотонинергической систем мозга при помощи антидепрессантов. Чаще всего используются препараты, для которых не имеется клинических данных об их отрицательном воздей-ствии на развитие ребенка при продолжении грудного вскармливания, например, бупропион (Fishnell, 2011). Однако препаратов, для которых было бы достоверно показано отсутствие какого-либо негативного влияния на потомство, пока не существует.
Таким образом, женщине приходится выбирать между продолжением грудного вскармливания и приемом антидепрессантов. При этом отлучение ребенка от груди, помимо всего прочего, означает, что он не будет получать физиологически активных веществ, содержащихся в молоке, в том числе бета-казоморфинов, которые уменьшают беспокойство и подверженность стрессам. То есть ребенок проигрывает в любом случае.
В такой ситуации чрезвычайно актуальным становится поиск фармакологических способов коррекции послеродовой депрессии, оказывающих минимальное влияние на ребенка. К счастью, на сегодня известно несколько групп веществ, перспективных с этой точки зрения. Среди них – женские гормоны. Как выше упоминалось, материнская депрессия во многом имеет ту же природу, что и депрессия в период менопаузы, обусловленная снижением выработки эстрадиола (Moses-Kolko et al., 2009). Справиться с подобными состояниями могут подкожные инъекции этого гормона, однако исследований по проверке безопасности для матери и ребенка долговременного введения эстрогена пока нет.
Выше упоминалось, что уровень родительской мотивации снижается под действием морфина и его производных. Соответственно, активировать материнские реакции можно с помощью налоксона, антагониста опиоидных рецепторов, который обычно используют в случае острой интоксикации опиатами. Это было подтверждено опытами на самках крыс, у которых введение даже низких доз налоксона увеличивало число контактов с детенышами (Добрякова и др., 2005).
Более того, оказалось, что налоксон может снимать основные негативные эффекты не только опиоидов, но и блокаторов рецепторов «гормона счастья» дофамина, что также способствует нормализации материнского поведения.
Оптимальный и одновременно эффективный способ введения налоксона – интраназальный, т. е. через нос. Дело в том, что при всасывании через эпителий носовой полости часть препарата попадает непосредственно в мозг, минуя системный кровоток. Благодаря этому можно значительно снизить количество вводимого вещества, уменьшив его побочные эффекты. Безусловно, чтобы рекомендовать налоксон для терапии послеродовой депрессии, необходимы дальнейшие тщательные исследования, однако уже имеющиеся результаты дают весомые основания для оптимизма.
В настоящее время изучаются и возможности коррекции послеродовой депрессии путем воздействия на опиоидную систему. Например, блокада рецепторов холецистокинина, одного из модуляторов опиоидергической регуляции материнской мотивации, усиливает вызванные морфином нарушения родительских реакций у крыс (Miranda-Paiva et al., 2002). Следовательно, этот нейропептид и его производные можно рассматривать в качестве фармакологических агентов, потенциально способных корректировать послеродовую депрессию. Аналогичные предположения существуют и в отношении других пептидных препаратов – модуляторов поведения, например, фрагментов и аналогов адренокортикотропного гормона и вазопрессина.
Очевидно, что проблему послеродовой депрессии нужно решать, действуя сразу в двух основных направлениях. Во-первых, проводить разъяснительную работу как среди будущих матерей, так и врачей относительно важности ранней диагностики заболевания. Наиболее эффективной стратегией, по-видимому, следует считать проведение опросов среди женщин не психиатрами, а обычными врачами-специалистами (гинекологами и педиатрами), которых женщины регулярно посещают в до- и послеродовой период. Выявление патологии на ранней стадии позволит справиться с ней более результативно и, возможно, без применения фармакологических препаратов.
Второе актуальное направление – поиск новых методов лечения, в частности, внедрение в медицинскую практику новых лекарственных препаратов, принципиально отличающихся от современных антидепрессантов. К сожалению, пока специализированных препаратов для коррекции послеродовой депрессии не найдено. В этой связи необходимо детально изучить действие налоксона (опиоидного антагониста), низких доз эстрогенов и стимуляторов рецепторов дофамина.
Механизмы, управляющие интенсивностью родительской заботы, также еще нуждаются в уточнении. Кроме того, необходимо получить достаточную информацию относительно долгосрочного влияния материнской депрессии на развитие ребенка, для чего в первую очередь следует создать интегрированные базы данных крупных медицинских центров.
Литература
Добрякова Ю. В., Танаева К. К., Дубынин В. А. и др. Роль дофаминовой и опиоидной систем в регуляции материнского поведения // Успехи физиологических наук. 2011. Т. 42, № 1. С. 3—17.
Brunton P. J., Russell J. A. The expectant brain: adapting for motherhood // Nat. Rev. Neurosci. 2008. V. 9, N 1. P. 11—25.
Numan M., Insel T. R. The neurobiology of parental behavior // New York: Springer, 2003. 418 p.
Tompson M. C., Pierre C. B., Boger K. D. et al. Maternal depression, maternal expressed emotion, and youth psychopathology // J. Abnorm. Child. Psychol. 2010. V. 38, N 1. P. 105—117.
В публикации использованы фото из архива авторов