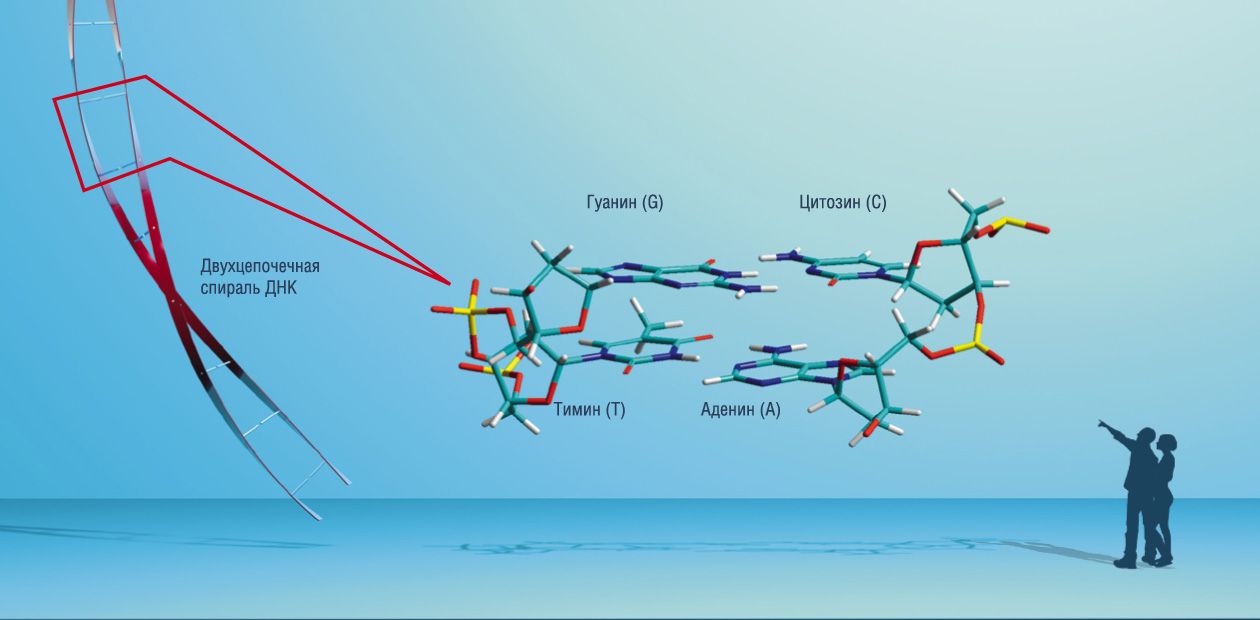
Комплементарные здоровью. Прошлое, настоящее и будущее антисмысловых технологий
В начале 1960-х гг. Сибирь стала «колыбелью» принципиально нового направления в молекулярной биологии и фармакологии, намного опередившего свое время. Идея, реализованная группой новосибирских исследователей под руководством Д. Г. Кнорре, состояла в создании биологически активных веществ, направленных непосредственно на генетические мишени – ДНК и РНК. Такими веществами стали олигонуклеотиды – фрагменты нуклеиновых кислот, способные специфически связываться с комплементарными им последовательностями. С помощью таких «антисмысловых» препаратов стало возможным подавлять размножение бактерий и вирусов, а также регулировать работу генов в клетках высших организмов, в том числе в опухолевых клетках.
В наши дни разработкой и синтезом олигонуклеотидов и их модифицированных аналогов занимается большой исследовательский и индустриальный сектор экономики. Созданные на их основе противовирусные и противовоспалительные препараты проходит клинические испытания, а некоторые уже используются в медицинской практике. В том числе «на родине» антисмысловых технологий ведутся разработки препаратов, эффективно блокирующих гены, отвечающие за лекарственную устойчивость раковых клеток и патогенных микроорганизмов
На сегодняшний день лекарственные препараты, являющиеся специфичными ингибиторами белков инфекционных агентов или клеток злокачественной опухоли, удалось получить лишь в некоторых случаях и по подсказке природы. Так, для избирательного взаимодействия с определенными белками-ферментами используют искусственные аналоги их субстратов, а для воздействия на раковые клетки – антитела к белкам, находящимся на их поверхности.
Однако к вопросу создания избирательных препаратов можно подойти с другой стороны. Ведь все белки «изготавливаются» на основе соответствующих генетических программ, и если смотреть в корень проблемы, то становится ясно, что именно эти «предшественники» являются идеальными терапевтическими мишенями.
Наследственная информация живых организмов «записана» в последовательности особых природных полимеров – нуклеиновых кислот, дезоксирибонуклеиновой (ДНК) и рибонуклеиновой (РНК). Геномы вирусов и бактерий содержат гены, характерные только для этих организмов. В генах опухолевых клеток имеются мутации, ответственные за их злокачественное перерождение и биохимические нарушения, которые не встречаются в генах нормальных клеток. Именно эти уникальные нуклеотидные последовательности могут быть целевыми объектами для воздействия избирательными лекарственными средствами.
Работу по направленному воздействию на генетические мишени – ДНК и РНК – начала в 1960-е гг. группа химиков и биологов под руководством Д. Г. Кнорре, работавшая в лаборатории природных полимеров (впоследствии – отдел биохимии) Института органической химии СО АН (Новосибирск). Основополагающая идея, сформулированная старшим научным сотрудником лаборатории Н. И. Гриневой, состояла в использовании для этой цели олигонуклеотидо в – фрагментов нуклеиновых кислот, способных образовывать специфические комплексы с комплементарными им нуклеотидными последовательностями.
На старте
Если в биологическую систему, в которой имеется множество (обычно миллионы) молекул разных нуклеиновых кислот, добавить олигонуклеотид, то он образует комплекс только с той нуклеиновой кислотой, в которой имеется комплементарная ему последовательность. Способность узнавать определенные нуклеотидные последовательности означает и способность узнавать гены, поскольку в каждом гене можно найти уникальные, только в нем присутствующие последовательности нуклеотидов.
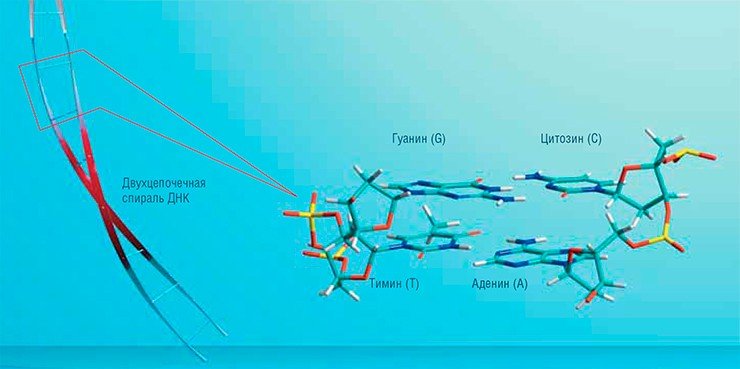
Даже в таком огромном геноме, как геном человека, последовательность из двадцати нуклеотидов статистически встречается только один раз. То есть такой последовательности в принципе достаточно, чтобы избирательно воздействовать на гены человека, а для воздействия на геномы вирусов и бактерий требуются более короткие (12—15-звенные) олигонуклеотиды.
С технической точки зрения, для реализации идеи Н. И. Гриневой требовалось найти уникальную последовательность нуклеотидов в целевой нуклеиновой кислоте, на которую нужно было воздействовать, и синтезировать олигонуклеотид, комплементарный этому участку. В наши дни это не является проблемой, однако для тех времен идея выглядела поистине фантастической: синтезировать олигонуклеотиды тогда еще только учились, поэтому они были запредельно дороги и доступны лишь в очень небольших количествах.
К тому же тогда не существовало еще эффективных методов секвенирования (определения последовательности) нуклеиновых кислот. Никто не мог уверенно предсказать, что возможность быстрой расшифровки структуры генов и, соответственно, поиска генных мишеней, появится в ближайшее столетие.
Однако все эти соображения не стали препятствием необычайному по смелости проекту (нигде в мире в то время подобные работы даже не планировались!), который начала небольшая группа молодых сотрудников и аспирантов института и студентов НГУ. Знания, воля к победе, эффективное планирование и широкое междисциплинарное сотрудничество позволили исследователям быстро продвинуться вперед. Были разработаны технологии синтеза и организовано производство веществ, необходимых для создания фрагментов нуклеиновых кислот. А благодаря созданию методов химической модификации нуклеиновых кислот появилась возможность присоединять к олигонуклеотидам различные химические группы.
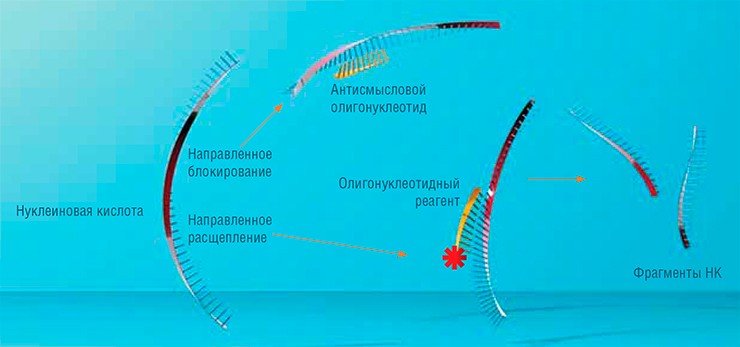
В фундаментальных работах сибирские исследователи показали принципиальную возможность направленного воздействия на нуклеиновые кислоты с помощью олигонуклеотидов, снабженных реакционноспособными группами, которые «работают» в точно заданных участках молекулы-мишени.
При исследовании взаимодействия олигонуклеотидов с живыми клетками было обнаружено, что их можно вводить в организм неповреждающими методами – через кожу и слизистые оболочки. Были идентифицированы белки крови и рецепторы на поверхности клеток, способные захватывать нуклеиновые кислоты. Наконец, была доказана терапевтическая эффективность олигонуклеотидных реагентов, т. е. их способность подавлять размножение вирусов в клетках и, соответственно, развитие вирусной инфекции у животных.
Лекарства «со смыслом»
Первые публикации сибирских исследователей, посвященные потенциальным ген-направленным препаратам и биологическим эффектам, вызываемым олигонуклеотидами, вызвали огромный интерес у специалистов. После проведения в 1988 г. в Новосибирском Академгородке первого в мире симпозиума по этой теме, на который собрались химики и биологи из самых известных зарубежных лабораторий, в работу по «олигонуклеотидной» тематике включились ученые США и Франции, а затем и других стран.
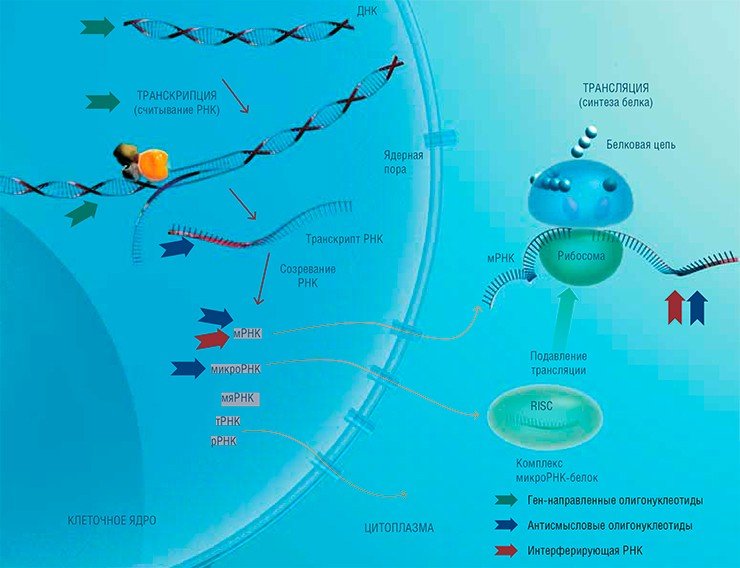
Американцы, поднаторевшие в рекламе, стали называть терапевтические олигонуклеотиды антисмысловыми, а технологии работы с ними – антисмысловыми технологиями. Это странное, на первый взгляд, название появилось потому, что основными мишенями для олигонуклеотидов в то время были матричные РНК, нуклеотидная последовательность которых соответствует смысловому (т. е. кодирующему белок) участку цепи ДНК. Поэтому комплементарные им олигонуклеотиды, блокирующие синтез белка, имеют «антисмысловую» последовательность.
Поданная таким образом идея антисмысловых технологий выглядела просто и красиво, ее можно было легко донести до представителей власти и бизнеса. За технологиями на основе олигонуклеотидов вырисовывалось большое будущее, поскольку специфические препараты для защиты от различных вирусов или уничтожения раковых опухолей можно было быстро разработать и производить по универсальной технологии. Для этого требовалось только расшифровать структуру генов-мишеней, что в то время было уже вполне реальным делом.
В 1987 г. президент США Р. Рейган лично посетил лабораторию в американском Национальном институте рака, где была продемонстрирована противовирусная активность олигонуклеотидов в отношении вируса иммунодефицита человека. Механизм этой активности был позднее раскрыт в совместных работах сибирских ученых и их американских коллег.
В разных странах, в основном в США, были основаны десятки крупных компаний, которые стали разрабатывать различные варианты олигонуклеотидных производных, направленные, в первую очередь, на вирусные РНК и специфические РНК опухолевых клеток. Журналы пестрели статьями, где описывались успешные эксперименты; на научных и медицинских конференциях представители фирм рассказывали о препаратах, уже готовых для испытаний в клинике.
Казалось, волшебные лекарства вот-вот хлынут к страдающим пациентам, однако несмотря на огромный объем проведенных исследований, быстрой победы не получилось. Слишком масштабны оказались химические задачи по синтезу пригодных для терапии олигонуклеотидов, слишком широкие биологические исследования требовалось провести, чтобы понять процессы, запускаемые этими веществами в клетках.
Сенсационные сообщения появлялись все реже, и энтузиазм стал убывать. Маленькие фирмы сошли со сцены, однако крупные фирмы и академические лаборатории продолжили, уже без рекламной шумихи, систематические исследования, шаг за шагом развивая химию и биологию нуклеиновых кислот.
Мир РНК
Исследуя структуру и функции клеточных РНК, ученые открывали все новые и новые процессы, протекающие в клетках под воздействием олигонуклеотидов. Оказалось, что образование комплексов олигонуклеотидов с РНК уже само по себе оказывает большое воздействие на функции последних, а также может приводить к разрушению РНК ферментами клетки, такими как РНКазы.
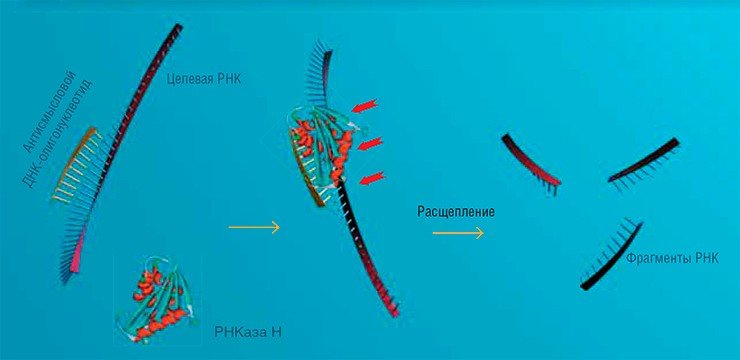
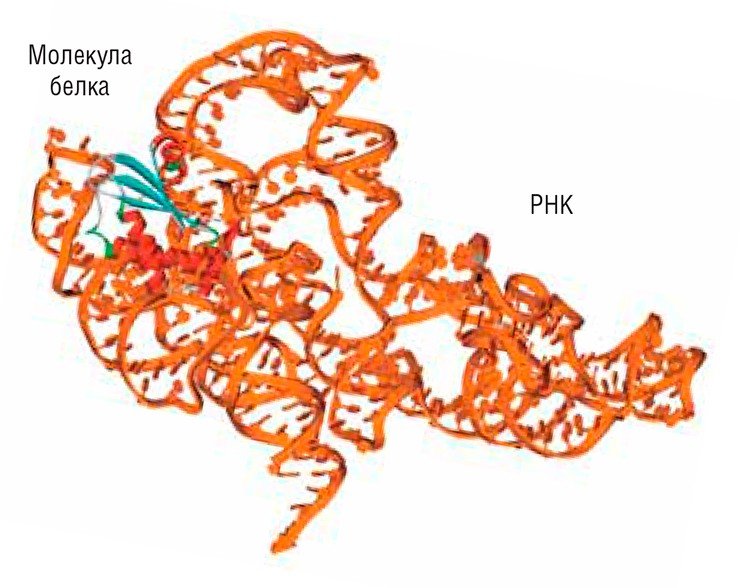
Так, связывание олигонуклеотида с мРНК в месте инициации синтеза белка останавливает процесс трансляции. А некоторые химически модифицированные аналоги олигонуклеотидов образуют с РНК такие прочные комплексы, которые могут блокировать продвижение рибосом по матричной РНК и таким образом полностью подавлять синтез белка. Выяснилось также, что олигонуклеотиды способны связываться не только с РНК, но и образовывать специфические комплексы с некоторыми белками, влияя на множество внутри-клеточных процессов.
Дальнейшее совершенствование методов изучения биополимеров, в том числе взрывное развитие технологий секвенирования ДНК, способствовало стремительному накоплению знаний в области молекулярной и клеточной биологии. Были расшифрованы геномы человека и практически всех известных инфекционных агентов, вирусов и бактерий; открыт ряд мутаций и хромосомных перестроек, связанных с онкологической трансформацией клеток. Произошла и переоценка роли РНК в живых системах: оказалось, что именно эти молекулярные структуры обеспечивают основные регуляторные функции в клетках и, соответственно, вовлекаются в развитие различных патологических процессов.
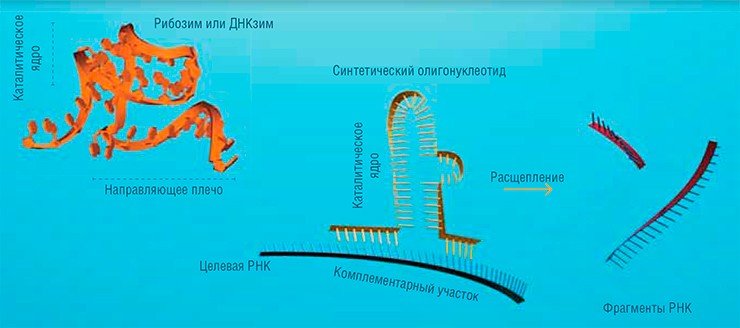
Одним из наиболее удивительных открытий стали рибозимы – молекулы РНК с характерной вторичной и третичной структурой, обладающие, подобно белкам, свойствами ферментов, т. е. способностью катализировать протекание химических реакций. Почти все обнаруженные в природе рибозимы являются рибонуклеазами – ферментами, разрушающими РНК: они, как правило, участвуют в процессах созревания матричной РНК. Если фрагменты каталитического ядра подобных рибозимов встроить в синтетические олигонуклеотиды, то такая конструкция будет по принципу комплементарности связываться с РНК-мишенью и расщеплять ее. Позднее методами молекулярной селекции были созданы ДНКзимы, также способные расщеплять РНК. Но исследователей ждало еще более поразительное открытие: выяснилось, что механизм, предложенный теоретиками для воздействия на генетические программы, уже давно используется природой.
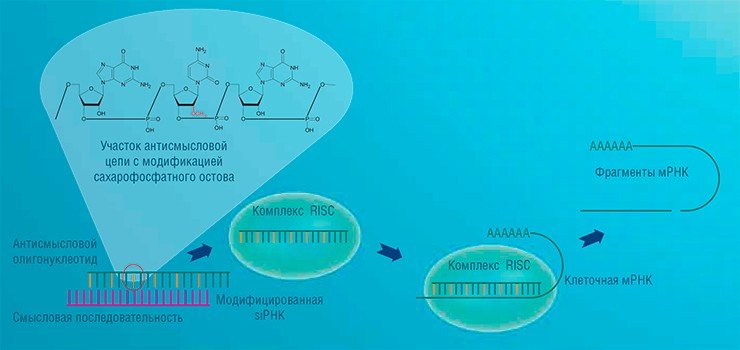
Например, чрезвычайно мощным средством подавления экспрессии генов оказались так называемые малые интерферирующие РНК (siPНК). Они образуются при фрагментировании длинных двухцепочечных или коротких шпилечных РНК, нуклеотидная последовательность которых комплементарна определенной матричной РНК. Связываясь с такой мРНК, siPНК запускают действие ферментативного механизма, разрушающего целевую молекулу.
За расшифровку процесса РНК-интерференции, которая, по сути, сама по себе является «антисмысловой технологией», американские ученые А. З. Файер и К. С. Мелло были удостоены в 2006 г. Нобелевской премии. И, конечно, siPНК могут быть синтезированы искусственно и доставлены в клетку в качестве ген-направленных препаратов.
Нужно подчеркнуть, что регулировать экспрессию генов с помощью олигонуклеотидов можно на различных уровнях. Антисмысловые олигонуклеотиды, комплементарные последовательности мРНК, подавляют экспрессию генов на стадии трансляции. Однако в последние годы внимание исследователей все больше привлекают некодирующие РНК, в том числе так называемые микроРНК, играющие роль регуляторов работы генов.
В этом смысле такие РНК вовлечены практически во все процессы жизнедеятельности организма, в том числе клеточную дифференцировку, канцерогенез и т. п. Именно эти РНК представляют собой важный современный класс мишеней для антисмысловых технологий.
Круг заболеваний, эффективность лечения которых может быть радикально повышена с помощью подобных препаратов, стремительно расширяется. В их числе – тяжелые вирусные, сердечно-сосудистые и раковые заболевания. В частности, уже вторую стадию клинических испытаний прошел миравирсен, препарат против гепатита С, разработанный датской компанией «Santaris Pharma», который представляет собой антисмысловой олигонуклеотид к одной из микроРНК.
Однако в качестве лекарственных препаратов можно использовать не только ингибиторы микроРНК, но и сами эти вещества. Например, в ряде опухолей был обнаружен недостаточный уровень экспрессии определенных микроРНК. В таких случаях можно создать искусственные аналоги этих микроРНК и ввести их в клетку для достижения нужного терапевтического эффекта. Первый подобный препарат для борьбы с гепатокарциномами – MRX34 – разработала и уже вывела на стадию клинических испытаний американская компания «Mirna Therapeutics».
Широким фронтом
В наши дни разработкой и синтезом олигонуклеотидов и их аналогов занимается большой исследовательский и индустриальный сектор экономики. Рынок олигонуклеотидов только для исследовательских целей в прошлом году превысил 700 млн долл. Уже синтезированы десятки новых видов химически модифицированных олигонуклеотидов; созданный на их основе ряд противовирусных и противовоспалительных препаратов проходит клинические испытания, а некоторые из них уже используются в медицинской практике.
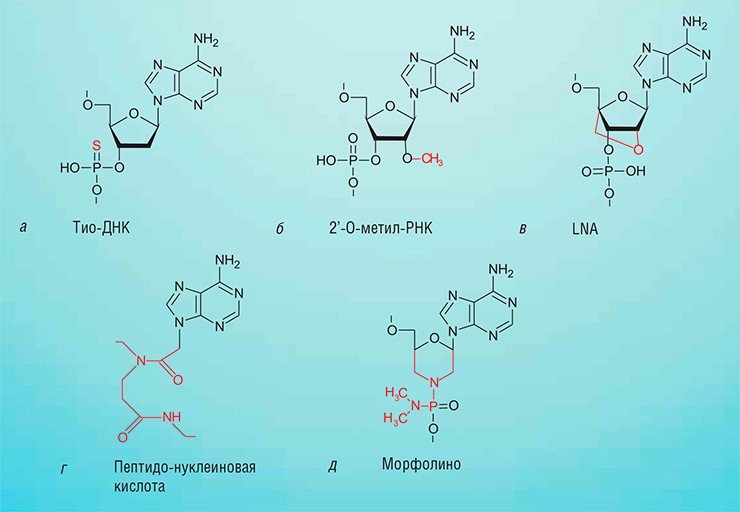
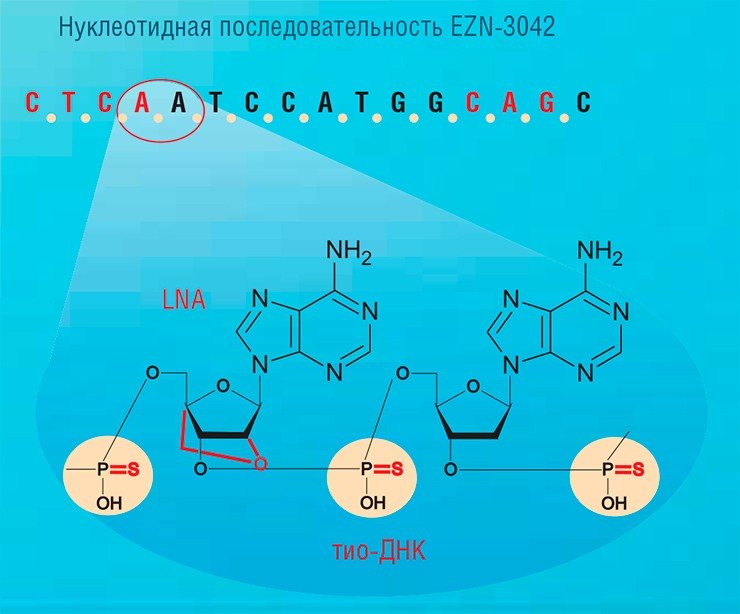
Например, препарат витравин, созданный компанией «ISIS Pharmaceuticals» (США), применяют для лечения больных цитомегаловирусным ретинитом – это поражение глаз возникает при значительном ослаблении иммунной системы в результате заболевания СПИДом, химиотерапии, трансплантации или приема иммуносупрессоров. Препарат представляет собой химически модифицированный олигонуклеотид (тио-ДНК), комплементарный одной из мРНК цитомегаловируса. В начале 2013 г. компания вывела на рынок еще один препарат из этого семейства – кинамро, предназначенный для снижения уровня липопротеидов низкой плотности у больных гомозиготной семейной гиперхолестеринемией, редкого, но очень тяжелого заболевания сосудистой системы.
Одним из мировых лидеров в развитии терапии на основе малых интерферирующих РНК является компания «Alnylam Pharmaceuticals» (США). Созданный там препарат патисиран предназначен для лечения группы тяжелых наследственных заболеваний, связанных с дефектами гена, кодирующего белок транстиретин. Накопление мутантного белка приводит к развитию тяжелых нейропатий и кардиомиопатий, которыми в мире страдают сотни тысяч человек. Патисиран в настоящее время проходит третью (последнюю) стадию клинических испытаний.
Разработаны и успешно проходят клинические испытания и другие препараты на основе siPНК: против вируса гепатита B (разработка компании «Arrowhead Research», США); против адренокортикальной карциномы и вирусов Марбург и Эбола (разработки компании «Tekmira», Канада).
В России исследования интерферирующих РНК сейчас ведутся в основном в Институте химической биологии и фундаментальной медицины СО РАН (Новосибирск). Здесь разработаны и синтезированы препараты РНК, эффективно блокирующие в раковых клетках экспрессию гена множественной лекарственной устойчивости, который обеспечивает этим клеткам защиту от традиционных противоопухолевых препаратов, а также гена c-myc, значимого для размножения опухолевых клеток. На основе полученных результатов планируется создание принципиально новых средств терапии для лечения различных опухолевых и вирусных заболеваний, а также коррекции широкого спектра биохимических нарушений.
Антисмысловые технологии открывают широкие перспективы и на пути борьбы с бактериальными патогенами. Многолетний опыт использования антибиотиков показал, что бактерии очень быстро приобретают лекарственную устойчивость, и достаточно одной единственной мутации, чтобы обесценить огромный труд по разработке нового лекарства. При этом у любой бактерии имеются гены, нарушение работы которых немедленно приводит к ее гибели.
Рационально сконструированный препарат на основе антисмысловых олигонуклеотидов, нацеленный на подобный ген, способен уничтожать бактерии, даже если целевой ген будет содержать не одну мутацию, а три. В ИХБФМ СО РАН сейчас реализуется проект по разработке таких препаратов, направленных против различных патогенов. Эти работы ведутся в сотрудничестве с приглашенным специалистом из США, лауреатом Нобелевской премии по химии (1989 г.), профессором С. Альтманом.
Опыт последних лет подтвердил плодотворность рожденной в Сибири идеи использования фрагментов нуклеиновых кислот в качестве базовых структур для создания ген-направленных биологически активных веществ. Пожалуй, самое замечательное свойство нуклеиновых кислот – программируемость их свойств. Именно это позволяет при создании лекарственного препарата просто записать его «формулу» в виде последовательности нуклеотидов в соответствии со «смысловой» последовательностью гена-мишени. Способ разработки нового лекарственного препарата, таким образом, становится очень прост и рационален.
В заключение хочется добавить, что вклад нуклеиновых кислот в терапевтический «арсенал» не ограничивается антисмысловыми технологиями. Благодаря все той же программируемости они смогли потеснить классические лекарственные препараты «на их поле».
Подавляющее большинство таких препаратов являются ингибиторами различных клеточных белков: ферментов, рецепторов и регуляторов активности генов. Сегодня с помощью методов молекулярной селекции возможно создавать молекулы нуклеиновых кислот с заданными свойствами, в том числе и способностью блокировать функцию любых белков. Такие ДНК и РНК называют аптамерами.
Первый терапевтический аптамер – макуген – уже используется в клинической практике для лечения заболеваний сетчатки глаза, а множество других проходят клинические испытания. В их числе – перспективные антикоагулянты, препараты для борьбы с аутоиммунными и онкологическими заболеваниями. С помощью молекулярной селекции можно получить и каталитически активные аптамеры – аптазимы, т. е. настоящие «нуклеиновые ферменты». И аптамеры, и аптазимы уже применяются в медицинской диагностике.
Но и этим не ограничивается терапевтический потенциал олигонуклеотидов! Как известно, важной составной частью механизма наследственного иммунитета являются клеточные белки – так называемые толл - рецепторы, которые способны специфично узнавать определенные нуклеиновые кислоты, сходные по строению с вирусными. Их взаимодействие запускает в клетке каскад процессов, приводящий к наработке интерферона и активации процессов иммунной защиты в соседних клетках. Поэтому такие РНК и ДНК можно использовать в качестве эффективных иммуностимулирующих средств. Уже сегодня олигонуклеотиды, содержащие соответствующие нуклеотидные последовательности, добавляют к обычным вакцинам для усиления их действия.
Повысить эффективность противоопухолевой терапии раковых заболеваний помогут короткие двухцепочечные ДНК. Дело в том, что такая терапия интенсивно повреждает геномную ДНК раковых клеток, вызывая в ней двухцепочечные разрывы, приводящие к клеточной гибели. Однако ферментативные системы клетки могут распознавать концевые двухцепочечные участки и не менее интенсивно восстанавливать поврежденную ДНК. Поэтому попадание в раковую клетку больших количеств коротких двухцепочечных ДНК, имитирующее массированное повреждение, «отвлекает» клетку от подобного «ремонта».
Возвращаясь к антисмысловым технологиям, нужно добавить, что с помощью модифицированных олигонуклеотидов можно не только блокировать «ненужные» гены, но и вносить в генетические программы точечные мутации, что открывает путь к созданию безопасных методов лечения наследственных заболеваний.
Таким образом, огромный прогресс в развитии терапии нуклеиновыми кислотами, наблюдаемый в последние годы, позволяет надеяться на появление в недалеком будущем безопасных и эффективных лекарств от заболеваний, не поддающихся существующим методам лечения, а также на значительный рост эффективности лечения остальных заболеваний. А поскольку специфический препарат для защиты от поражения любым патологическим агентом можно быстро разработать и производить по универсальной технологии, это значительно облегчает создание средств борьбы с новыми инфекциями и для защиты от биологического оружия.
Литература
Власов В. В. Лекарство для генов // НАУКА из первых рук. 2007. № 2 (14). С. 55—59.
Черноловская Е. Л. РНК-интерференция: клин клином // НАУКА из первых рук. 2008. №1 (19). С. 54—59.
Belikova A. M., Zarytova V. F., Grineva N. I. Synthesis of ribonucleosides and diribonucleoside phosphates containing 2-chloroethylamine and nitrogen mustard residues // Tetrahedron Lett. 1967. N. 37. P. 3557—3562.
Kole R., Krainer A. R., Altman S. RNA therapeutics: beyond RNA interference and antisense oligonucleotides // Nature Reviews Drug Discovery. 2012. V. 11. P. 125—140.
Burnett J. C., Rossi J. J. RNA-based therapeutics – current progress and future prospects // Chemistry Biology. 2012.V. 19. P. 60—71.
Публикация подготовлена при поддержке гранта правительства РФ (проект 14.В25.31.0028) под руководством лауреата Нобелевской премии 1989 г. по химии С. Альтмана